Содержание
- 2. C 6 12,011 IVA группа Строение атома
- 3. Аллотропные модификации углерода и применение
- 4. Химические свойства углерода
- 5. Применение углерода
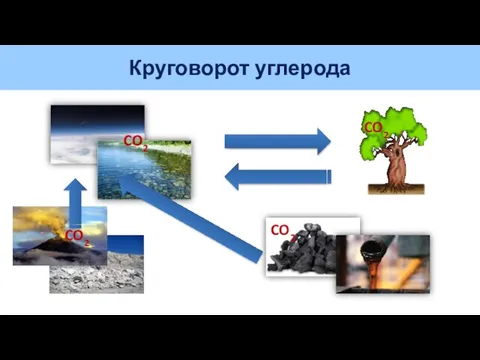
- 6. Круговорот углерода CO2 CO2 CO2 CO2
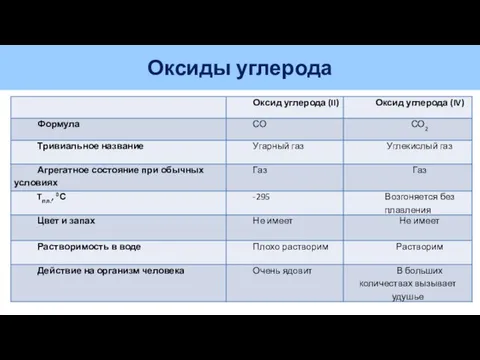
- 7. Оксиды углерода
- 8. Химические свойства оксида углерода (II) Получение СО 2С + О2 (нед) = 2СО +2 Горение в
- 9. сухой лёд При давлении около 60 атм. углекислый газ превращается в бесцветную жидкость. При испарении этой
- 10. Химические свойства CO2 Реакции со щелочами CO2 + Ca(OH)2 = CaCO3↓ + H2O карбонат кальция Качественная
- 11. Химические свойства CO2 Реакции со щелочами CO2 + Ca(OH)2 = CaCO3↓ + H2O карбонат кальция Реакции
- 12. Получение CO2 В промышленности CaCO3 = CaO + CO2↑ t В лаборатории CaCO3 + 2HCl =
- 13. Применение CO2 1 2 3 4 5 1. изготовление шипучих напитков 2. получение соды 3. создание
- 14. Угольная кислота. Карбонаты. Жёсткость воды
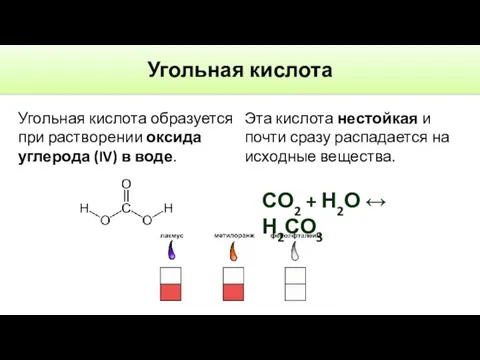
- 15. СО2 + Н2О ↔ Н2СО3 Угольная кислота образуется при растворении оксида углерода (IV) в воде. Эта
- 16. СО2 + Н2О ↔ Н2СО3 Получение угольной кислоты и исследование её свойств
- 17. Свойства угольной кислоты Диссоциация Н2CO3 ↔ H+ + HCO3- HCO3- ↔ H+ + CO32- СаСО3 –
- 18. Соли угольной кислоты В воде растворимы только карбонаты калия, натрия и аммония. Карбонаты других металлов нерастворимы
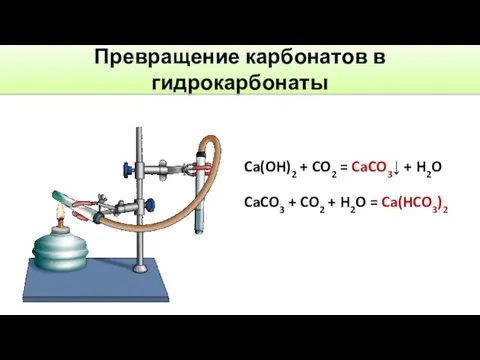
- 19. Превращение карбонатов в гидрокарбонаты Ca(OH)2 + CO2 = CaCO3↓ + H2O CaCO3 + CO2 + H2O
- 20. Жёсткость воды Ca2+ Mg2+ HCO3-
- 21. Образование накипи на стенках котлов, чайников, труб парового отопления.
- 22. Сталактиты и сталагмиты
- 23. Жёсткость воды Ca2+ Mg2+ Cl- SO42- Na2CO3 сода CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
- 24. Качественные реакции на карбонаты и гидрокарбонаты CO32- + 2H+ = H2O + CO2↑ HCO3- + H+
- 25. Применение солей угольной кислоты Na2CO3 · 10H2O кристаллическая сода Na2CO3 кальцинированная сода
- 26. Применение солей угольной кислоты NaHCO3 питьевая сода K2CO3 поташ
- 27. Применение солей угольной кислоты СаСО3 известняк, или мрамор
- 28. Угольная кислота – это двухосновная слабая неустойчивая кислота. Выводы Угольная кислота образуется при растворении в воде
- 30. Скачать презентацию























 Химия душистых веществ. Занятие 1
Химия душистых веществ. Занятие 1 Презентация по Химии "Готовимся к экзамену по химии" - скачать смотреть бесплатно
Презентация по Химии "Готовимся к экзамену по химии" - скачать смотреть бесплатно Нефть Состав, свойства, переработка
Нефть Состав, свойства, переработка  Полиуретаны. Структура и строение
Полиуретаны. Структура и строение Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин) Дисперсные системы
Дисперсные системы Качественный анализ. Таблица растворимости соединений
Качественный анализ. Таблица растворимости соединений Видалення забруднень органічного походження з поверхні тканини
Видалення забруднень органічного походження з поверхні тканини Аммиак
Аммиак Природный и попутный нефтяной газ
Природный и попутный нефтяной газ Три состояния вещества
Три состояния вещества Витамины в нашей еде
Витамины в нашей еде Алюминий
Алюминий  Синтез и реакции пиридазина
Синтез и реакции пиридазина Путешествие в мир углеводородов нефти
Путешествие в мир углеводородов нефти Презентация по Химии "Мир кристаллов медного купороса" - скачать смотреть
Презентация по Химии "Мир кристаллов медного купороса" - скачать смотреть  Окислительно-восстановителые реакции в органической химии
Окислительно-восстановителые реакции в органической химии Нефть и способы ее переработки
Нефть и способы ее переработки Углерод. Кремний
Углерод. Кремний Водородный электрод
Водородный электрод Взаимодействие ускоренных ионов с веществом (часть 1)
Взаимодействие ускоренных ионов с веществом (часть 1) Основные классы неорганических соединений
Основные классы неорганических соединений Обучающий тест «Виды химической связи»
Обучающий тест «Виды химической связи» Полібутадієновий та поліізопреновий каучуки
Полібутадієновий та поліізопреновий каучуки Ситуационная задача по биохимии
Ситуационная задача по биохимии Пятичленные гетероциклические соединения. Профильный уровень
Пятичленные гетероциклические соединения. Профильный уровень Металлы и их соединения
Металлы и их соединения Растительные источники жиров и жирных масел
Растительные источники жиров и жирных масел