Содержание
- 3. Электроотрицательность (ЭО)- это свойство атома оттягивать на себя электроны от других атомов. Условно принята за единицу
- 4. Шкала электроотрицательности Шкала электроотрицательности
- 5. ЭО (с увеличением порядкового номера) в периоде –возрастает в группе уменьшается
- 6. Химическая связь- это взаимодействие, которое связывает отдельные атомы в молекулы. Основным условием образования химической связи является
- 7. Согласно современным представлениям, природа химической связи объясняется взаимодействием полей, образуемых электронами и ядрами атомов, участвующих в
- 8. Химическая связь – это взаимодействие атомов, обусловленное перекрываем их электронных облаков, которое сопровождается уменьшением полной энергии
- 10. Ковалентная связь Ковалентной называют связь, которая возникает в неметаллах в результате образования общих электронных пар. Различают
- 12. Ковалентная неполярная образуется между неметаллами одинаковой ЭО. Например: N2; H2; O2; Общее электронное облако расположено симметрично
- 13. Ковалентная полярная образуется в неметаллах разной ЭО. Общее электронное облако смещено в сторону более электроотрицательного элемента.
- 14. Механизмы образования
- 15. Обменный механизм Общая электронная пара возникает при взаимодействии двух электронов Сl : Cl Донорно-акцепторный Переход существующей
- 16. Ионная связь Это вид связи, возникает под действием электростатических сил притяжения противоположно заряженных ионов. Происходит почти
- 17. Донорно-акцепторный механизм
- 18. Na -1e?Na+ Cl+ e?Cl- Примеры: соли, оксиды металлов
- 19. КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ Существует три агрегатных состояния: любое вещество может быть газом, жидкостью и твердым веществом. Например,
- 20. Агрегатное состояние
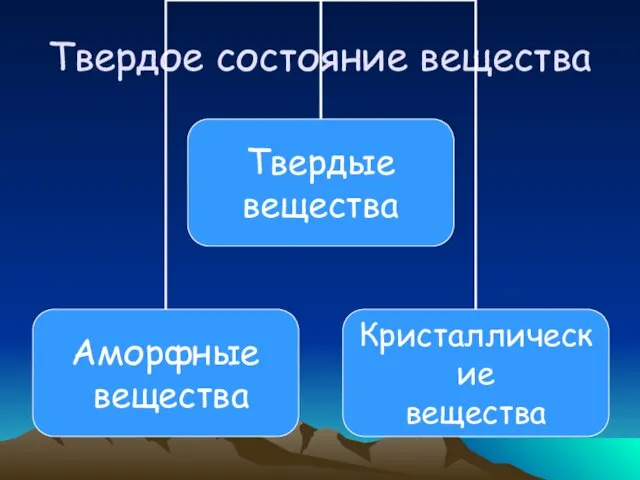
- 21. Твердое состояние вещества
- 22. Аморфные вещества Аморфные вещества не имеют определенной температуры плавления – при нагревании они постепенно размягчаются и
- 23. К аморфным веществам относится: большинство пластмасс Стекло, канифоль, воск, пластилин Шоколад, различные смолы жевательные резинки
- 24. Пластмассы
- 26. Воск
- 28. пластилин
- 29. Шоколад
- 30. Жевательная резинка
- 31. Кристаллические вещества - Имеют строго определенную температуру плавления. - Характеризуются правильным расположением частиц, из которых они
- 32. Узел – точка пересечения линий, соединяющих центры молекул Если соединить эти узлы прямыми линиями, то образуется
- 33. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают
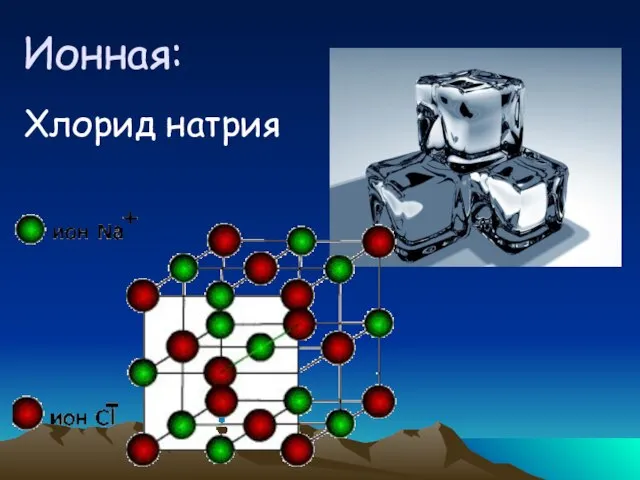
- 34. Ионная: Хлорид натрия
- 36. Ионая кристаллическая решетка В узлах ионы Связи прочные Т пл. высокие Твердые непластичные
- 37. Атомная: Алмаз и графит
- 38. Атомная кристаллическая решетка Связи прочные Т пл. высокие Прочные Твердые Не пластичные Не растворимы в воде
- 39. Молекулярная Йод
- 40. Молекулярная решетка Связи непрочные Т пл. низкие Непрочные Непластичные Мало растворимые
- 41. Металлическая Железо
- 42. Na+ Механизм образования металлической связи Na Na Na Na Na Na Na Na Na+ Na Na+
- 43. Основные физические свойства Металлический блеск
- 44. Основные физические свойства Температура плавления Плотность металлов
- 45. Основные физические свойства Пластичность и ковкость металлов связана со смещением слоев кристаллической решетки относительно друг друга
- 46. Теплопроводность обусловлена большой подвиж-ностью электронов, которые сталкиваясь с колеблющимися атомами и ионами обмениваются с ними энергией.
- 47. Основные физические свойства Электропроводность связана с направлен-ным движением элек-тронов при помеще-нии металла в элек-трическое поле
- 50. Скачать презентацию













































 Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов
Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов Молекулы и атомы. Простые и сложные вещества
Молекулы и атомы. Простые и сложные вещества Lead
Lead Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть
Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть  Алмаз, графит и фуллерен Строковой Натальи 9б
Алмаз, графит и фуллерен Строковой Натальи 9б  Взаимодействие кислоты с основанием
Взаимодействие кислоты с основанием Минералогия и кристаллография
Минералогия и кристаллография Оксид кремния
Оксид кремния Неметаллы. Аллотропия. Куцапкина Людмила Васильевна учитель химии ГБОУ гимназии № 343 Невского района Санкт- Петербурга
Неметаллы. Аллотропия. Куцапкина Людмила Васильевна учитель химии ГБОУ гимназии № 343 Невского района Санкт- Петербурга Рідкісні кристали і полімери. Їх властивості та застосування
Рідкісні кристали і полімери. Їх властивості та застосування Тема урока : Скорость химической реакции
Тема урока : Скорость химической реакции  Презентация Правила безопасности в кабинете химии
Презентация Правила безопасности в кабинете химии Глицерин
Глицерин Контейнерная химия: комплексоны, комплексообразование, применение
Контейнерная химия: комплексоны, комплексообразование, применение Тотығып фосфорлану
Тотығып фосфорлану Оксид серы(VI). Серная кислота
Оксид серы(VI). Серная кислота Явище ізомерії. Структурна ізомерія. Близнюки органічного світу
Явище ізомерії. Структурна ізомерія. Близнюки органічного світу Презентация по Химии "Водні Ресурси" - скачать смотреть
Презентация по Химии "Водні Ресурси" - скачать смотреть  Алюминий, его физические и химические свойства
Алюминий, его физические и химические свойства неметаллы Общая характеристика
неметаллы Общая характеристика Изучение содержания углекислого газа в классном помещении и определение оптимальных условий для проветривания. Муниципальное об
Изучение содержания углекислого газа в классном помещении и определение оптимальных условий для проветривания. Муниципальное об Вода. Свойства воды
Вода. Свойства воды Аттестационная работа. Рабочая программа курса внеурочной деятельности «Химия. Мои первые опыты»
Аттестационная работа. Рабочая программа курса внеурочной деятельности «Химия. Мои первые опыты» Протолитическое равновесие в водных и неводных растворах
Протолитическое равновесие в водных и неводных растворах Методы трансформации карбоновых кислот и их производных
Методы трансформации карбоновых кислот и их производных Простые вещества, металлы
Простые вещества, металлы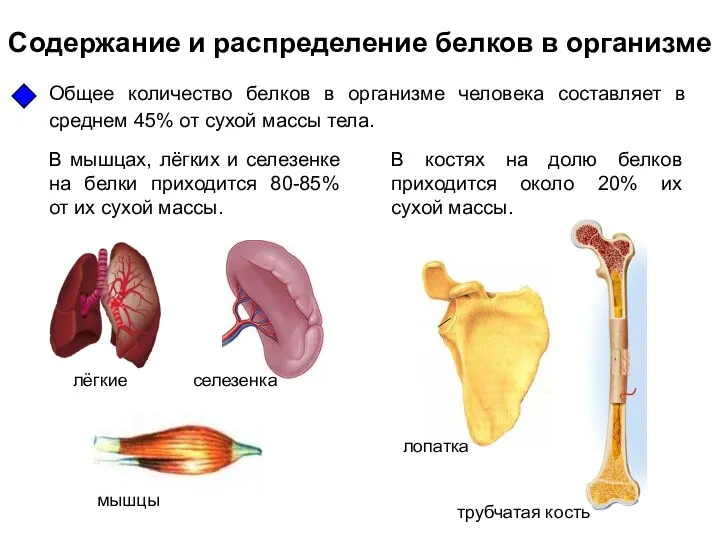 Содержание и распределение белков в организме
Содержание и распределение белков в организме Структурный тип
Структурный тип