Содержание
- 2. Хелатный эффект
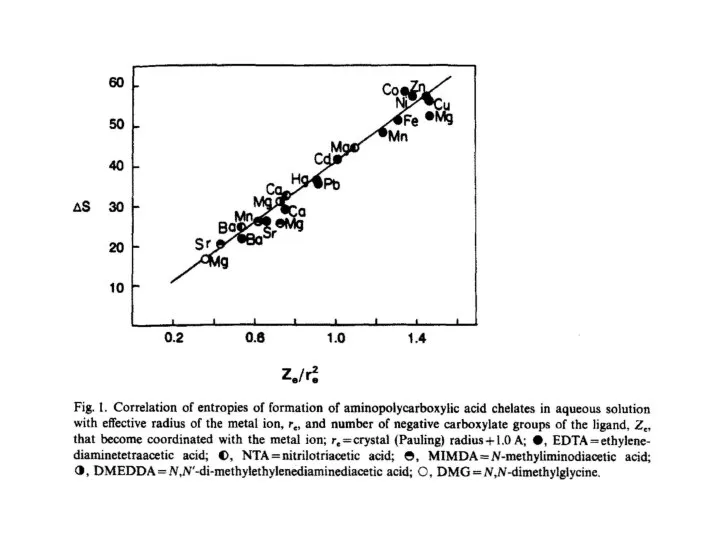
- 3. L ML2 + L-L = M | + 2L L ΔS0 = R·ln55.5 = 33 Дж·моль-1·К-1
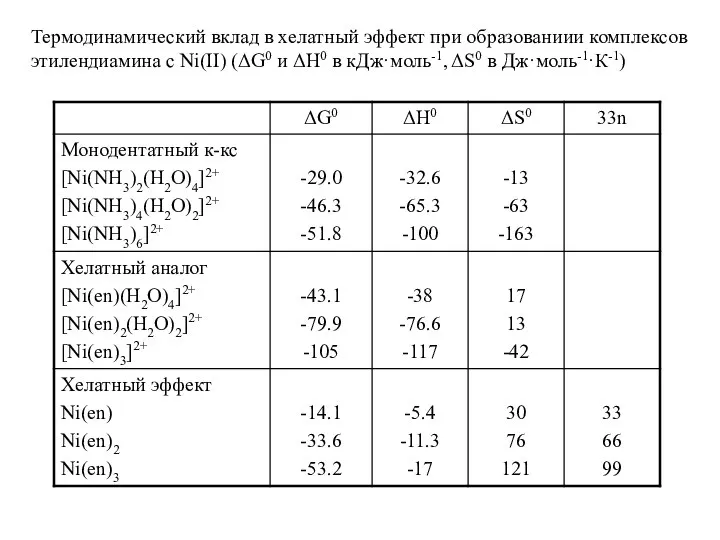
- 4. Термодинамический вклад в хелатный эффект при образованиии комплексов этилендиамина с Ni(II) (ΔG0 и ΔH0 в кДж·моль-1,
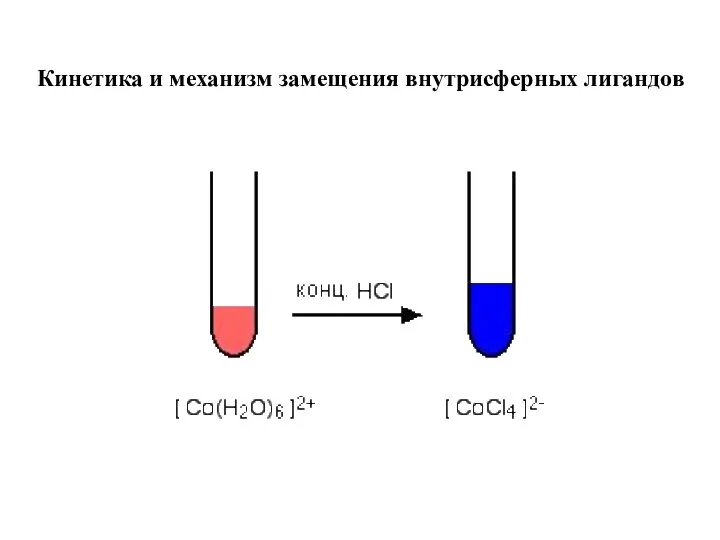
- 6. Кинетика и механизм замещения внутрисферных лигандов
- 7. MLn-1X + Y = MLn-1Y + X Инертные комплексы: t1/2 ≥ 10 c Лабильные комплексы: t1/2
- 8. Механизмы обмена лигандов MLn-1X + Y = MLn-1Y + X 1) Ассоциативный механизм (А) MLn-1X +
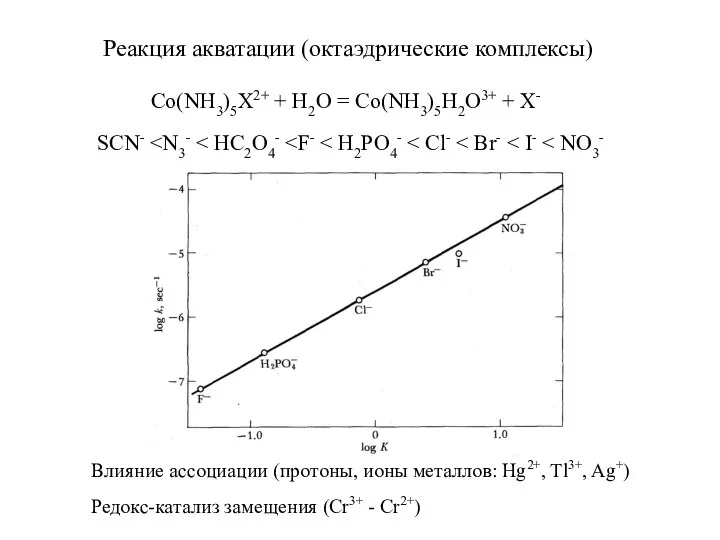
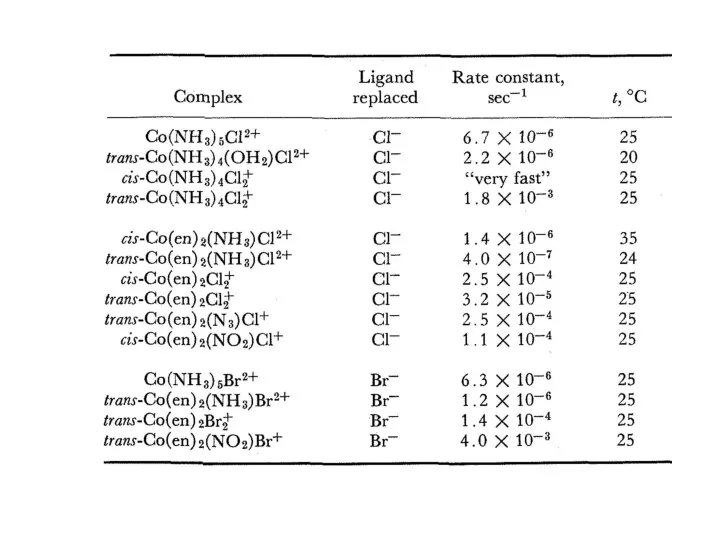
- 9. Реакция акватации (октаэдрические комплексы) Co(NH3)5X2+ + H2O = Co(NH3)5H2O3+ + X- SCN- Влияние ассоциации (протоны, ионы
- 10. Langford C.H., Gray H.B. Ligand Substitution Processes. W. A. Benjamin, Inc., New York. 1965
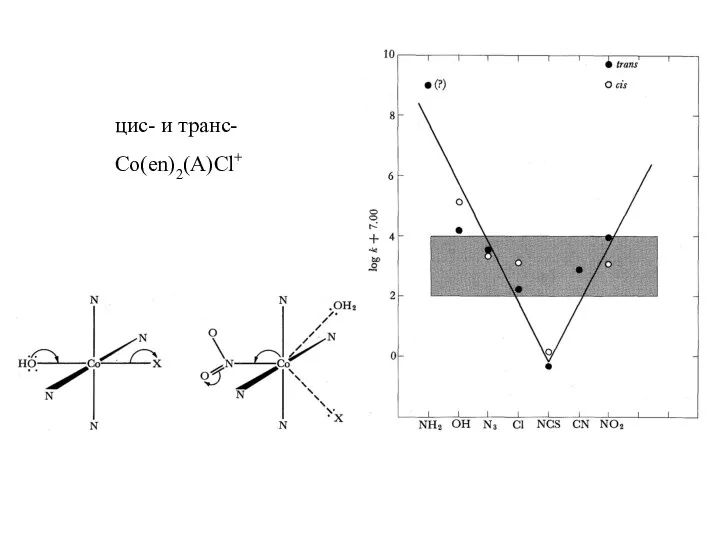
- 12. цис- и транс- Co(en)2(A)Cl+
- 13. Co(NH3)5Cl2+ + OH- = Co(NH3)4(NH2)Cl+ + H2O Co(NH3)4(NH2)Cl+ + H2O → Co(NH3)4OH2+ + Cl- Co(NH3)5F2+ +
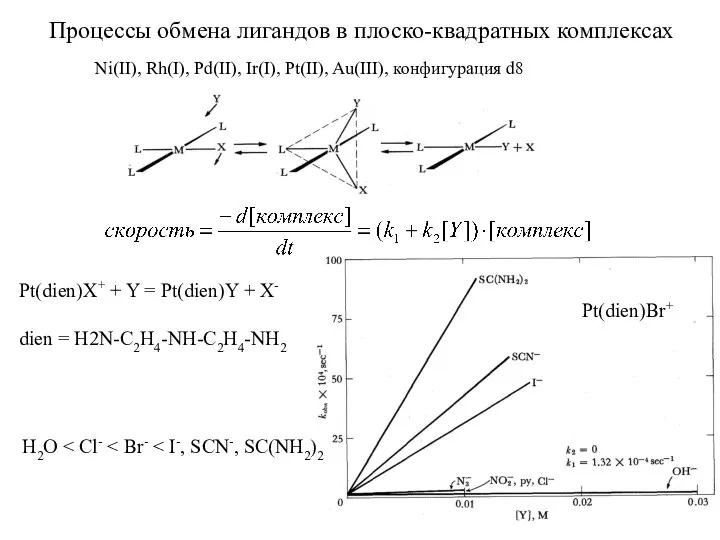
- 14. Процессы обмена лигандов в плоско-квадратных комплексах Pt(dien)X+ + Y = Pt(dien)Y + X- dien = H2N-C2H4-NH-C2H4-NH2
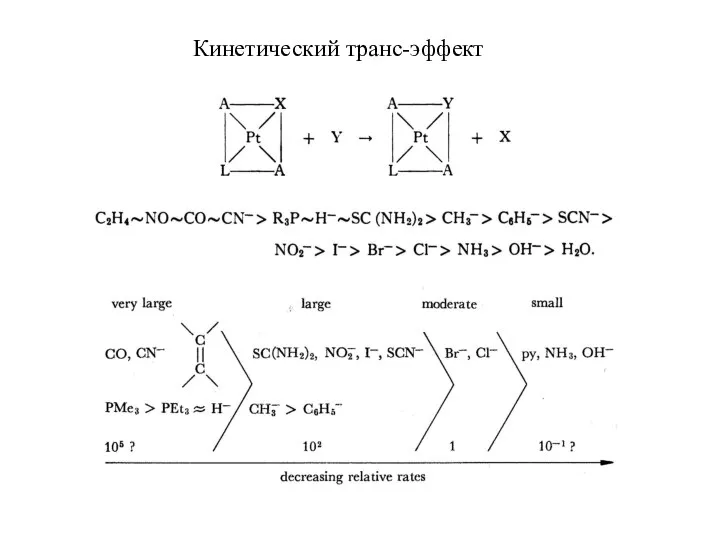
- 15. Кинетический транс-эффект
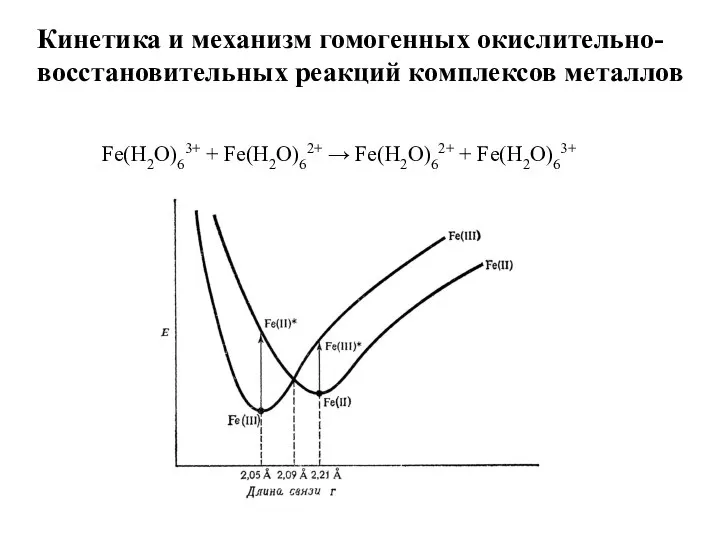
- 16. Кинетика и механизм гомогенных окислительно-восстановительных реакций комплексов металлов Fe(H2O)63+ + Fe(H2O)62+ → Fe(H2O)62+ + Fe(H2O)63+
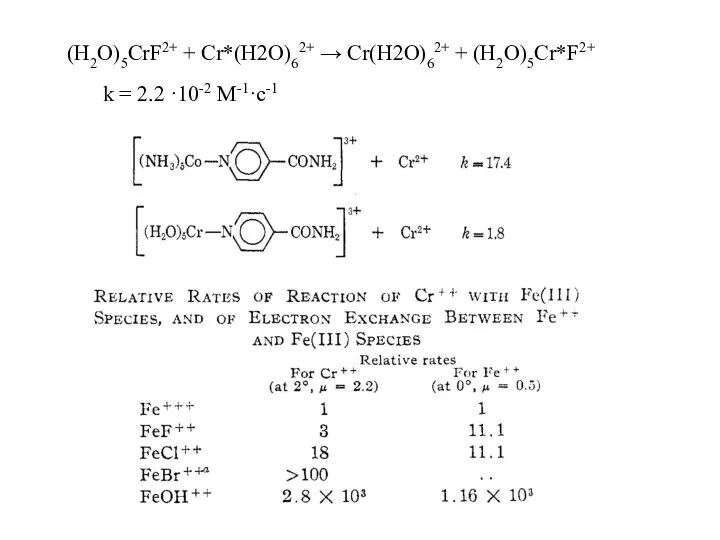
- 18. Co(NH3)63+ + Cr2+ → Co2+ + Cr3+ + 6NH3 k = 10-4 M-1·c-1 внешнесферный механизм Co(NH3)5Cl2+
- 19. (H2O)5CrF2+ + Cr*(H2O)62+ → Cr(H2O)62+ + (H2O)5Cr*F2+ k = 2.2 ·10-2 M-1·c-1
- 21. Скачать презентацию








 Презентация по Химии "Бинарные соединения" - скачать смотреть
Презентация по Химии "Бинарные соединения" - скачать смотреть  Тұздар химиялық қосылыстар класы
Тұздар химиялық қосылыстар класы Металдар мен бейметалдар, олардың қосылыстарының қасиеттерінің период және топ бойынша өзгеруі
Металдар мен бейметалдар, олардың қосылыстарының қасиеттерінің период және топ бойынша өзгеруі Идеальный газ в молекулярно-кинетической теории. Среднее значение квадрата скорости молекул
Идеальный газ в молекулярно-кинетической теории. Среднее значение квадрата скорости молекул Стадии онтогенеза почв
Стадии онтогенеза почв Каучук и резина
Каучук и резина Типы химической связи
Типы химической связи Gas hydrates
Gas hydrates Строение и функция белков
Строение и функция белков Тест по теме «Альдегиды и кетоны»
Тест по теме «Альдегиды и кетоны» Углерод
Углерод Enantioselective Total Synthesis of (+)-Vittatalactone
Enantioselective Total Synthesis of (+)-Vittatalactone Диоксины, глобальные экотоксиканты
Диоксины, глобальные экотоксиканты Биохимия нуклеиновых кислот
Биохимия нуклеиновых кислот Аминокислотный спектр плазмы крови у пациентов с острым миелобластным лейкозом
Аминокислотный спектр плазмы крови у пациентов с острым миелобластным лейкозом Вырожденные фазовые равновесия на экспериментальных t-x диаграммах
Вырожденные фазовые равновесия на экспериментальных t-x диаграммах Химия, как наука. Основные понятия и законы
Химия, как наука. Основные понятия и законы Кристаллохимические радиусы
Кристаллохимические радиусы Презентация по Химии "Кто хочет стать отличником" - скачать смотреть бесплатно
Презентация по Химии "Кто хочет стать отличником" - скачать смотреть бесплатно Углеводы – структура, функции, свойства
Углеводы – структура, функции, свойства Строение вещества. Молекулы
Строение вещества. Молекулы Растворы. Классификация дисперсных систем
Растворы. Классификация дисперсных систем Анализ качества лекарственных и косметических веществ из группы алифатических кислот и аминокислот
Анализ качества лекарственных и косметических веществ из группы алифатических кислот и аминокислот Адсорбционные равновесия и процессы на подвижных и неподвижных границах раздела фаз
Адсорбционные равновесия и процессы на подвижных и неподвижных границах раздела фаз Вторичное квантование. Применение оболочечной модели. Метод Хартри - Фока
Вторичное квантование. Применение оболочечной модели. Метод Хартри - Фока Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти
Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти Механизмы трансформации энергии в фотосинтезе
Механизмы трансформации энергии в фотосинтезе Строение атома
Строение атома