Содержание
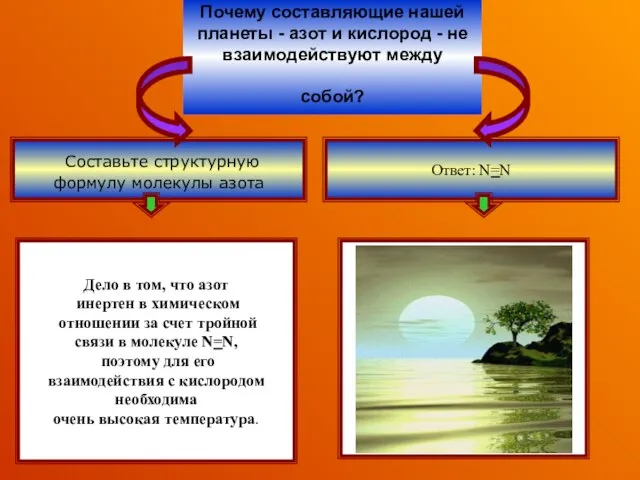
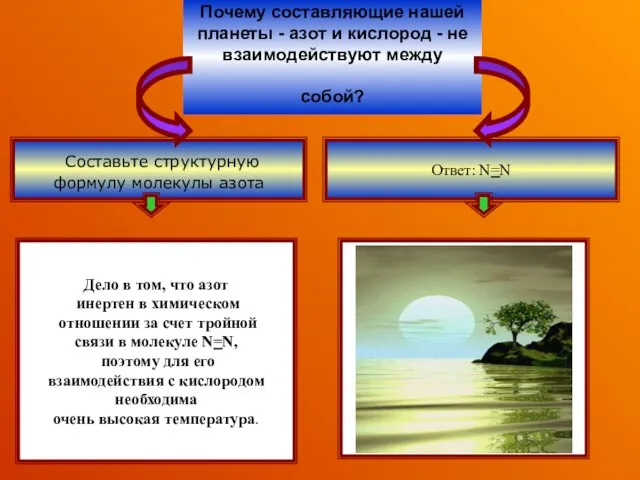
- 2. Почему составляющие нашей планеты - азот и кислород - не взаимодействуют между собой? Составьте структурную формулу
- 3. Почему муравьи хоронят «покойников» через день? Даже мертвые муравьи вырабатывают нечто вроде феромонов. За мертвым муравьем
- 4. Почему воздух после грозы обогащен озоном? Задание: Вычислите, сколько молей озона образуется из 6 моль кислорода.
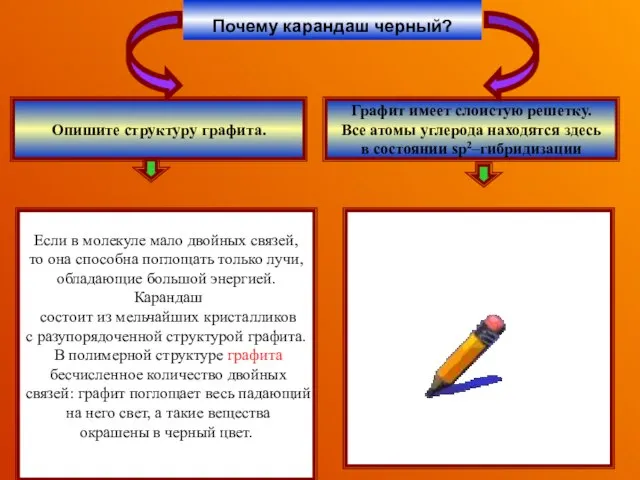
- 5. Почему карандаш черный? Опишите структуру графита. Графит имеет слоистую решетку. Все атомы углерода находятся здесь в
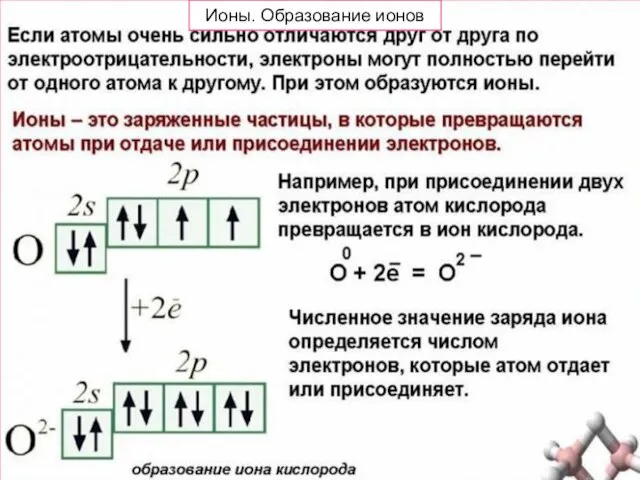
- 8. Ионы. Образование ионов
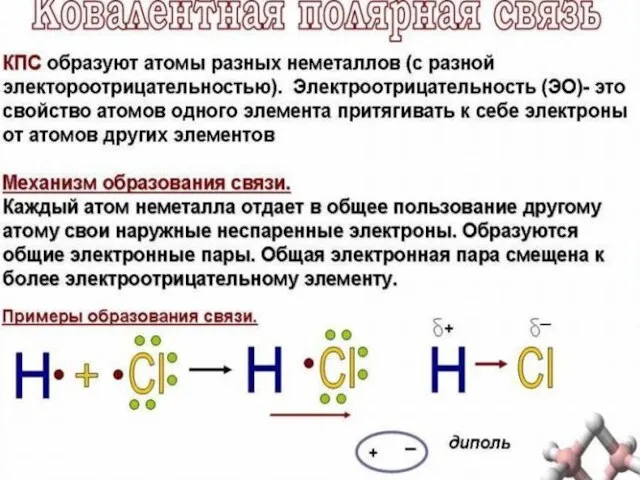
- 11. Если взаимодействуют атомы, которые сильно отличаются по своей электроотрицательности, то объединяющая их молекулярная орбиталь (общая электронная
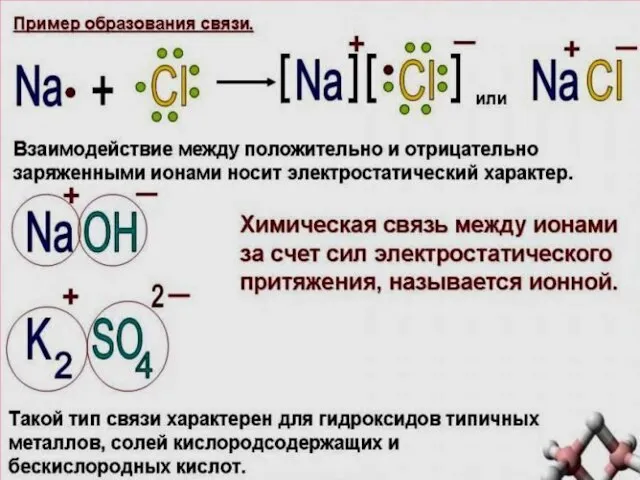
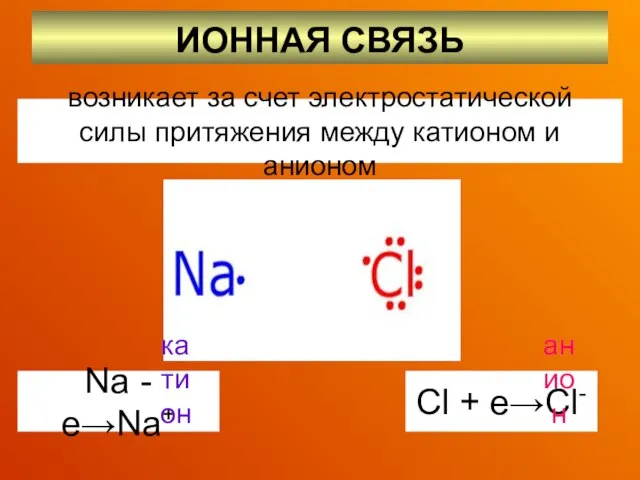
- 12. ИОННАЯ СВЯЗЬ возникает за счет электростатической силы притяжения между катионом и анионом Na - e→Na+ Cl
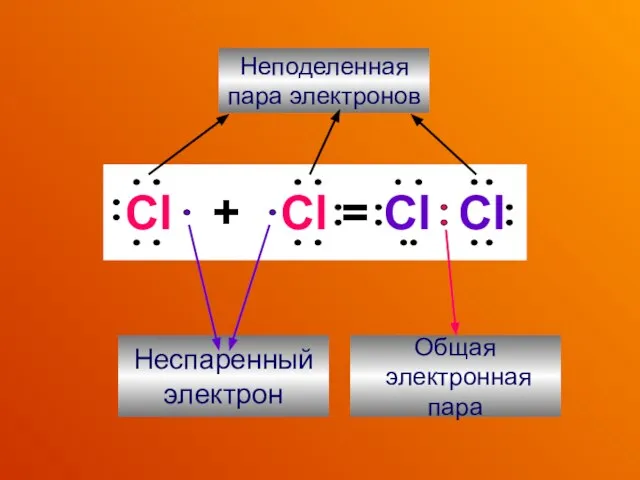
- 15. Cl + Cl = Cl Cl Неспаренный электрон Общая электронная пара Неподеленная пара электронов
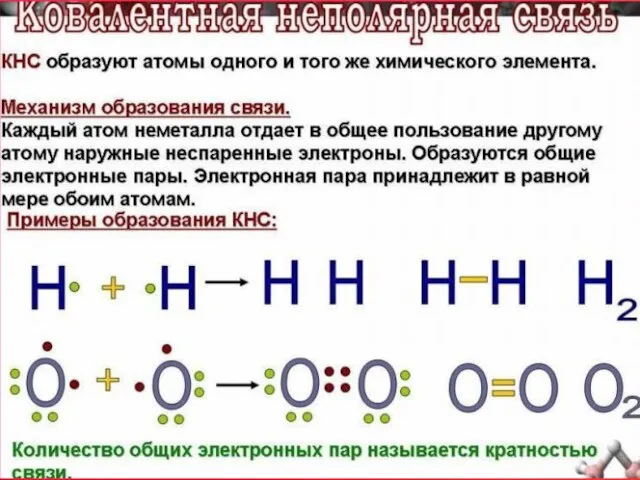
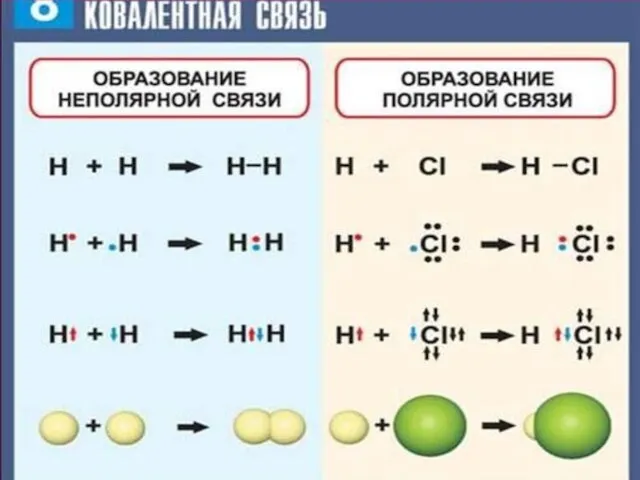
- 17. Механизмы образования ковалентной связи 1. ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали. 2.
- 18. Молекула двухатомна, ковалентные неполярные связи (:N≡N:) :N : . . : N : :N : :
- 19. каждый из атомов предоставляет в общее пользование по одному электрону:
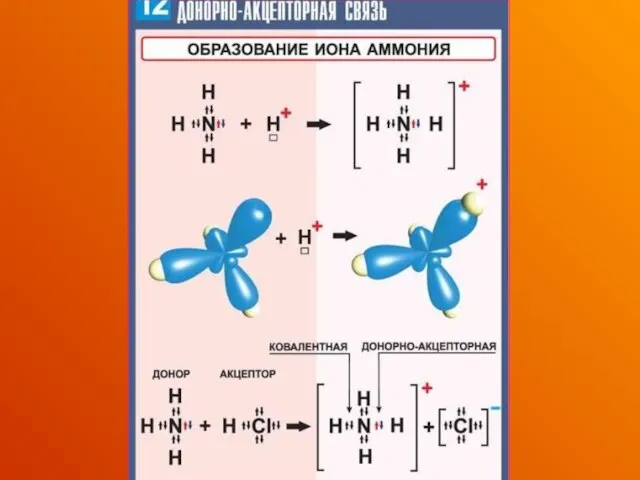
- 20. образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора:
- 25. Почему составляющие нашей планеты - азот и кислород - не взаимодействуют между собой? Составьте структурную формулу
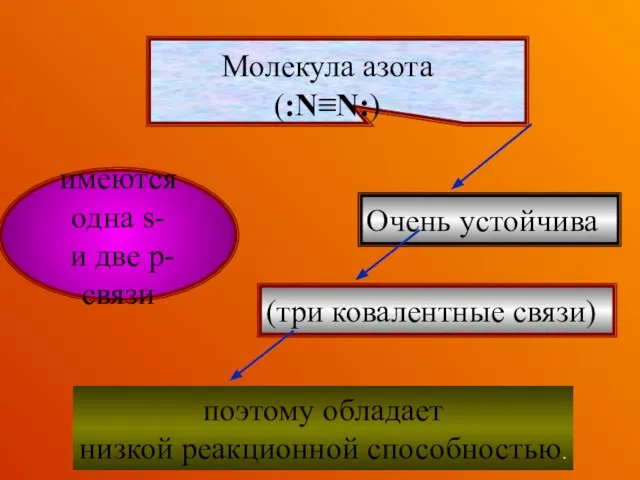
- 26. Очень устойчива (три ковалентные связи) поэтому обладает низкой реакционной способностью. Молекула азота (:N≡N:) имеются одна s-
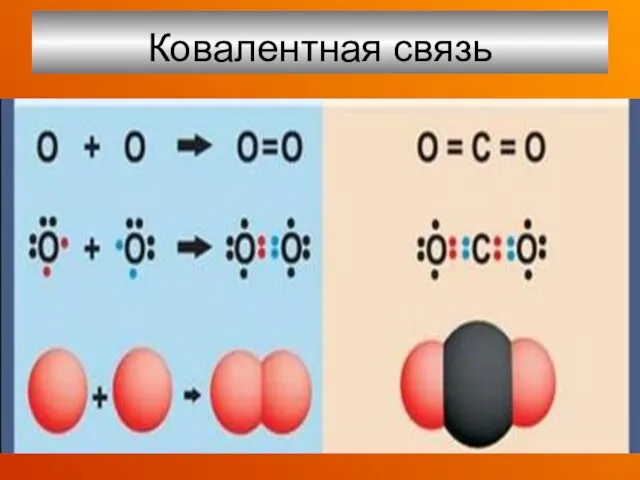
- 28. Ковалентная связь
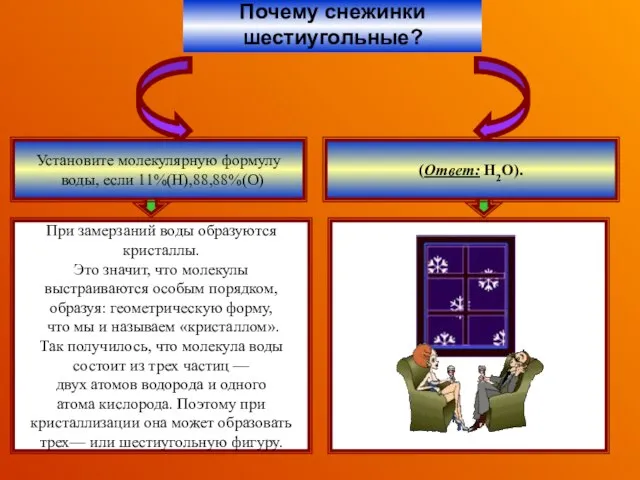
- 29. Почему снежинки шестиугольные? При замерзаний воды образуются кристаллы. Это значит, что молекулы выстраиваются особым порядком, образуя:
- 31. Разрыв ковалентной связи может происходить двумя способами
- 32. Ковалентная связь осуществляется двумя электронами с противоположными спинами, которые принадлежат одновременно двум различным атомам. Взаимное перекрывание
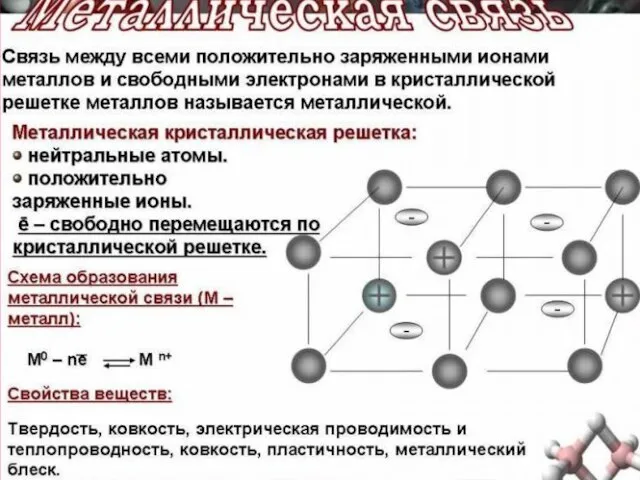
- 34. СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧ. СВЯЗИ. Между ионами и свободными электронами возникают электростатические взаимодействия, которые и являются причиной
- 37. Рис. Сдвиг слоев металлического кристалла не приводит к возникновению больших сил отталкивания между ионами металла, так
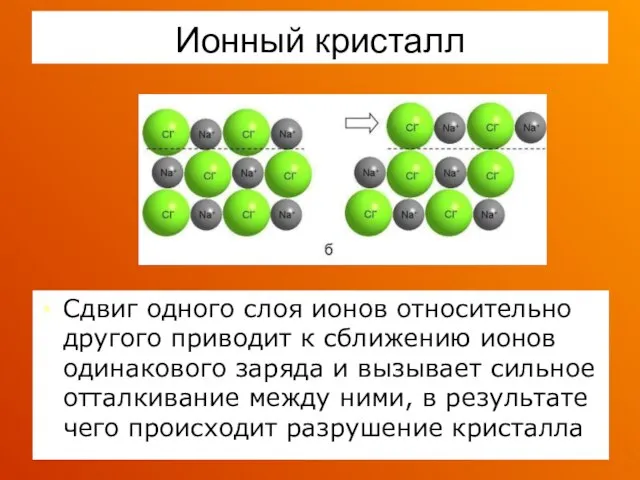
- 38. Ионный кристалл Сдвиг одного слоя ионов относительно другого приводит к сближению ионов одинакового заряда и вызывает
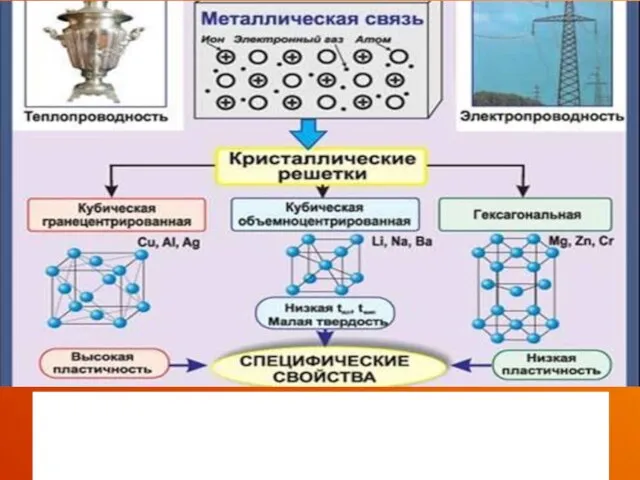
- 39. Почему Me проводит электрический ток? Валентные электроны, отделившиеся от атомов металлов, более или менее свободно перемещаются
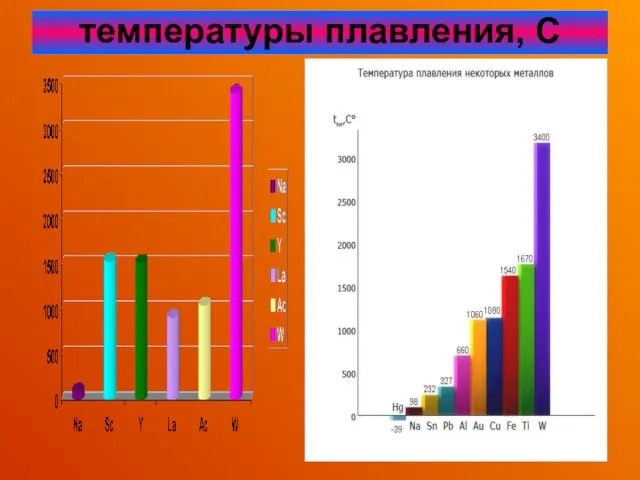
- 40. температуры плавления, С
- 42. H••Cl
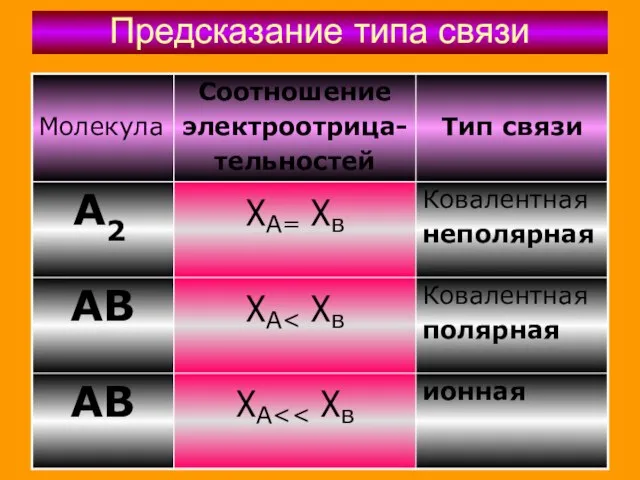
- 43. Предсказание типа связи
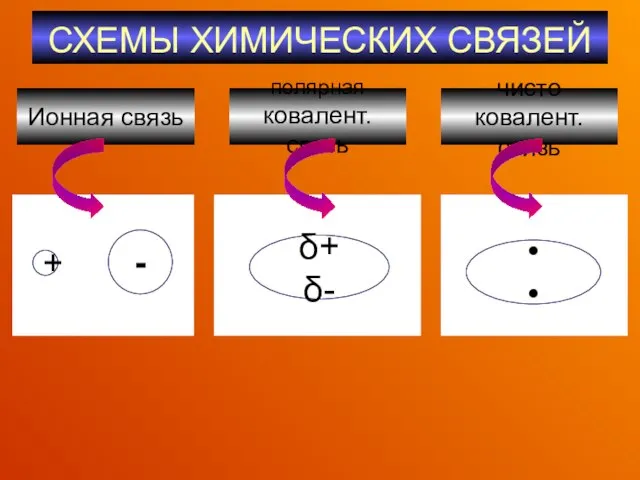
- 44. СХЕМЫ ХИМИЧЕСКИХ СВЯЗЕЙ Ионная связь полярная ковалент.связь чисто ковалент.связь + - • • δ+ δ-
- 45. Простая связь двойная связь тройная связь F-F O O N -N - - - - -
- 46. Относительное расположение эп Относительное расположение электронной пары между двумя атомами А А А В А С
- 48. Свойства ковалентной связи Высокоэнергетическая (прочная) 2. Насыщаемая. Число ковалентных связей атома в соединении строго соответствует числу
- 49. Свойства ионной связи Высокоэнергетическая (прочная в кристалле) 2.Не обладает насыщаемостью, поскольку возможно взаимодействие данного иона с
- 50. Свойства металлической связи Высокоэнергетическая (прочная) 2.Ненасыщаемая. 3. Ненаправленная.
- 51. Металлическая связь в металлах третьей группы оказывается существенно прочнее, чем в щелочных металлах. В ее образовании
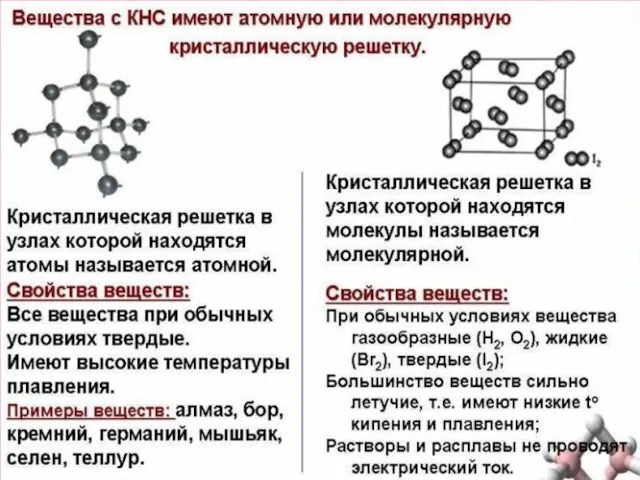
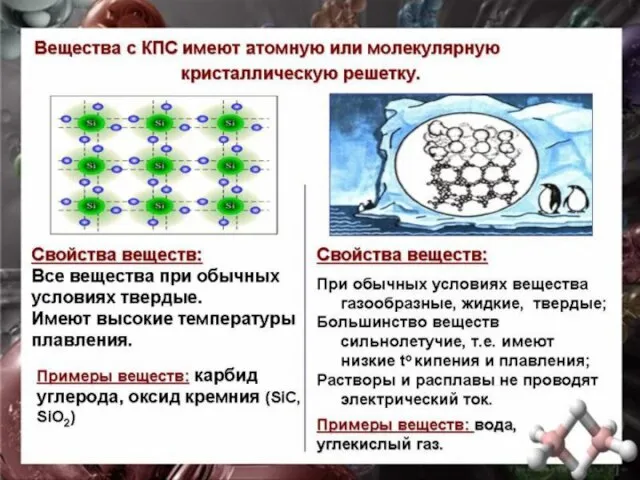
- 53. Кристаллические решётки Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки
- 54. ИОННЫЕ Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью.
- 55. АТОМНЫЕ Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными
- 56. МОЛЕКУЛЯРНЫЕ Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как
- 57. МЕТАЛЛИЧЕСКИЕ Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для металлов характерны физические
- 59. Скачать презентацию


































 Вольфрам. Знаходження в періодичній системі
Вольфрам. Знаходження в періодичній системі Лекарственная форма порошки
Лекарственная форма порошки Презентация по Химии "«Атомы химических элементов»." - скачать смотреть бесплатно
Презентация по Химии "«Атомы химических элементов»." - скачать смотреть бесплатно Определение химического состава почвы пришкольного участка
Определение химического состава почвы пришкольного участка Свойства радиоактивных элементов
Свойства радиоактивных элементов Методы синтеза коллоидных кристаллов. (Лекция 13)
Методы синтеза коллоидных кристаллов. (Лекция 13) Минералы. Значение минералов и задачи минералогии
Минералы. Значение минералов и задачи минералогии Автор: Лисицкая Елена Владимировна учитель физики ГОУ ЦО «Школа здоровья»№ 628.
Автор: Лисицкая Елена Владимировна учитель физики ГОУ ЦО «Школа здоровья»№ 628.  Общая характеристика неметаллов
Общая характеристика неметаллов Дисперсные системы
Дисперсные системы Гравиметрический анализ в аналитической химии
Гравиметрический анализ в аналитической химии Аппарат Киппа
Аппарат Киппа Химические волокна. Свойства и технология производства
Химические волокна. Свойства и технология производства ПРЕЗЕНТАЦИЯ КАБИНЕТА ХИМИИ
ПРЕЗЕНТАЦИЯ КАБИНЕТА ХИМИИ Биологическое окисление
Биологическое окисление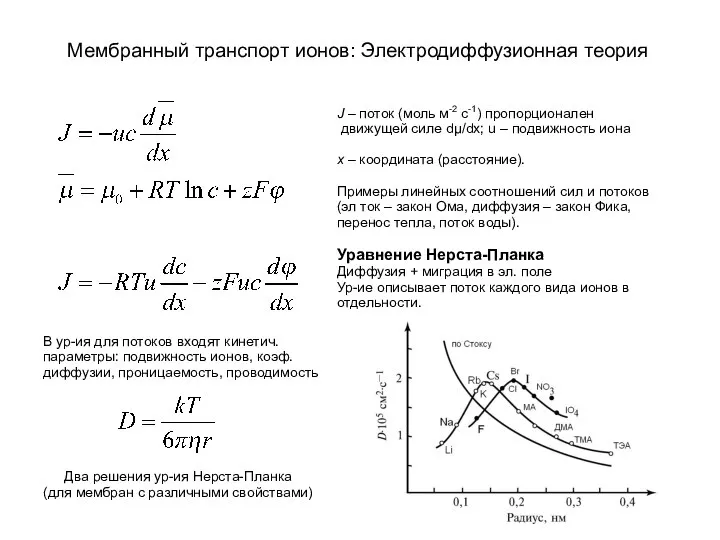 Мембранный транспорт ионов: электродиффузионная теория
Мембранный транспорт ионов: электродиффузионная теория Мы́ло — жидкий или твёрдый продукт, содержащий поверхностноактивные вещества
Мы́ло — жидкий или твёрдый продукт, содержащий поверхностноактивные вещества Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна
Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна  Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ №10 Ст. Новомыша
Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ №10 Ст. Новомыша Вода. Растворы. Растворение
Вода. Растворы. Растворение Биохимия. Разделы биохимии. Становление биохимии как науки
Биохимия. Разделы биохимии. Становление биохимии как науки Химические волокна. Свойства и технология производства
Химические волокна. Свойства и технология производства Предельные углеводороды
Предельные углеводороды Электролитная адсорбция
Электролитная адсорбция Нуклеиновые кислоты
Нуклеиновые кислоты Драгоценные камни
Драгоценные камни Выполнила: Иванова Алина, ученица 8 класса МБОУ «Ильинская СОШ». Руководитель: Фёдорова Светлана Ивановна, учитель химии МБОУ «И
Выполнила: Иванова Алина, ученица 8 класса МБОУ «Ильинская СОШ». Руководитель: Фёдорова Светлана Ивановна, учитель химии МБОУ «И