Содержание
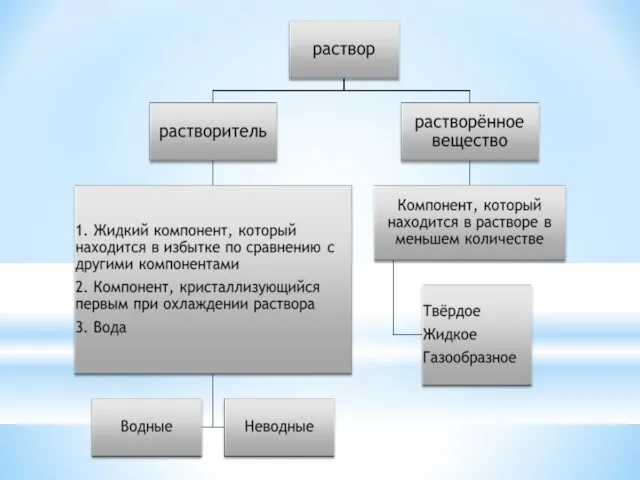
- 2. Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов
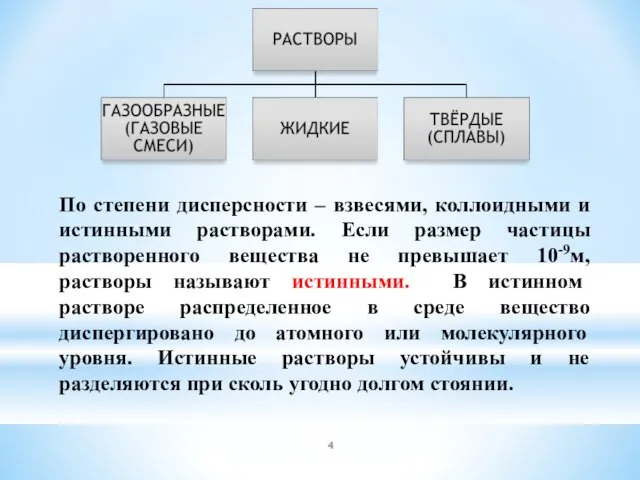
- 4. По степени дисперсности – взвесями, коллоидными и истинными растворами. Если размер частицы растворенного вещества не превышает
- 6. образованию структур переменного состава. Взаимодействие одинаковых частиц растворителя или растворенного вещества - образуются ассоциаты. Взаимодействие между
- 7. Процесс образования раствора идет самопроизвольно даже если ∆??>0, т.к. энтропия ∆S? возрастает. Раствор, при котором ∆G?=0
- 8. Для жидких растворов процесс идёт самопроизвольно (ΔG Раствор, в котором при данных условиях вещество больше не
- 9. Образование жидких растворов сопровождается процессом сольватации Сольватация – совокупность энергетических и структурных изменений, происходящих в растворе
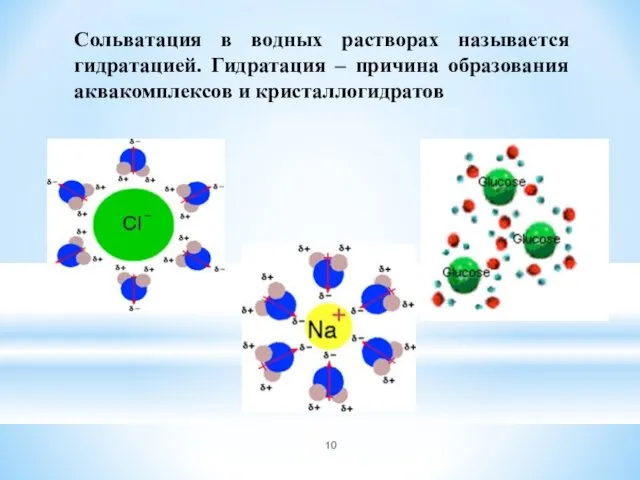
- 10. Сольватация в водных растворах называется гидратацией. Гидратация – причина образования аквакомплексов и кристаллогидратов
- 11. Концентрация растворённого вещества в насыщенном растворе называется растворимостью. Растворимость зависит от: природы растворённого вещества и растворителя,
- 12. Концентрация и способы ее выражения Концентрация – количество растворенного вещества, содержащееся в определенном количестве раствора или
- 14. 3. Молярность раствора – число молей растворенного вещества в одном литре раствора. 4. Моляльность раствора -
- 15. Растворы неэлектролитов. Закон Рауля и его следствия Раствор называется идеальным, если в нем отсутствует взаимодействие между
- 16. Закон: Парциальное давление насыщенного пара компонента раствора над раствором Рi прямо пропорционально мольной доле этого компонента
- 17. Вывод из закона Рауля - относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного
- 18. Общее давление насыщенного пара над раствором равно сумме парциальных давлений насыщенных паров компонентов раствора: С ростом
- 20. 1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы. 2. Понижение
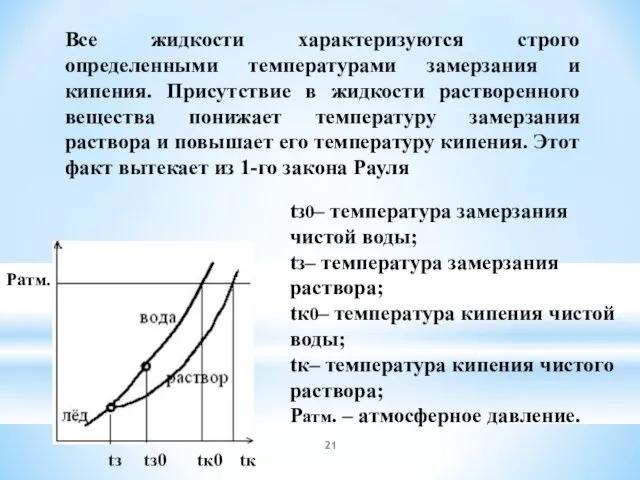
- 21. Все жидкости характеризуются строго определенными температурами замерзания и кипения. Присутствие в жидкости растворенного вещества понижает температуру
- 23. Физический смысл криоскопической константы растворителя: K – величина, показывающая насколько градусов понижается температура кристаллизации раствора, содержащего
- 24. Повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от
- 25. Разбавленные растворы неэлектролитов обладают коллигативными свойствами. Коллигативными называются свойства растворов, зависящие только от концентрации, но не
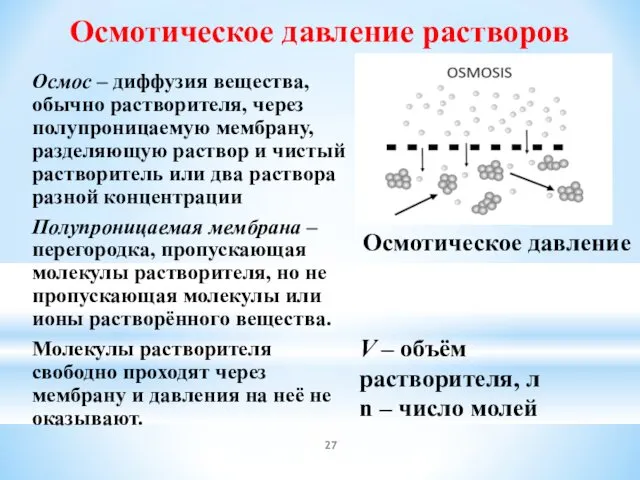
- 27. Осмос – диффузия вещества, обычно растворителя, через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два
- 28. Молекулы или ионы растворённого вещества не проходят сквозь мембрану и оказывают на неё давление, равное давлению
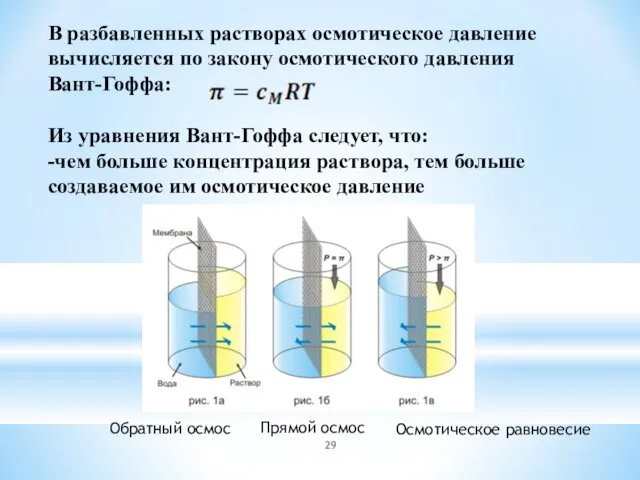
- 29. Обратный осмос Прямой осмос Осмотическое равновесие В разбавленных растворах осмотическое давление вычисляется по закону осмотического давления
- 30. -осмотическое давление прямо пропорционально абсолютной температуре т.е. осмотическое давление не зависит ни от вида растворённого вещества,
- 34. Растворы сильных электролитов. Понятие о теории сильных электролитов Петер Дебай, Нобелевская премия по химии 1936г. Эрих
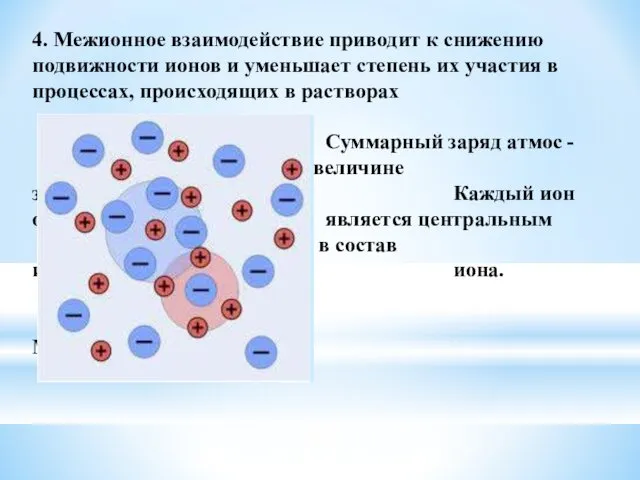
- 35. 4. Межионное взаимодействие приводит к снижению подвижности ионов и уменьшает степень их участия в процессах, происходящих
- 36. Для реальных растворов вместо понятия «концентрация» ввели «активность». Активность связана с концентрацией через коэффициент активности, который
- 38. Скачать презентацию




























 Задача №9. Глицерин. Команда «Карбораны»
Задача №9. Глицерин. Команда «Карбораны» Оксиды углерода
Оксиды углерода Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно
Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно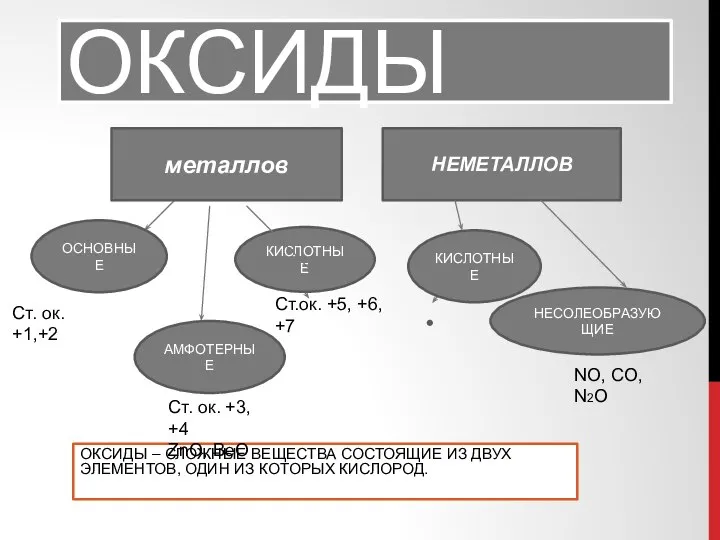 Оксиды
Оксиды Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы Гормоны гипофиза. (Лекция 12)
Гормоны гипофиза. (Лекция 12) Пластмасса
Пластмасса Химия и стирка
Химия и стирка  Презентация по Химии "Регуляторы биомолекулярных процессов" - скачать смотреть
Презентация по Химии "Регуляторы биомолекулярных процессов" - скачать смотреть  Основы органической химии
Основы органической химии Атом – сложная частица
Атом – сложная частица Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов
Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов Химические свойства оксидов
Химические свойства оксидов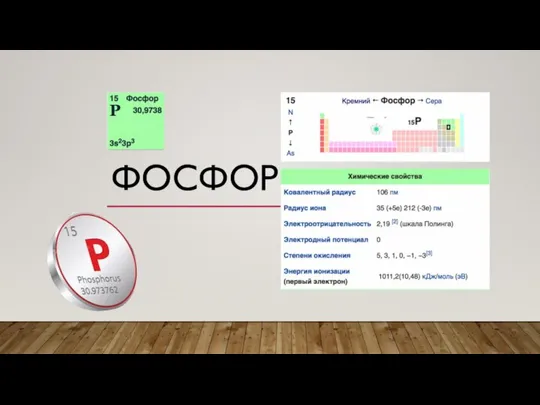 Фосфор. Функции фосфора в организме
Фосфор. Функции фосфора в организме Corrosion
Corrosion 11 хб
11 хб  Бионеорганическая химия. Биогенные элементы. (Лекция 5.2)
Бионеорганическая химия. Биогенные элементы. (Лекция 5.2) Биогенные s-элементы
Биогенные s-элементы Исследование спектральных и люминесцентных свойств боратных стекол с добавлением висмута
Исследование спектральных и люминесцентных свойств боратных стекол с добавлением висмута Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн
Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева
Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева Углеводороды – самые простые органические соединения
Углеводороды – самые простые органические соединения Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне
Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Ионное произведение воды. Понятие о рН раствора
Ионное произведение воды. Понятие о рН раствора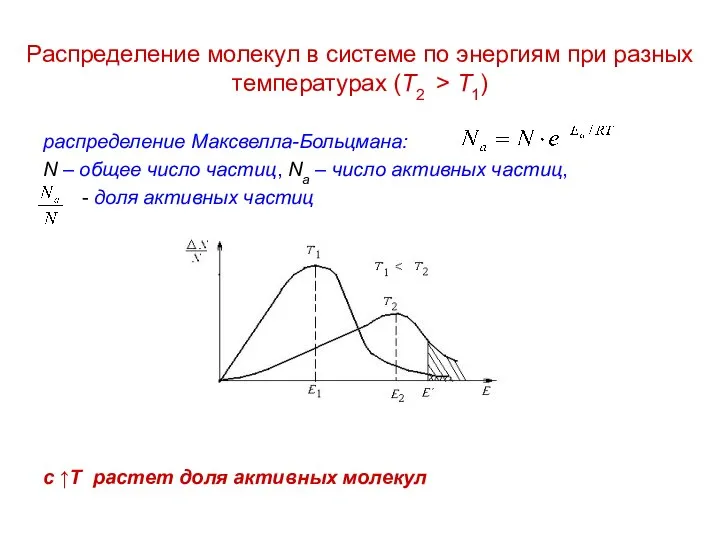 Распределение молекул в системе по энергиям при разных температурах
Распределение молекул в системе по энергиям при разных температурах