Содержание
- 2. ВОДА — РАСТВОРИТЕЛЬ. РАСТВОРЫ. КОНЦЕНТРАЦИЯ РАСТВОРОВ. МАССОВАЯ ДОЛЯ РАСТВОРЕННОГО ВЕЩЕСТВА. Наука начинается с тех пор, как
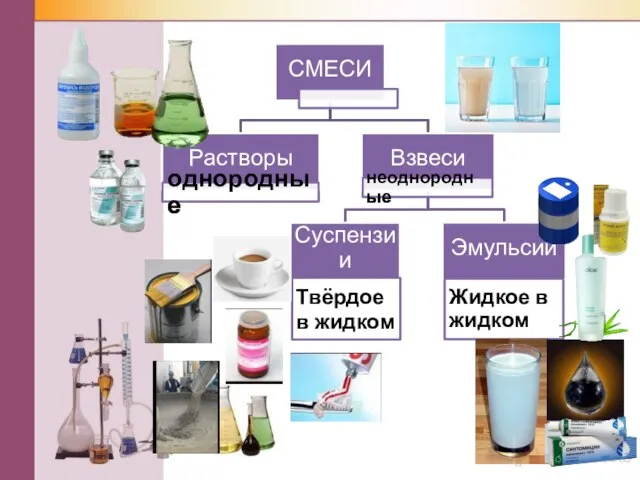
- 3. Растворение – это физико-химический процесс
- 6. Растворимость веществ.
- 8. По отношению к растворам часто употребляют термины «концентрированный» и «разбавленный». Концентрированный раствор – если раствор содержит
- 9. Классификация растворов по содержанию растворенного вещества Ненасыщенный раствор: при данной температуре находится меньше растворяемого вещества, чем
- 10. Растворимость. Коэффициент растворимости – это масса вещества (г), способная раствориться в одном литре растворителя (л) Например,
- 11. Растворимость Решите задачу. Лаборант приготовил при 200С 2 раствора: 5 литров раствора хлорида меди (II) –
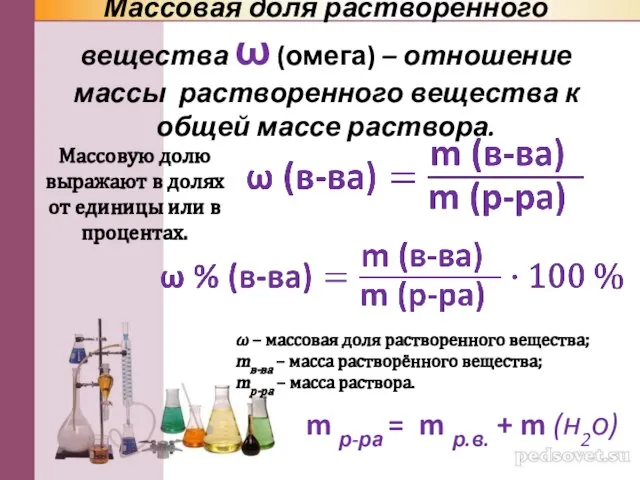
- 12. Массовая доля растворенного вещества ω (омега) – отношение массы растворенного вещества к общей массе раствора. ω
- 13. Массовую долю (процентную концентрацию) обычно выражают в долях от единицы или в процентах. Например, массовая доля
- 14. Дано: m (р-ра) = 300 г Ѡ (соль) = 5% (0,05) ---------------------------- m (соль) = ?
- 15. Решение: m (соль) 1) Ѡ (соль) = ----------------- m (р-ра) 2) m (соль) = Ѡ (соль)
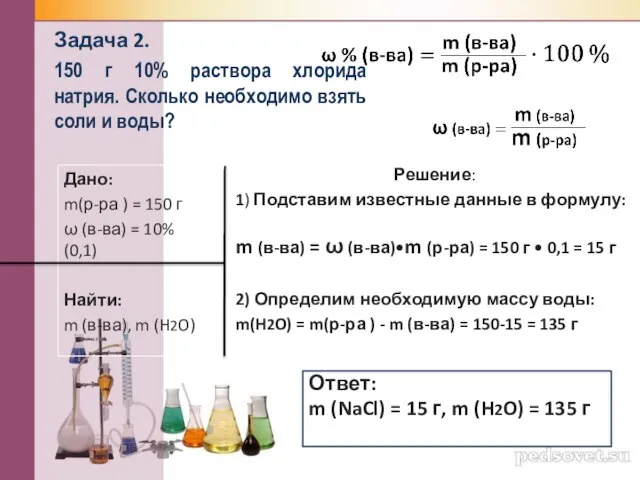
- 16. Задача 2. 150 г 10% раствора хлорида натрия. Сколько необходимо взять соли и воды? Дано: m(р-ра
- 17. Задача 3. В 500 г раствора, насыщенного при t=20 С, содержится 120 г нитрата калия KNO3.
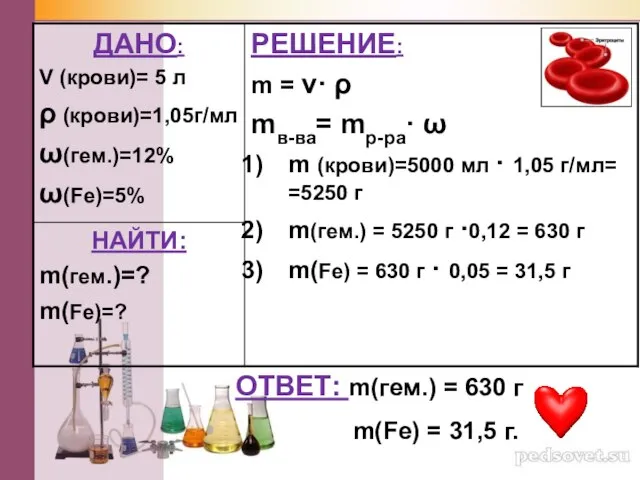
- 18. В организме человека в среднем содержится 5 л крови, плотность которой составляет 1,05 г/мл. Сколько граммов
- 19. ОТВЕТ: m(гем.) = 630 г m(Fe) = 31,5 г.
- 20. Задача 5 Задача 6 Задача 7 Столовый уксус представляет собой 6% раствор уксусной кислоты в воде.
- 21. При помощи § 33 (стр. 110) письменно в тетради ответить на вопросы: Что такое раствор? Привести
- 22. Задача 1. Вычислите массовую долю раствора в %, который получится, если 50 г. вещества растворили в
- 23. Решите задачи. Задача 1. Для того, чтобы обработать цветы, Кате нужно приготовить 2 кг 2%-ного раствора
- 24. Решите задачи. Задача 3. Вычислите массовую долю раствора, который получится, если 120 г соли лаборант растворит
- 25. Решите задачи. Задача 5. Мама для бульона взяла 700 г воды, добавила 1,5 чайных ложки соли
- 26. Определите, сколько нужно взять растворов соли 60%-й и 10%-й концентраций для приготовления 300 г раствора 25%-й
- 27. Проверочная работа Массовая доля вещества в растворе
- 29. Скачать презентацию






















 Анилин. Підготували : л-ст Капуста Є.С. л-ст Гаврил
Анилин. Підготували : л-ст Капуста Є.С. л-ст Гаврил Кристалічні тіла
Кристалічні тіла Физические и физико-химические свойства и характеристики грунтов. (Лекция 2)
Физические и физико-химические свойства и характеристики грунтов. (Лекция 2) Обмен углеводов
Обмен углеводов Органічна хімія
Органічна хімія Жиры. Сложные эфиры трехатомного
Жиры. Сложные эфиры трехатомного Электролитическая диссоциация
Электролитическая диссоциация Основные задачи и направления коллоидной химии. (Лекция 1)
Основные задачи и направления коллоидной химии. (Лекция 1) Применение композиционных угольно-цеолитных адсорбентов для очистки промышленных сточных вод
Применение композиционных угольно-цеолитных адсорбентов для очистки промышленных сточных вод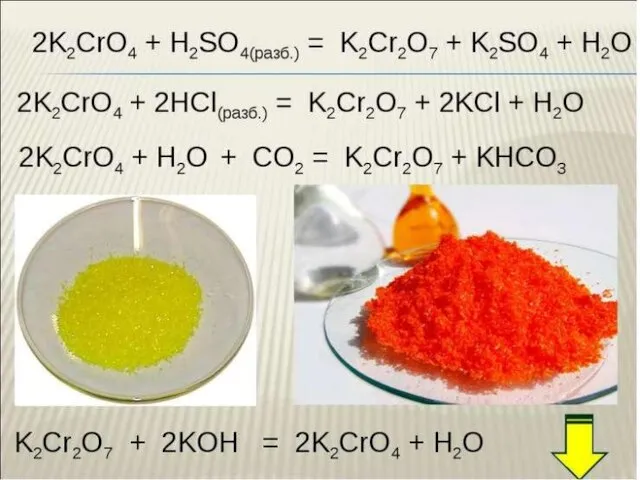 Хром. Соединения хрома
Хром. Соединения хрома Амины. Способы получения
Амины. Способы получения Презентация по химии Классы неорганических веществ
Презентация по химии Классы неорганических веществ Кислоты. Определение кислот
Кислоты. Определение кислот Соединения химических элементов
Соединения химических элементов Производство синтетических моющих средств
Производство синтетических моющих средств Роль химических элементов в жизнедеятельности организма
Роль химических элементов в жизнедеятельности организма Цветки Арники
Цветки Арники Состав смеси газов
Состав смеси газов Класифікація неорганічних сполук, їхній склад і номенклатура
Класифікація неорганічних сполук, їхній склад і номенклатура Занимательная химия. Как проводить опыты в домашних условиях
Занимательная химия. Как проводить опыты в домашних условиях Фолиевая кислота
Фолиевая кислота  Лекарственные вещества (определения и классификация)
Лекарственные вещества (определения и классификация) Презентация по Химии "Теория Витализма" - скачать смотреть бесплатно
Презентация по Химии "Теория Витализма" - скачать смотреть бесплатно Рафинирование от растворимых окислов
Рафинирование от растворимых окислов Аммиак NH3
Аммиак NH3  Презентация по Химии "Кальций" - скачать смотреть
Презентация по Химии "Кальций" - скачать смотреть  Полимеры
Полимеры Основні види палива та їх роль в енергетиці країни
Основні види палива та їх роль в енергетиці країни