Содержание
- 2. Цель урока Дать общую характеристику металлов II-А группы по положению в ПСХЭ и строению атомов. Рассмотреть
- 3. Проверка домашнего задания 1) Допишите схемы тех реакций, которые протекают практически до конца: а) Li +
- 4. «Крестики - нолики» а) вещества, которые реагируют с водой б) сложные вещества, относящиеся к одному классу
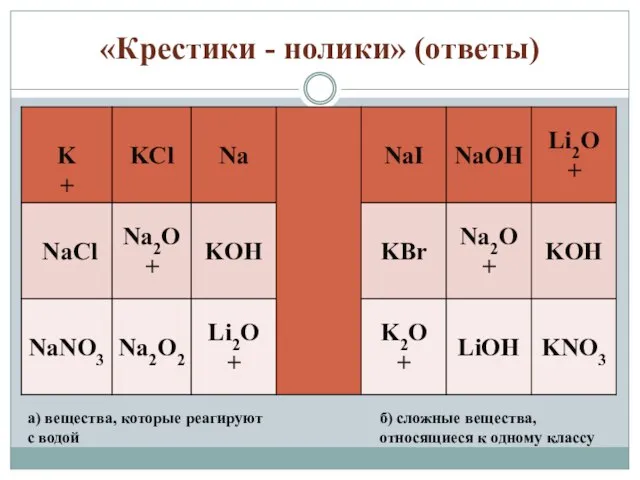
- 5. «Крестики - нолики» (ответы) а) вещества, которые реагируют с водой б) сложные вещества, относящиеся к одному
- 6. Элементы IIА группы Дайте их характеристику по положению в ПСХЭ. Как изменяются их свойства?
- 7. Химические свойства элементов IIА группы 1. Очень реакционноспособны. 2. Обладают положительной валентностью +2. 3. Реагируют с
- 8. Пользуясь учебником, подготовьте краткие ответы на следующие вопросы и оформите их в виде схем, формул на
- 9. +20Ca 2е-,8е-,8е-,2е- …3s23p63d0| 4s2 Умеренно твёрдый, серебристо-белый металл
- 10. Нахождение в природе Сталактиты и сталагмиты Известняк Кораллы
- 11. Химические свойства кальция 1. Реакция с водой. В обычных условиях поверхность Be и Mg покрыты инертной
- 12. Химические свойства кальция 3. Реакция с кислородом. Все металлы образуют оксиды RO, барий-пероксид – BaO2: 2Mg
- 13. 5. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета: Ca2+ - темно-оранжевый
- 14. Физкульминутка
- 15. Важнейшие соединения кальция CaO – негашеная известь CaCO3 ?t° CaO + CO2 CaO + H2O ?
- 16. Важнейшие соединения кальция CaO + H2O ? Ca(OH)2(гашеная известь) Ca + 2H2O ? Ca(OH)2 + H2
- 17. Тест на закрепление по ЩЗМ (можно набрать 7 балов ) А-1. Распределение электронов по электронным слоям
- 18. Ответы на тест по закреплению 1) - 2 2) - 1 3) - 4 4) -
- 19. Задания для закрепления материала. (Из образцов ГИА). Даны схемы превращений. Напишите уравнения реакций, с помощью которых
- 20. Роль кальция в жизни человека Кальций является основой костной ткани, зубов и придатков кожи – волос
- 21. Содержание кальция в организме человека, его значение Демонстрация декальцинированной кости
- 22. Рекомендуемые Всемирной Организацией Здравоохранения суточные нормы потребления кальция. Дети до 3 лет — 600 мг. Дети
- 23. Содержание кальция в продуктах питания: Малое содержание кальция: рыба (30-90); хлеб с отрубями (60), хлеб пшеничный
- 25. Скачать презентацию




















 Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Цинк. Знаходження в періодичній системі і основні характеристики
Цинк. Знаходження в періодичній системі і основні характеристики Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Получение и приминение этилена
Получение и приминение этилена Презентация по Химии "Почему золото блестит?" - скачать смотреть
Презентация по Химии "Почему золото блестит?" - скачать смотреть  Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач.
Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач. 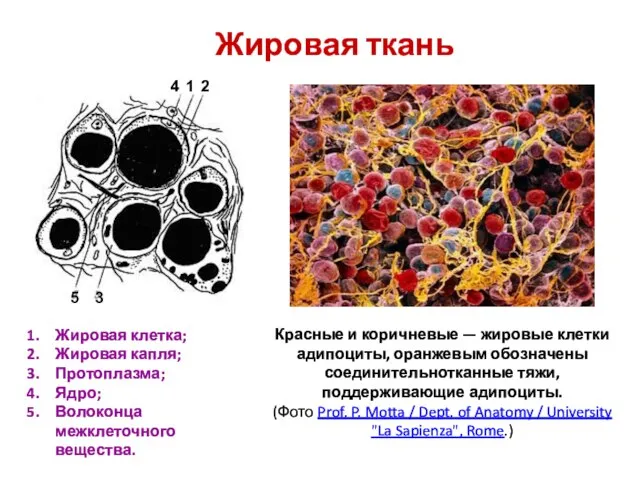 Жировая ткань
Жировая ткань Зависимость константы скорости химической реакции от температуры
Зависимость константы скорости химической реакции от температуры История микроскопа
История микроскопа  Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов
Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов Клиническая фармакология антибактериальных препаратов
Клиническая фармакология антибактериальных препаратов Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Химический элемент натрий
Химический элемент натрий Ковалентная химическая связь
Ковалентная химическая связь Транс-жиры
Транс-жиры Обмен липидов
Обмен липидов Метаболизм углеводов
Метаболизм углеводов Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В.
Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В. Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Водородная связь
Водородная связь Разделение смесей
Разделение смесей Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват
Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват Дисперсные системы и растворы
Дисперсные системы и растворы Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В.
Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В. Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Соли. Названия и классификация солей
Соли. Названия и классификация солей