Содержание
- 2. Определение кислот Кислоты в природе Классификация кислот Химические свойства кислот Получение кислот Применение кислот План урока:
- 3. Кислотами называются сложные вещества, образованные катионами водорода и анионами кислотных остатков. 1. Определение кислот
- 4. 2. Кислоты в природе Кислотные дожди (азотная, серная кислоты) Кислоты в пище (яблочная, щавелевая, лимонная, молочная,
- 5. Паук педипальпида стреляет в своих врагов струйкой, состоящей из уксусной кислоты. Плоские тысяченожки используют яд пострашнее
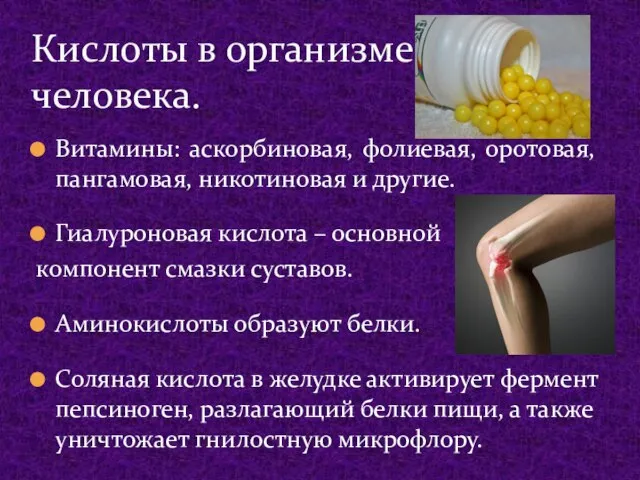
- 6. Витамины: аскорбиновая, фолиевая, оротовая, пангамовая, никотиновая и другие. Гиалуроновая кислота – основной компонент смазки суставов. Аминокислоты
- 7. По составу: Кислородосодержащие: НNO3, H2SO3; Бескислородные: HCl, H2S. По основности: (основность кислоты определяется числом катионов, которые
- 8. I. Взаимодействие с металлами, расположенными в электрохимическом ряду напряжений металлов до водорода. 2HCI + Zn =
- 9. Взаимодействие с основными оксидами. 2 HCl + BaO = BaCI2 + H2O
- 10. Взаимодействие с растворимыми и нерастворимыми основаниями. Это реакции нейтрализации. HNO3 + NaOH = NaNO3 + H2O
- 11. Взаимодействие с солями Сильная кислота способна вытеснить слабую кислоту даже из нерастворимой соли. 2HCI + Na2S
- 13. Кислородосодержащие получают при взаимодействии оксидов неметаллов с водой: Бескислородные: Затем растворяют в воде и получают соляную
- 14. Соляная кислота Для растворения окалины и ржавчины при никелировании, хромировании, цинковании и т.п. стальных и чугунных
- 15. Серная кислота Для производства фосфорных и азотных удобрений В производстве взрывчатых веществ Искусственных волокон Красителей Пластмасс
- 16. Азотная кислота Производство азотных удобрений Взрывчатых веществ Лекарственных веществ Красители Пластмассы Искусственные волокна
- 17. Задание 1. Напишите формулы и дайте характеристику кислотам на основе их классификации: кремниевая кислота, плавиковая кислота.
- 19. Скачать презентацию















 Открытие водорода
Открытие водорода Фотодыхание
Фотодыхание Гидротермальные месторождения. (Лекция 10)
Гидротермальные месторождения. (Лекция 10) ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 1.ОВР.Классификация ОВР. 2.Метод электронного баланса. 3.Метод полуреакций.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 1.ОВР.Классификация ОВР. 2.Метод электронного баланса. 3.Метод полуреакций.  Функціональні матеріали в аналітичній хімії. Лекція 1
Функціональні матеріали в аналітичній хімії. Лекція 1 Побочная подгруппа VI группы периодической системы
Побочная подгруппа VI группы периодической системы Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества
Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ  Метаболизм липидов. Метаболизм глицерофосфолипидов и холестерола. (Лекция 3)
Метаболизм липидов. Метаболизм глицерофосфолипидов и холестерола. (Лекция 3) Презентация по Химии "Карбонові кислоти" - скачать смотреть бесплатно
Презентация по Химии "Карбонові кислоти" - скачать смотреть бесплатно Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна
Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна  Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Коррозия и защита материалов
Коррозия и защита материалов Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Химия атмосферы
Химия атмосферы Композиты. Полимерные композиционные материалы
Композиты. Полимерные композиционные материалы Твёрдое состояние вещества
Твёрдое состояние вещества Коэффициент концентрации меди
Коэффициент концентрации меди Значення хімії у розв’язанні сировинної проблеми
Значення хімії у розв’язанні сировинної проблеми  Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Лиофильные и лиофобные дисперсные системы
Лиофильные и лиофобные дисперсные системы Классы неорганических веществ
Классы неорганических веществ Медь и ее сплавы
Медь и ее сплавы Виды состояния вещества
Виды состояния вещества Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии
Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии Растворяющаяся в воде моющая масса - мыло
Растворяющаяся в воде моющая масса - мыло Классификация сплавов. Диаграммы состояния сплавов
Классификация сплавов. Диаграммы состояния сплавов Ртуть
Ртуть