Содержание
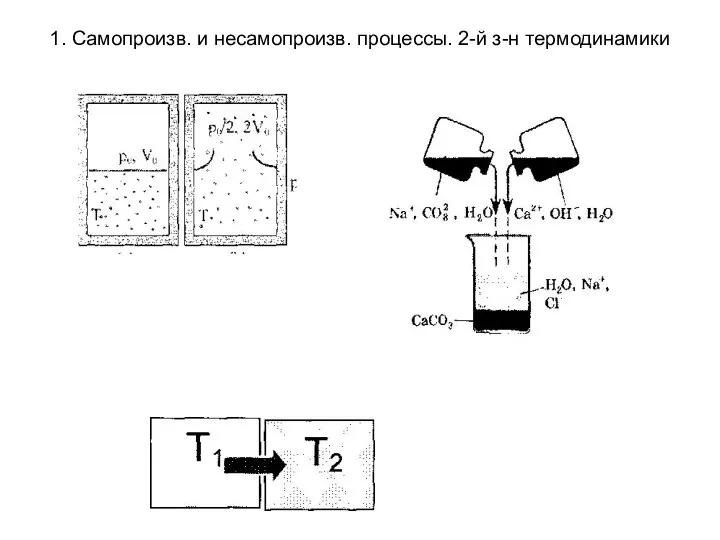
- 2. 1. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики Процессы подразделяются на самопроизвольные и не самопроизвольные. Самопроизвольные
- 3. 1. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики
- 4. 1. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики Несамопроизвольные процессы - процессы протекающие при сообщении системе
- 5. 1. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики
- 6. 1. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики Первый закон термодинамики не дает ответа на вопрос
- 7. 1. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики Предложено много разнообразных качественных формулировок 2-го начала термодинамики:
- 8. 1. Самопроизв. и несамопроизв. процессы. 2-й з-н термодинамики Количественно второй закон термодинамики можно сформулировать так: существуют
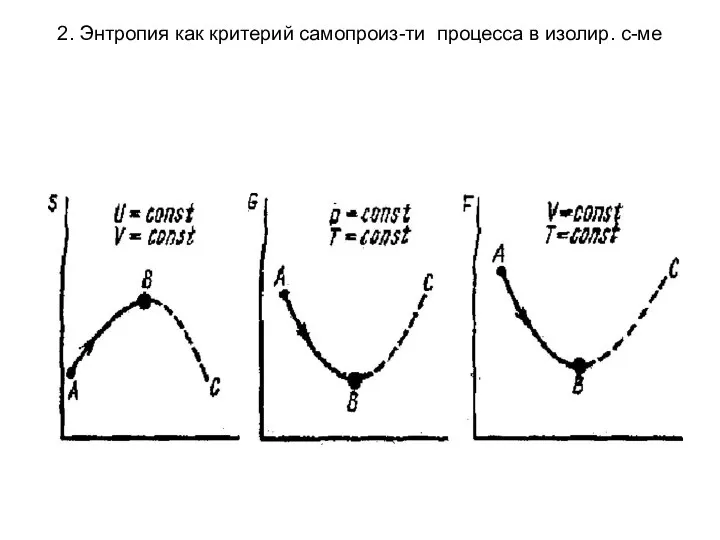
- 9. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме Термодинамическими потенциалами являются различные функции состояния в
- 10. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме для закрытой системы (при T=const, V= const)
- 11. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
- 12. 2. Энтропия как критерий самопроизвольности процесса в изолированной системе Термодинамическое определение энтропии введено Р. Клаузиусом в
- 13. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме Приращение энтропии в равновесном процессе равно приведенной
- 14. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме Статистическое определение энтропии в 1896 г дает
- 15. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме Макросостояние системы характеризуется определенными термодинамическими параметрами ,
- 16. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме Больцман установил взаимосвязь энтропии с термодинамической вероятностью:
- 17. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме При абсолютном нуле прекращаются колебательные движения частиц,
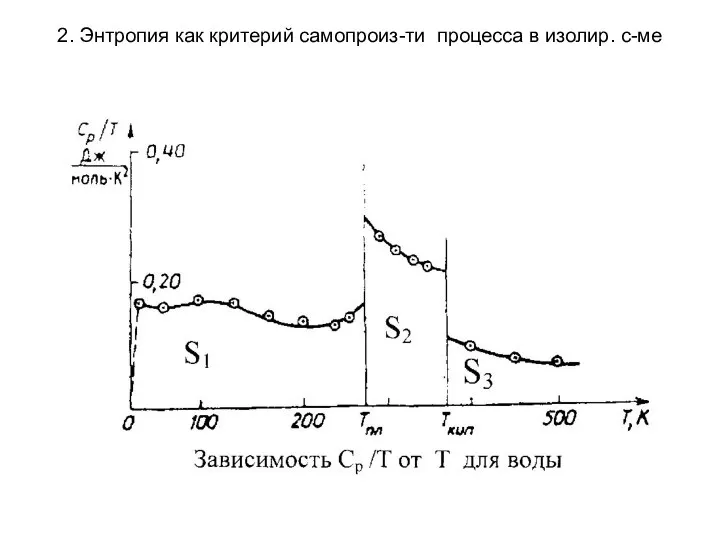
- 18. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме Расчет абсолютного значения энтропии Для многих практических
- 19. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме Где S0ид - поправка на неидеальность газа
- 20. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме
- 21. 2. Энтропия как критерий самопроиз-ти процесса в изолир. с-ме Сложив сумму этих интегральных членов с изменениями
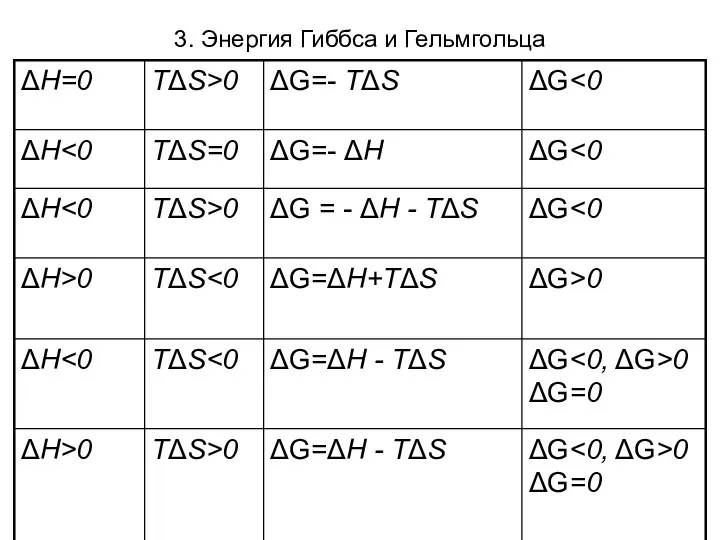
- 22. 3. Энергия Гиббса и Гельмгольца При Т,р =const (изохорно-изотермические условия) критерием самопроизвольности является изобарно-изотермический потенциал (энергия
- 23. 3. Энергия Гиббса и Гельмгольца
- 24. 3. Энергия Гиббса и Гельмгольца
- 25. 3. Энергия Гиббса и Гельмгольца При T,V = const, критерием самопроизвольности является изохорно-изотермический потенциал (энергия Гельмгольца)
- 26. 3. Энергия Гиббса и Гельмгольца Характеристические функции - функции, частные производные которых по какому-либо из параметров
- 27. 4. Химический потенциал Химический потенциал μ – термодинамическая функция состояния, определяющая изменение термодинамических потенциалов при изменении
- 28. 4. Химический потенциал Наиболее просто химический потенциал связан с термодинамическим потенциалом G: G=∑μi Ni . Для
- 29. 4. Химический потенциал В простейшем случае идеальных газов зависит только от концентрации i -го компонента: μi
- 31. Скачать презентацию
























 Миметик глицина на основе производного Гераниола
Миметик глицина на основе производного Гераниола Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения Химические процессы
Химические процессы Бор (Borum)
Бор (Borum) Химия и стирка
Химия и стирка  Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть
Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть  Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии
Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии д.з.051
д.з.051 Химические и физико-химические методы стандартизации и контроля качества лекарственных. (Лекция 3)
Химические и физико-химические методы стандартизации и контроля качества лекарственных. (Лекция 3) Азотная кислота
Азотная кислота Окислительно-восстановительные реакции. (Лекция 18)
Окислительно-восстановительные реакции. (Лекция 18) Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата. (Тема 6)
Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата. (Тема 6) Майда еритін витаминдер. А,D,E,K витаминдері
Майда еритін витаминдер. А,D,E,K витаминдері Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Презентация Соли
Презентация Соли Lekcii_ - 2017-lech_ped 11
Lekcii_ - 2017-lech_ped 11 V група періодичної системи Менделєєва
V група періодичної системи Менделєєва Химико-технологические процессы современных производств
Химико-технологические процессы современных производств Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Химия. Вопросы. Практическая работа
Химия. Вопросы. Практическая работа Химическая идентификация
Химическая идентификация Почему протекают химические реакции
Почему протекают химические реакции Презентация по Химии "Солі в природі" - скачать смотреть бесплатно
Презентация по Химии "Солі в природі" - скачать смотреть бесплатно Пегматитовые месторождения
Пегматитовые месторождения Ароматичні вуглеводні Арени Підготував Учень 11-А класу Пазуханич Руслан
Ароматичні вуглеводні Арени Підготував Учень 11-А класу Пазуханич Руслан 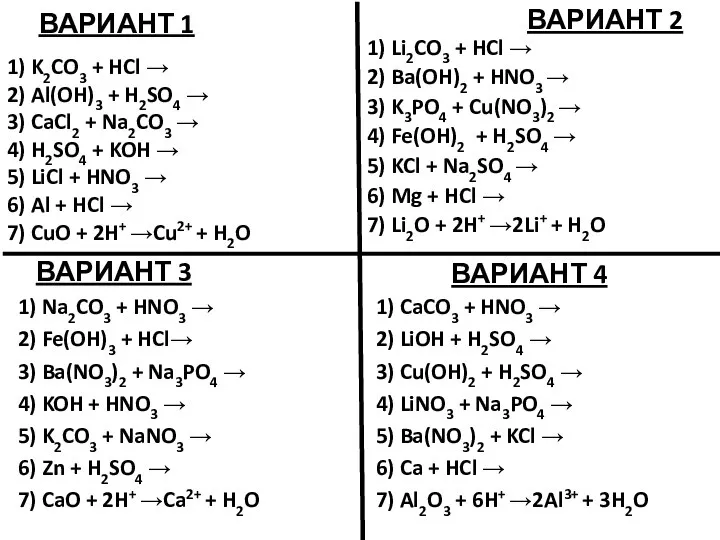 Уравнения возможных реакций. Задание
Уравнения возможных реакций. Задание Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)
Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)