Содержание
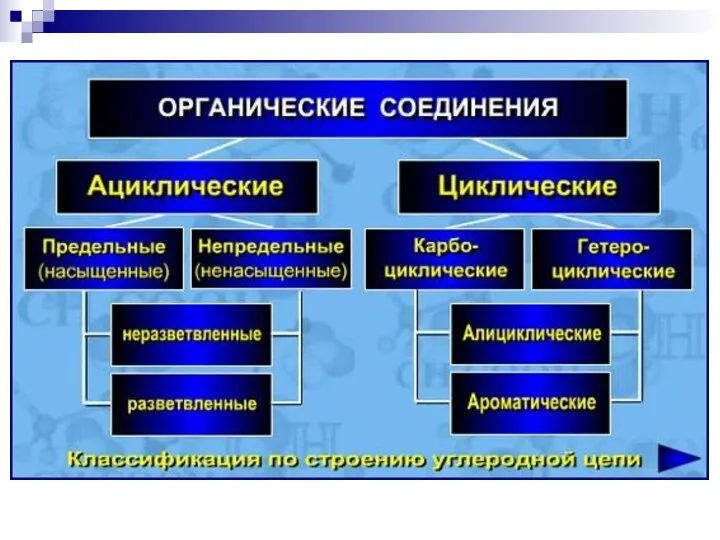
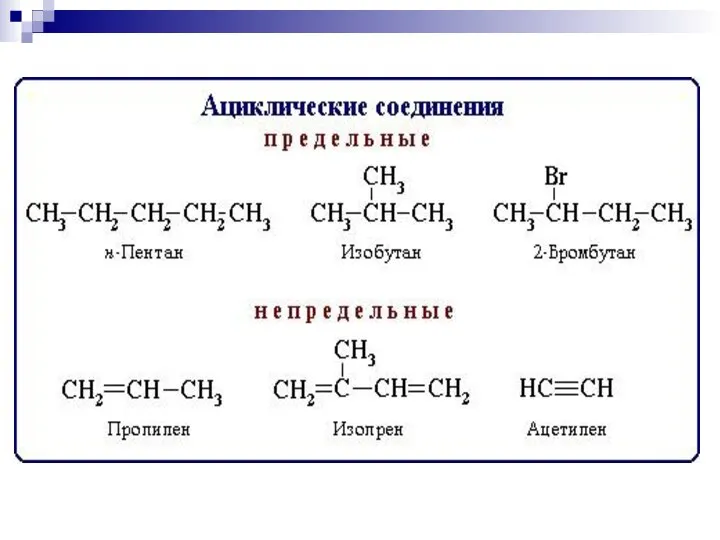
- 2. БИООРГАНИЧЕСКАЯ ХИМИЯ изучает строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием
- 3. «Целью курса «Биоорганическая химия», как учебной дисциплины, является формирование знаний взаимосвязи строения и химических свойств биологически
- 4. « Конечная цель изучения курса «Биоорганическая химия» в медицинских вузах состоит в формировании системных знаний о
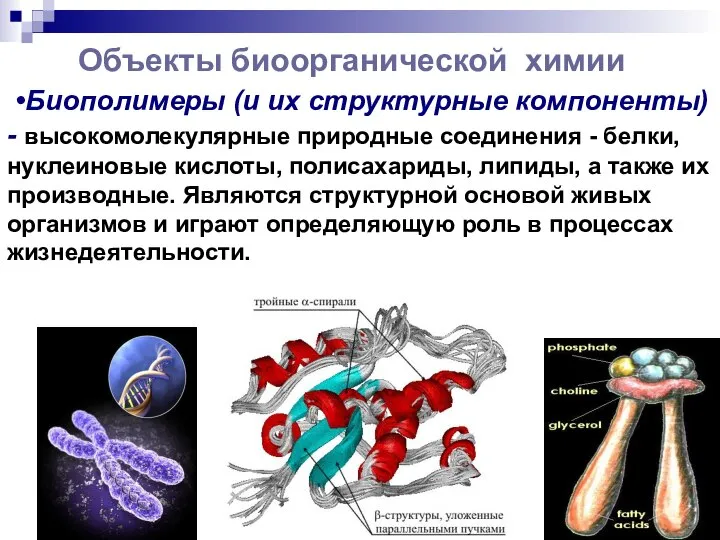
- 5. Объекты биоорганической химии •Биополимеры (и их структурные компоненты) - высокомолекулярные природные соединения - белки, нуклеиновые кислоты,
- 6. •Биорегуляторы—природные вещества, обладающие биорегулирующей векторностью (терпеноиды,стероиды,витамины,алкалоиды, простагландины,флавоноиды и др.). •Метаболиты—промежуточные продукты обмена веществ в живых клетках.
- 7. «Жизнь – это особая форма существования биополимерных тел (систем), характеризующихся хиральной чистотой и способностью к самоорганизации
- 8. “Натура тем паче всего удивительна, что в простоте своей многохитростна и от малого числа причин производит
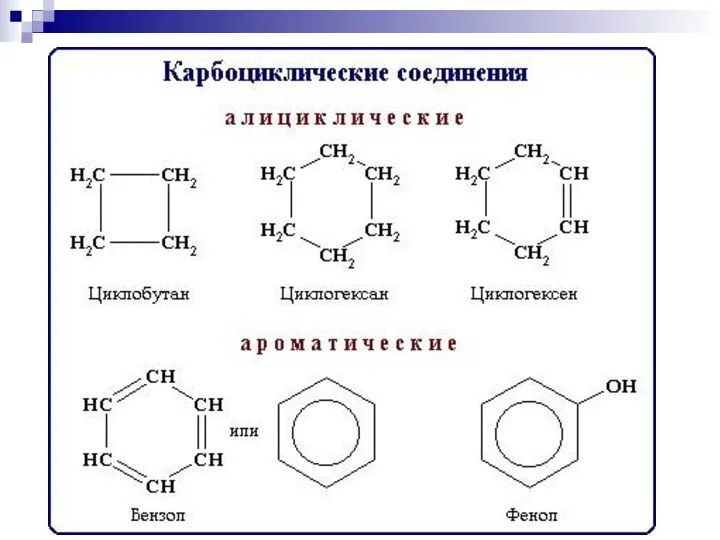
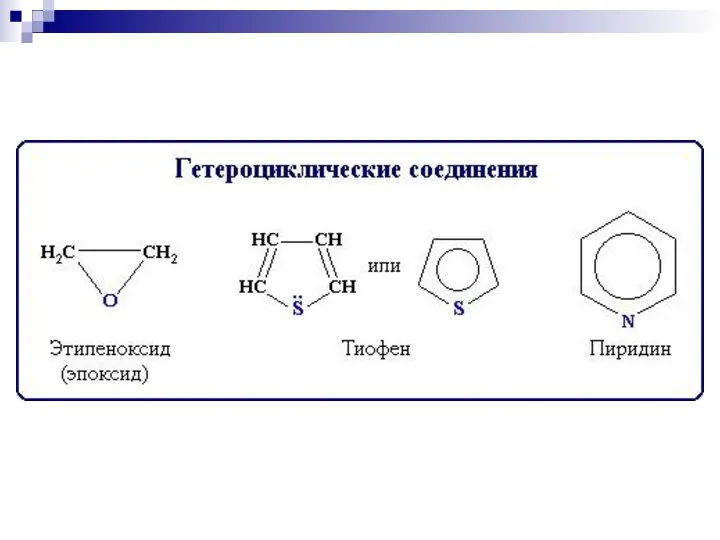
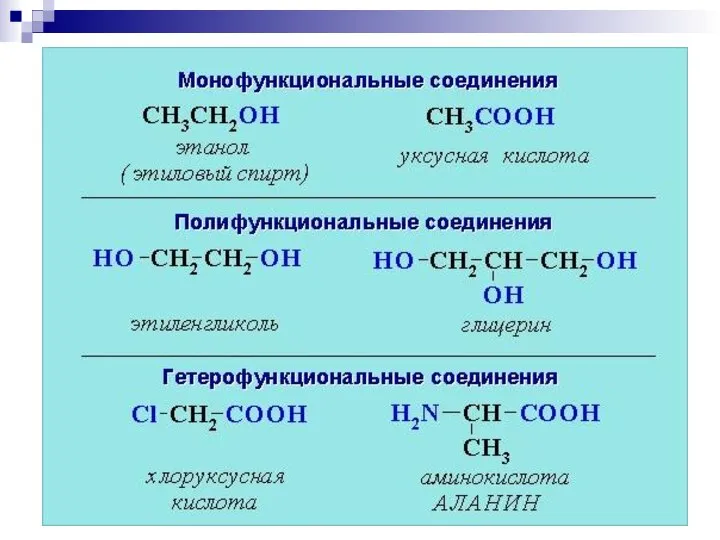
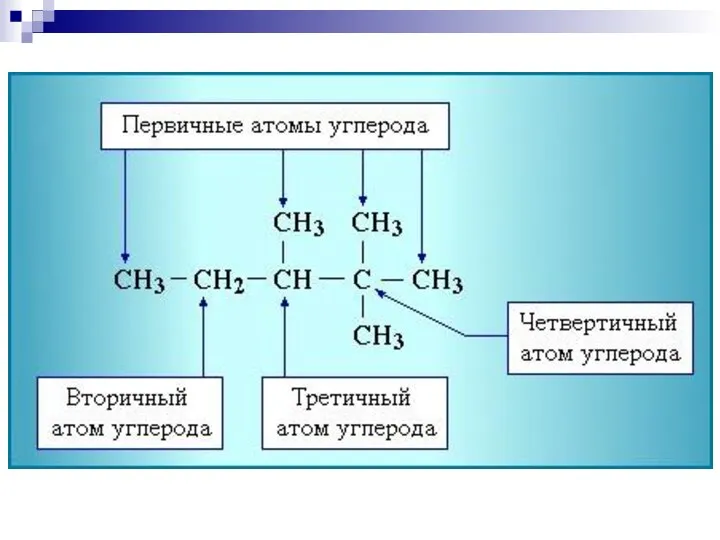
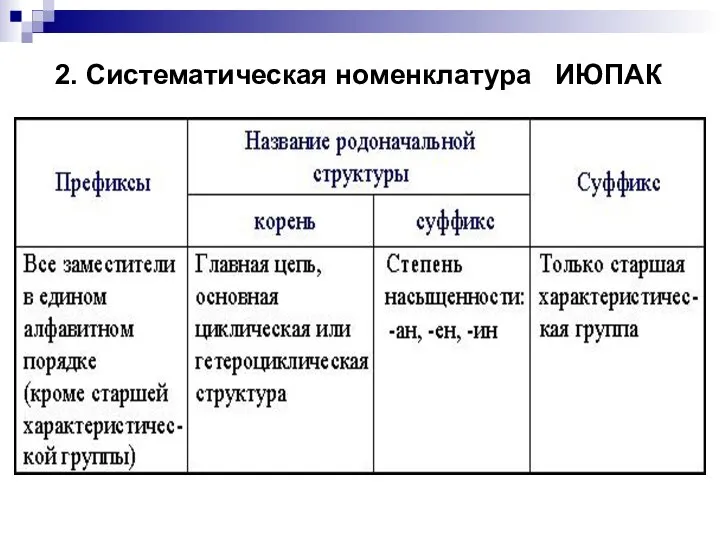
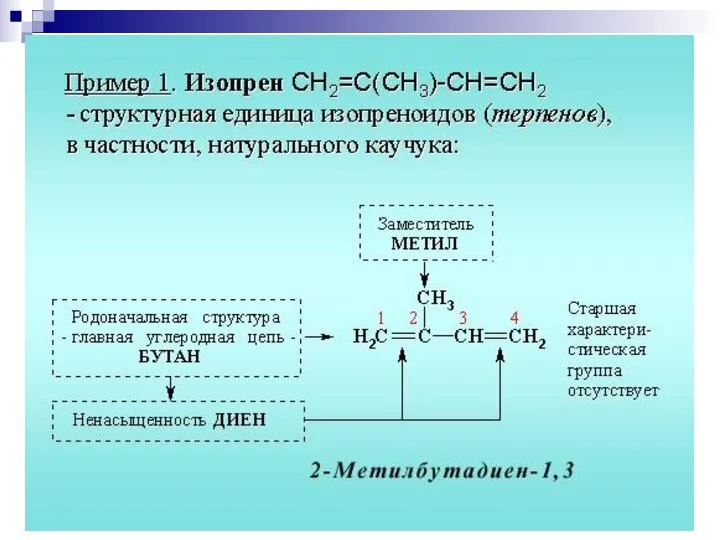
- 9. 2. Систематическая номенклатура ИЮПАК
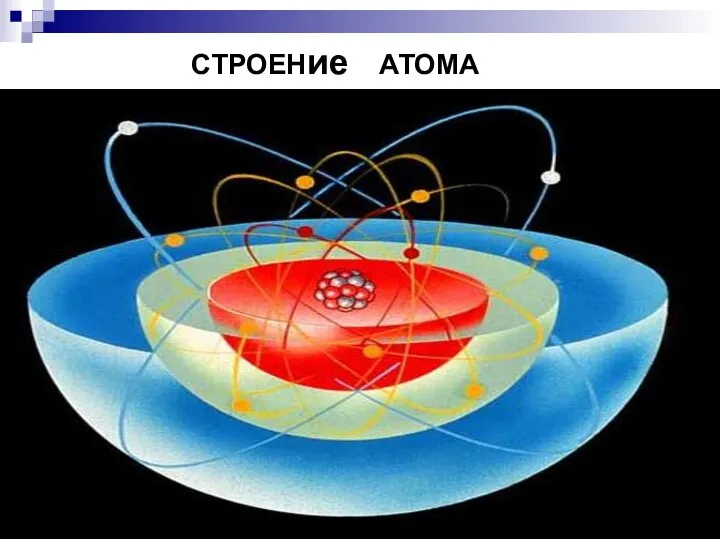
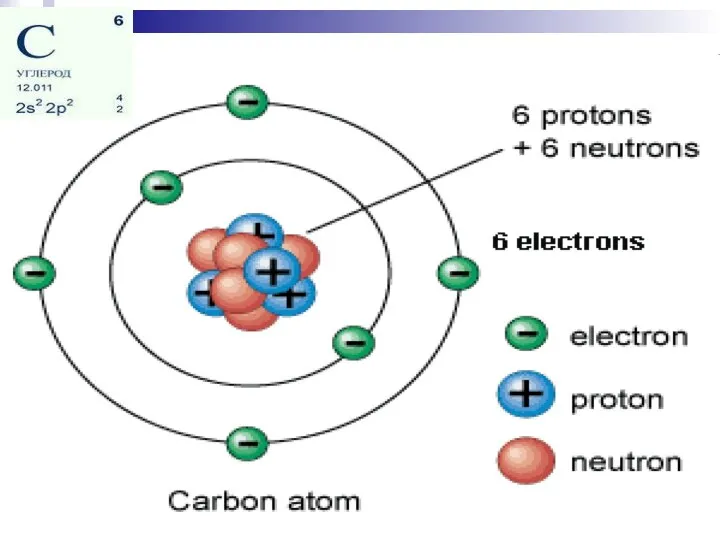
- 11. СТРОЕНие АТОМА
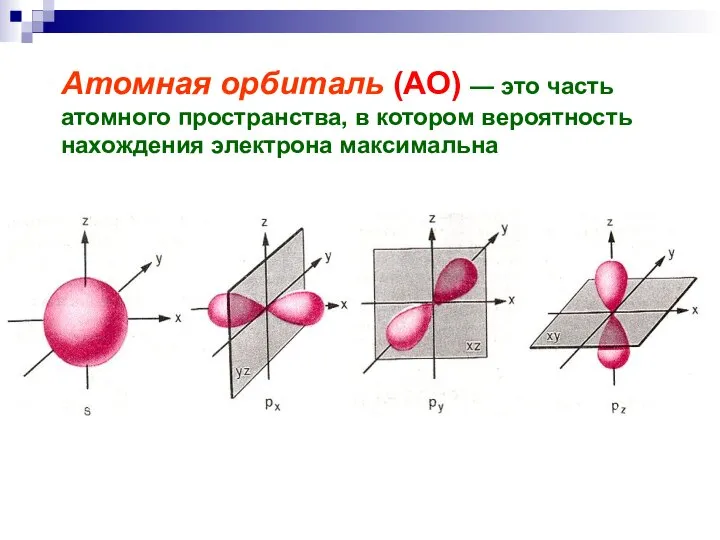
- 13. Атомная орбиталь (АО) — это часть атомного пространства, в котором вероятность нахождения электрона максимальна
- 14. Правило Хунда (Гунда): Орбитали данного подуровня заполняются сначала по одному электрону. Правило Паули: на орбитали могут
- 15. Электронный паспорт Р15 15 Фосфор P 30,974 3s23p3
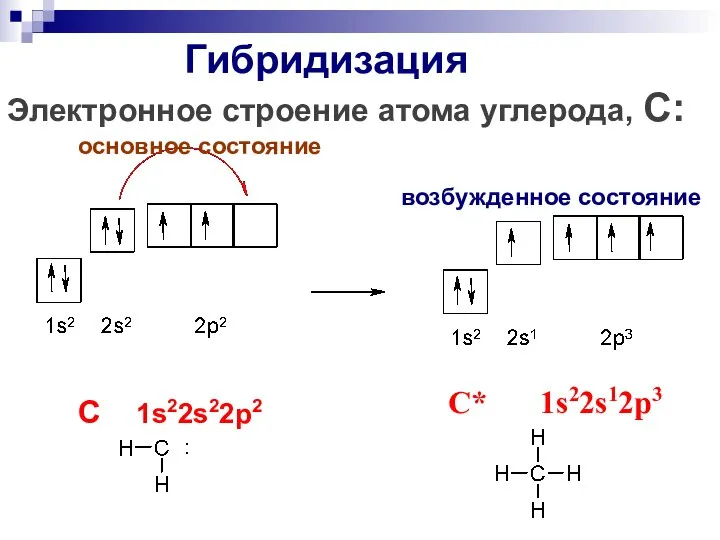
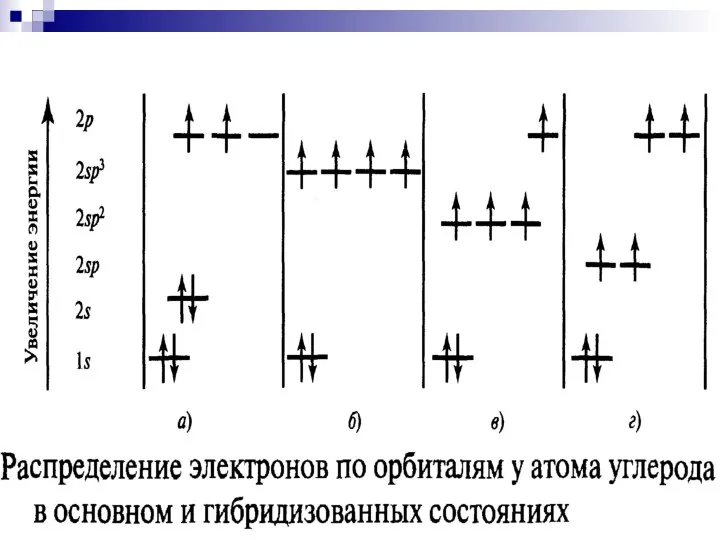
- 16. Гибридизация Электронное строение атома углерода, С: основное состояние возбужденное состояние C 1s22s22p2 C* 1s22s12p3
- 17. . Гибридизация - смешивание волновых функций различных валентных электронов атома, в результате которого волновые функции всех
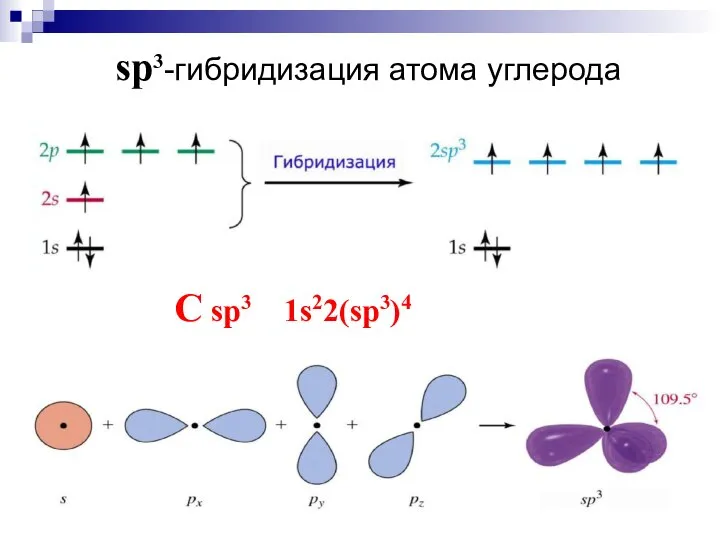
- 18. sp3-гибридизация атома углерода C sp3 1s22(sp3)4
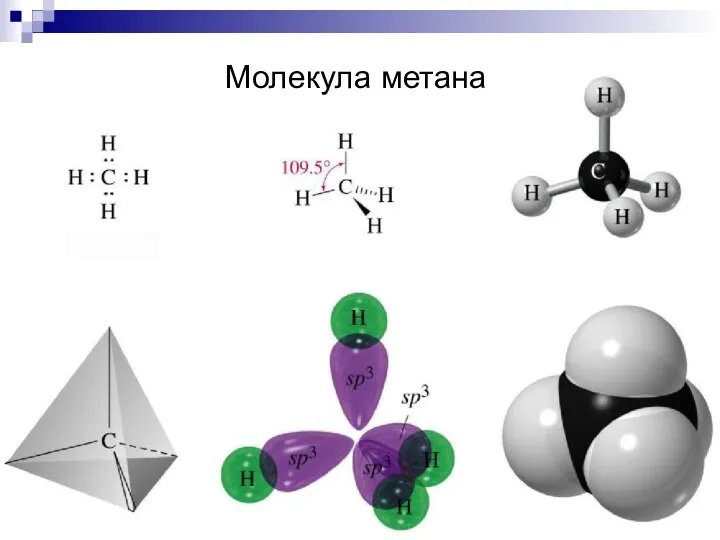
- 19. Молекула метана
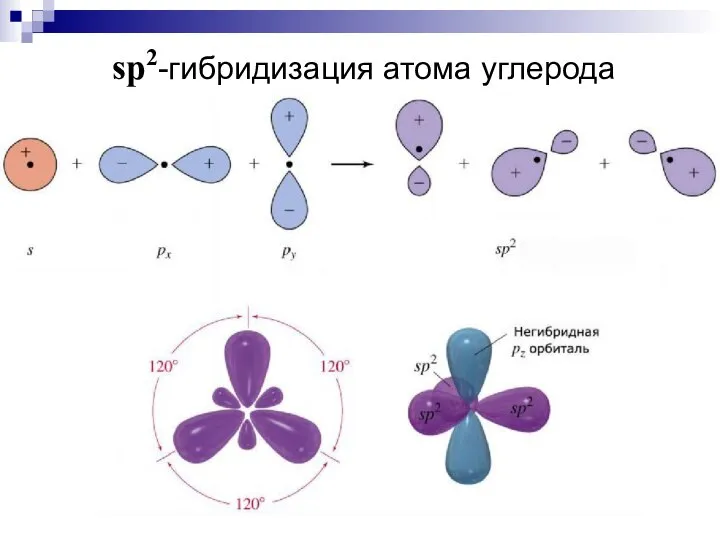
- 20. sp2-гибридизация атома углерода
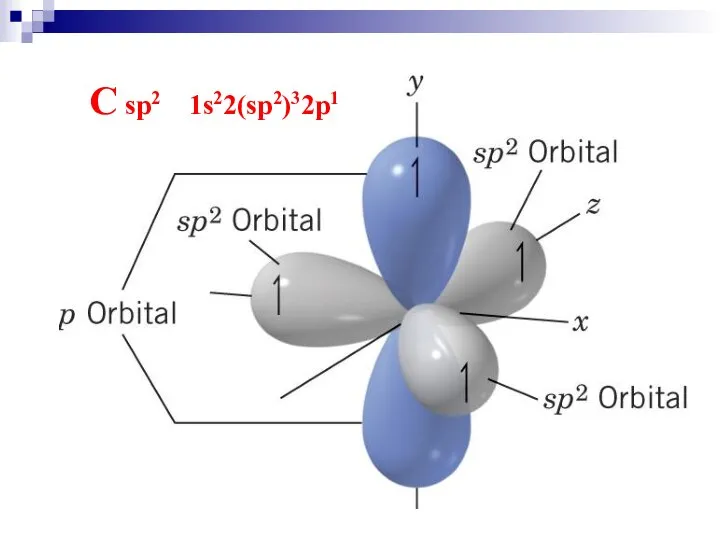
- 21. C sp2 1s22(sp2)32p1
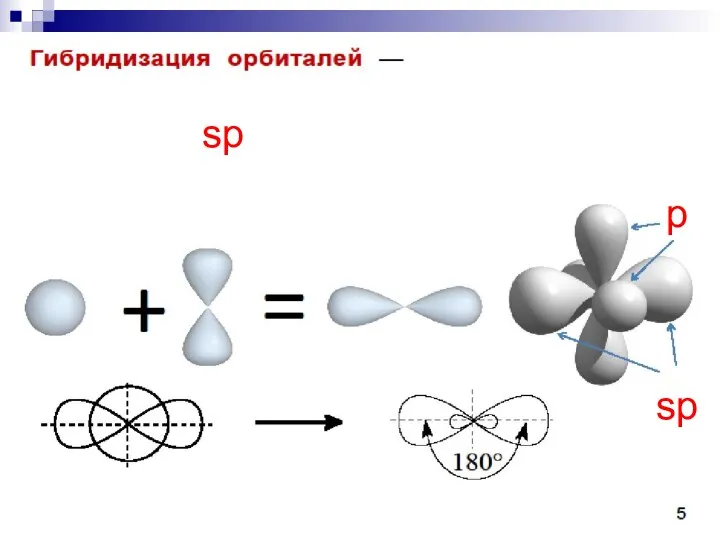
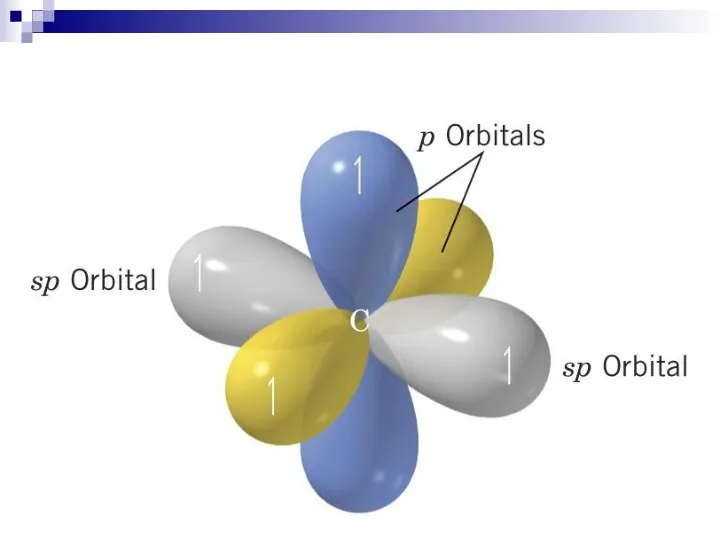
- 22. sp sp p
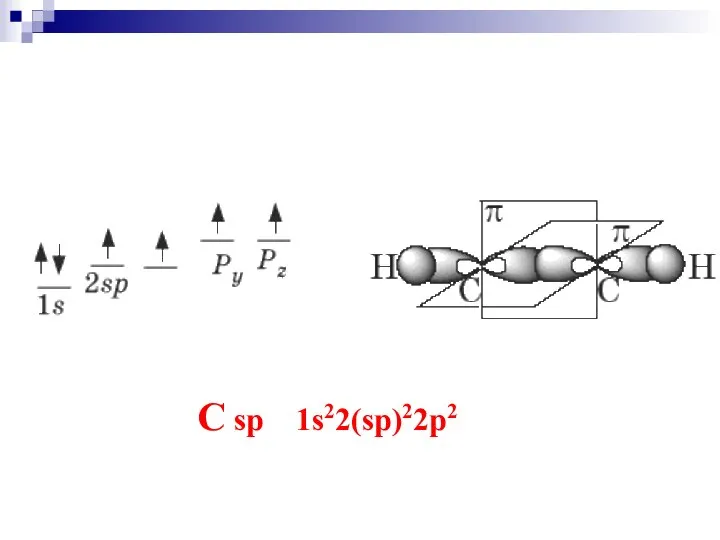
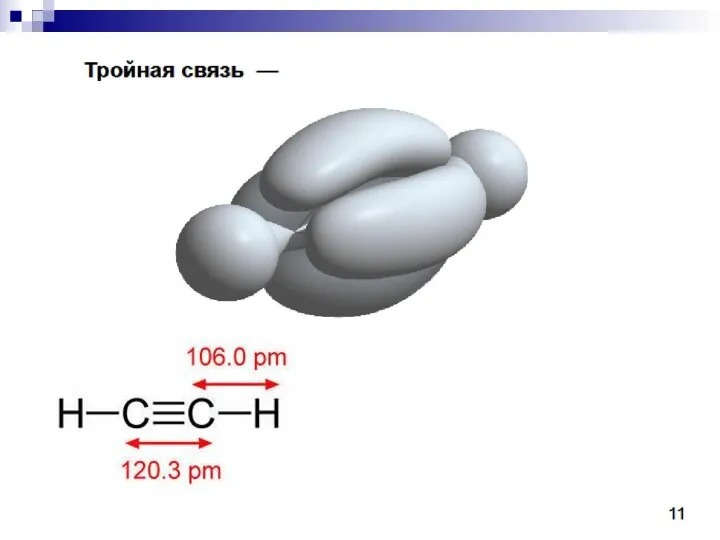
- 23. C sp 1s22(sp)22p2
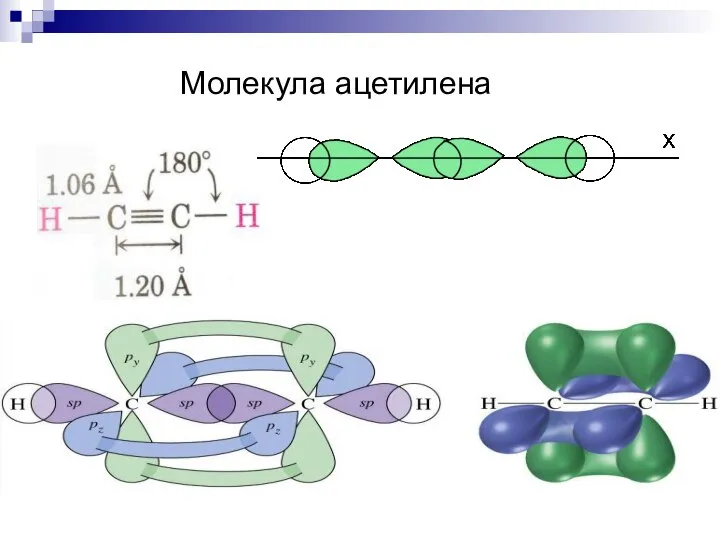
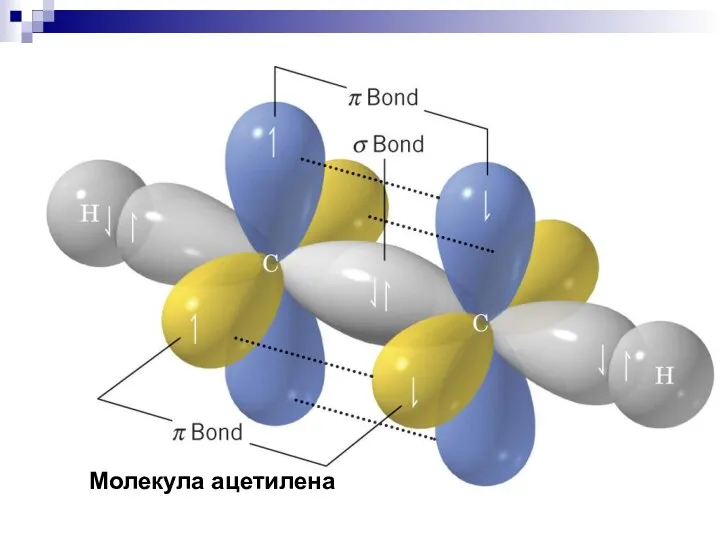
- 25. Молекула ацетилена
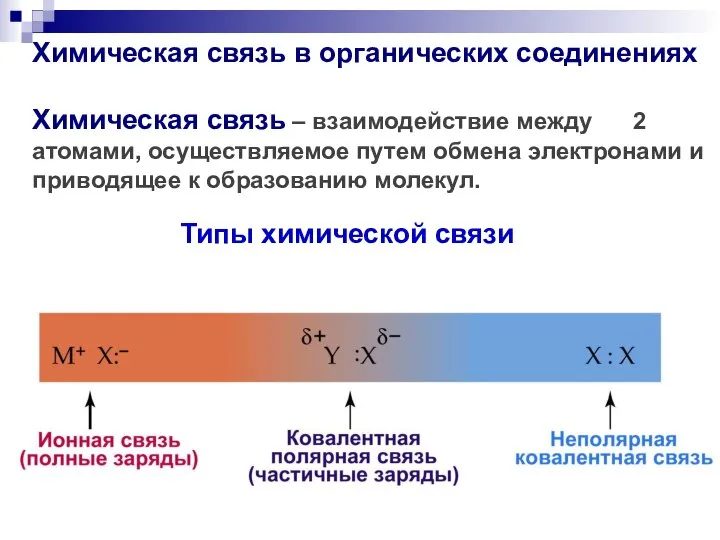
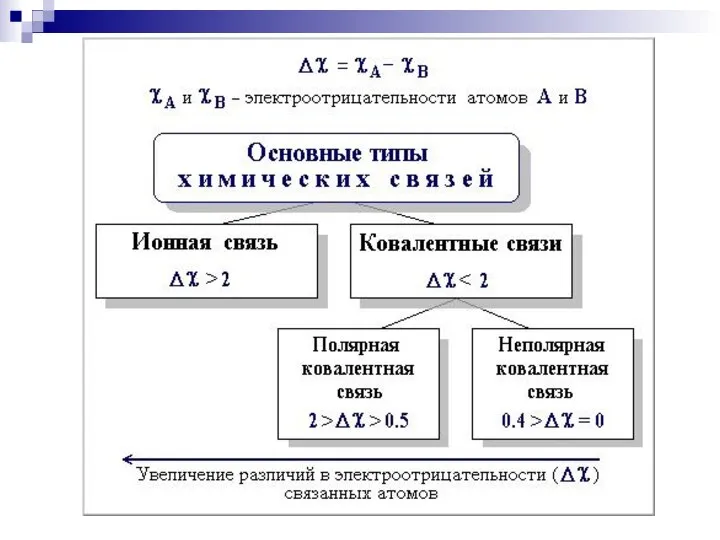
- 27. Химическая связь в органических соединениях Химическая связь – взаимодействие между 2 атомами, осуществляемое путем обмена электронами
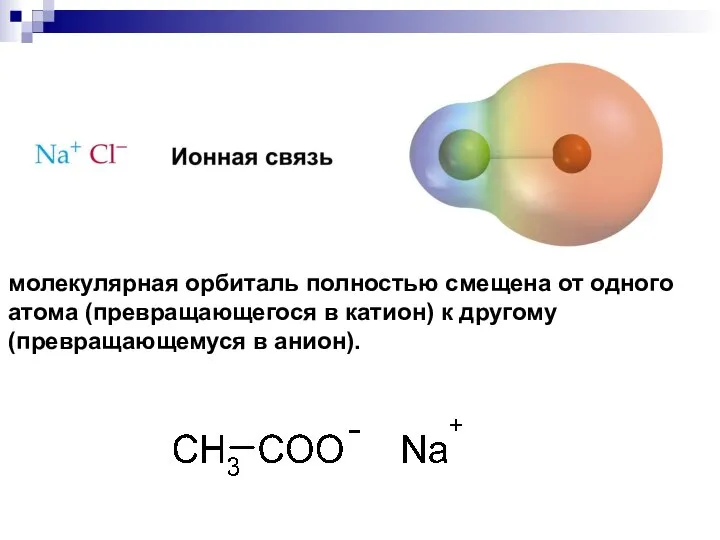
- 29. молекулярная орбиталь полностью смещена от одного атома (превращающегося в катион) к другому (превращающемуся в анион).
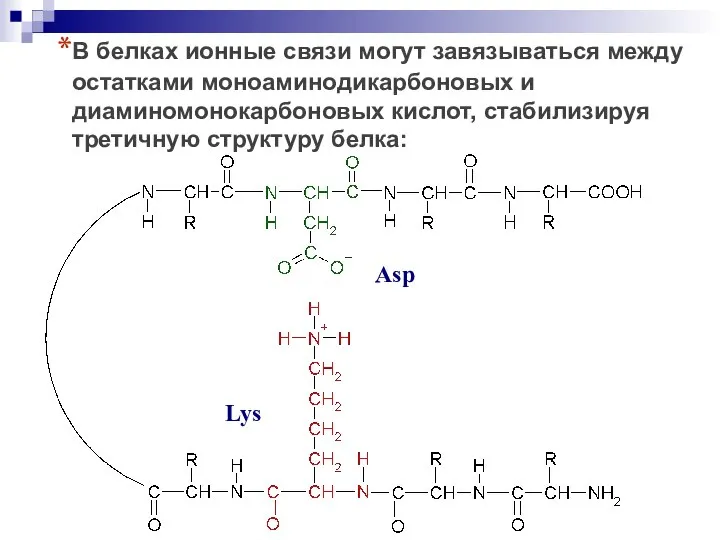
- 30. В белках ионные связи могут завязываться между остатками моноаминодикарбоновых и диаминомонокарбоновых кислот, стабилизируя третичную структуру белка:
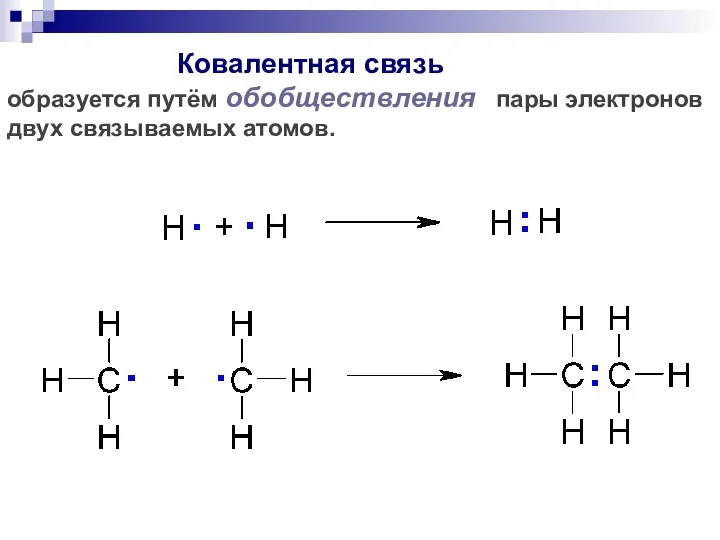
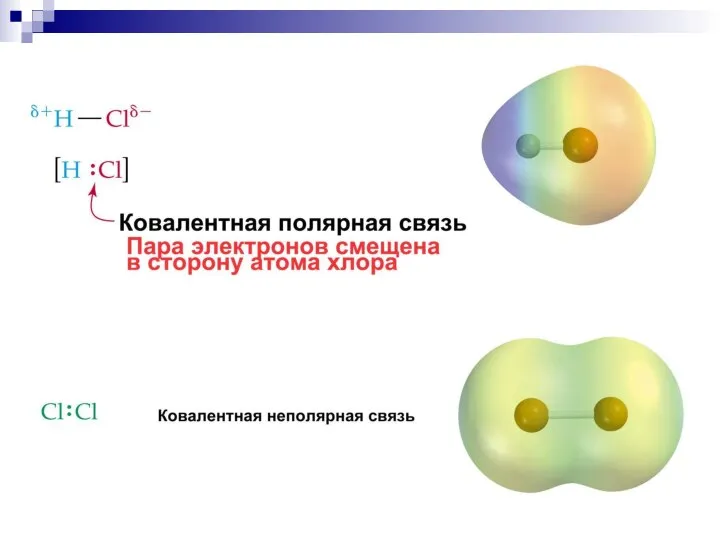
- 31. Ковалентная связь образуется путём обобществления пары электронов двух связываемых атомов.
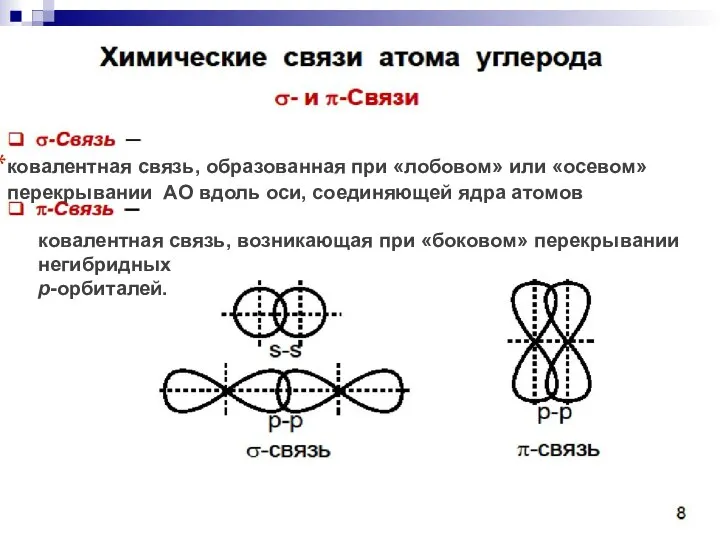
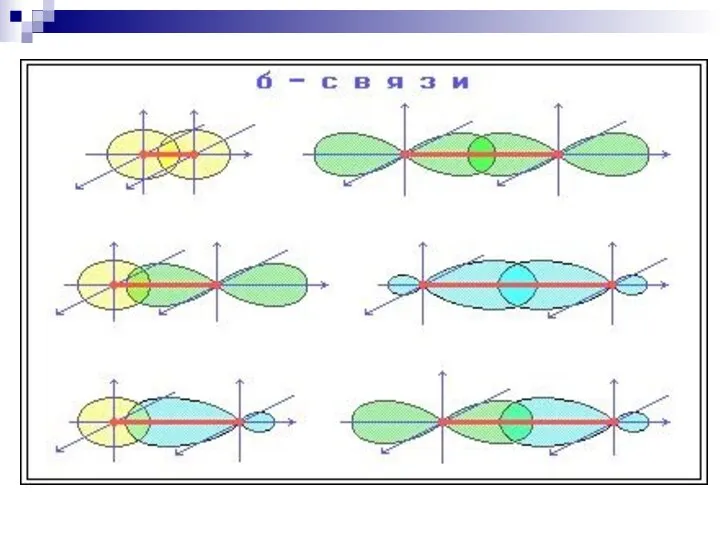
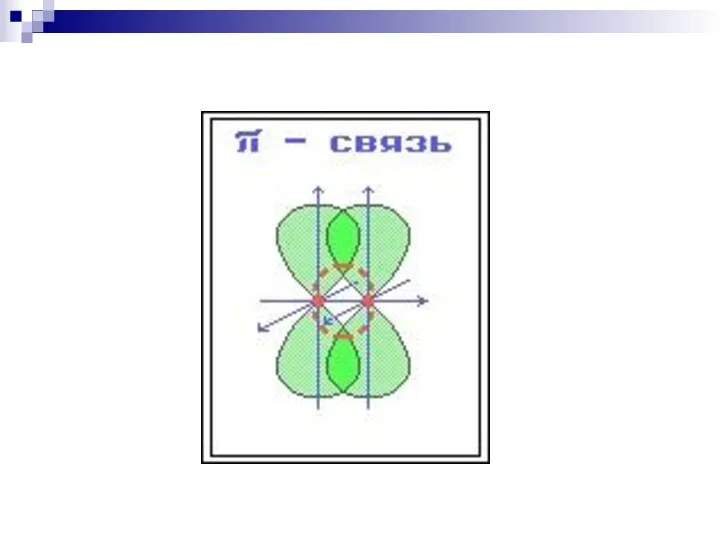
- 34. ковалентная связь, образованная при «лобовом» или «осевом» перекрывании АО вдоль оси, соединяющей ядра атомов ковалентная связь,
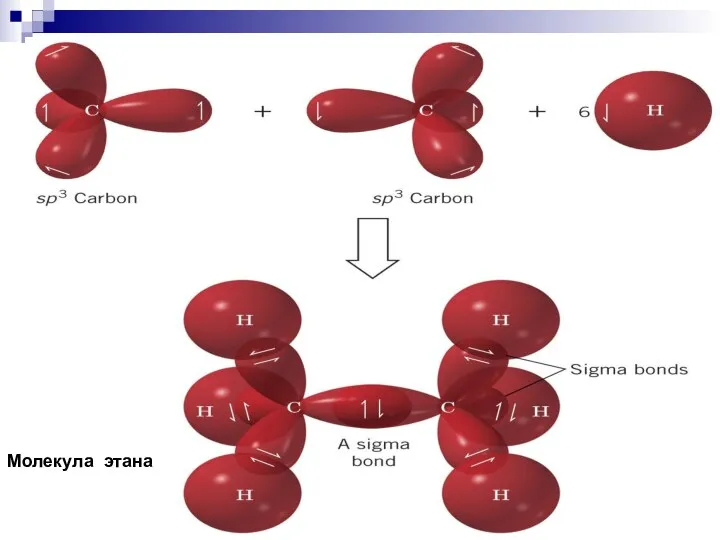
- 36. Молекула этана
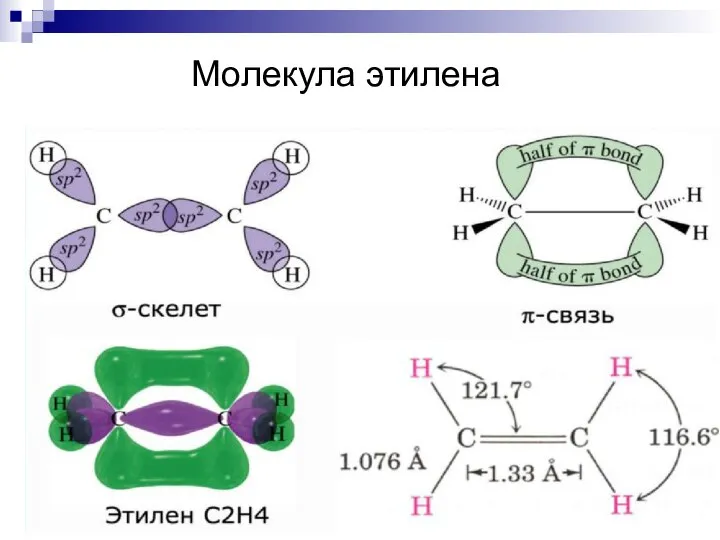
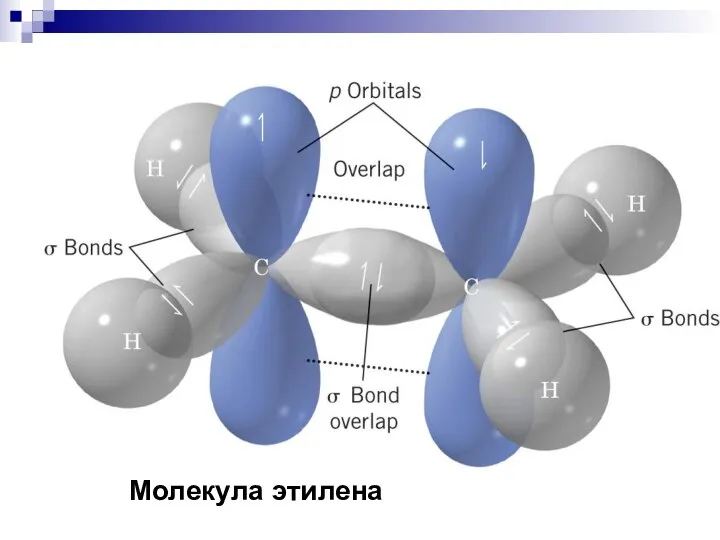
- 38. Молекула этилена
- 39. Молекула этилена
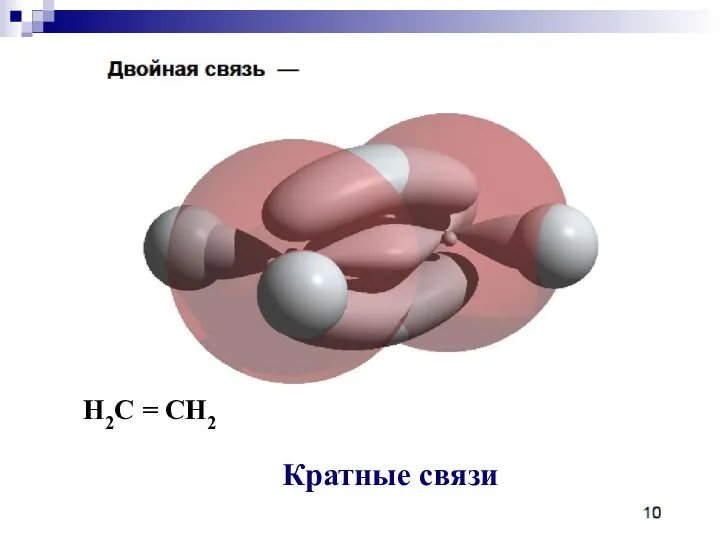
- 40. Кратные связи H2C = CH2
- 41. Молекула ацетилена
- 43. Характеристики ковалентных связей Ι. Энергия связи ΙΙ. Длина связи ΙΙΙ. Полярность IV. Поляризуемость Ι. ΙΙ.
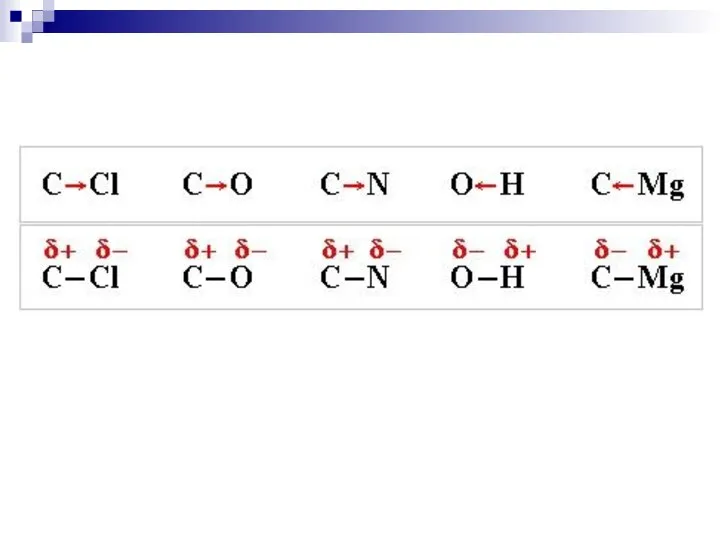
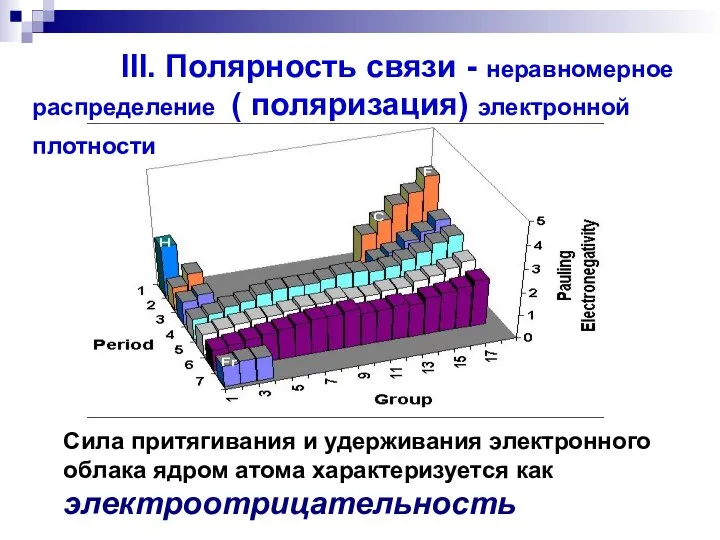
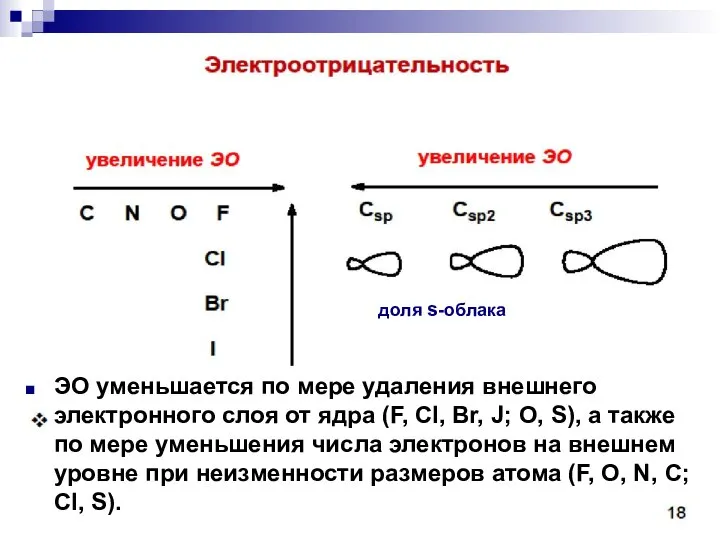
- 44. Сила притягивания и удерживания электронного облака ядром атома характеризуется как электроотрицательность III. Полярность связи - неравномерное
- 45. доля s-облака ЭО уменьшается по мере удаления внешнего электронного слоя от ядра (F, Cl, Br, J;
- 46. Шкала электроотрицательности по Полингу: F O Cl, N Br J C,
- 48. IV. Поляризуемость Ковалентная связь обладает поляризуемостью — способностью смещать электроны связи под влиянием внешнего электрического поля.
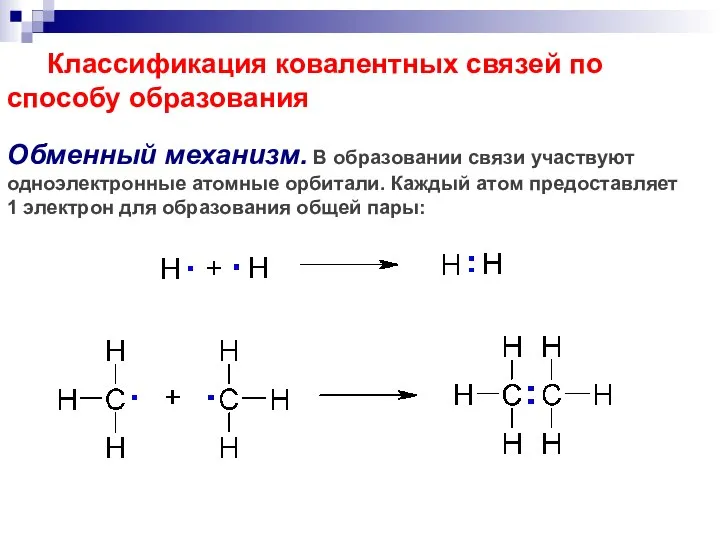
- 49. Классификация ковалентных связей по способу образования Обменный механизм. В образовании связи участвуют одноэлектронные атомные орбитали. Каждый
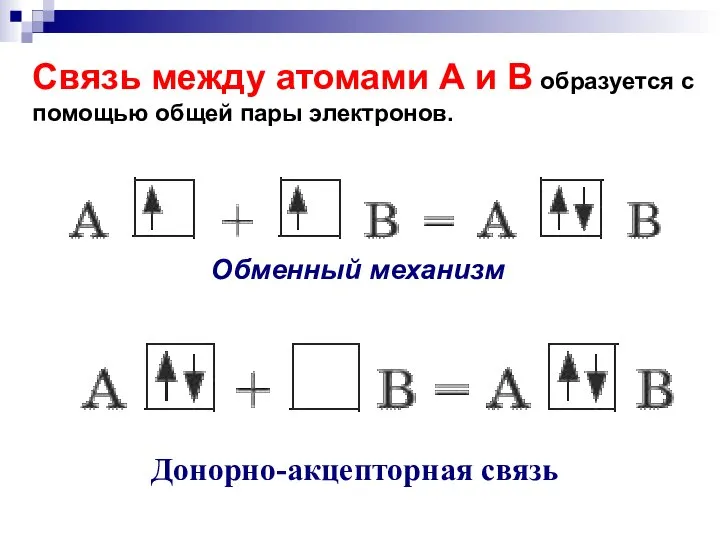
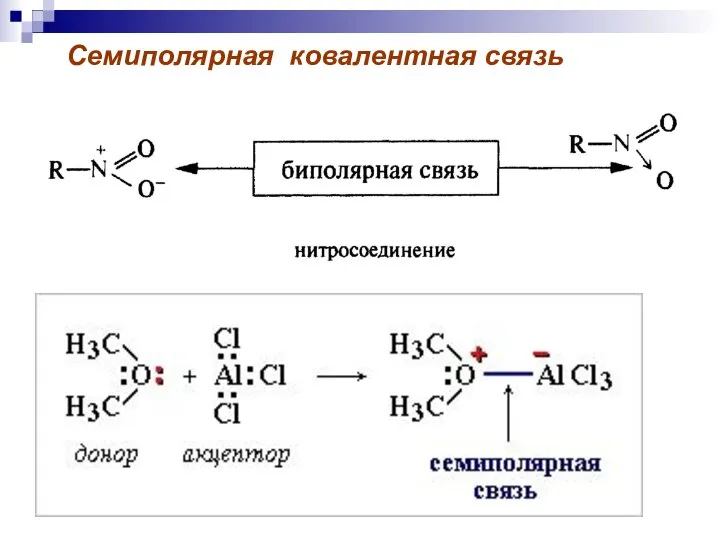
- 50. Связь между атомами А и В образуется с помощью общей пары электронов. Донорно-акцепторная связь Обменный механизм
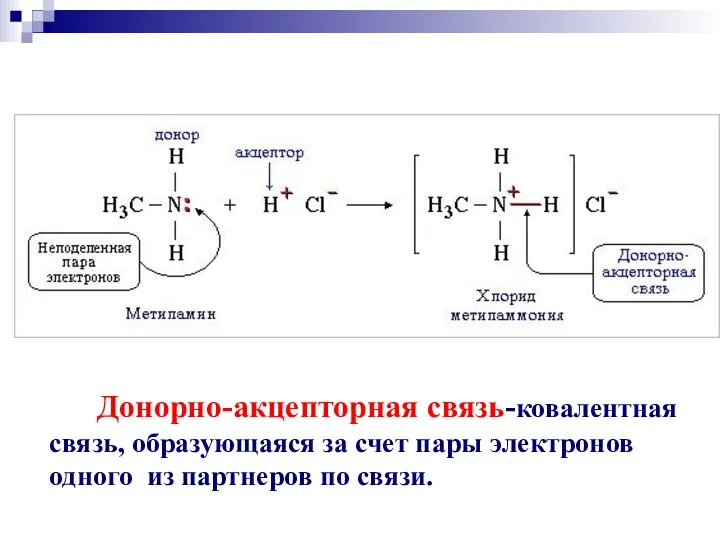
- 51. Донорно-акцепторная связь-ковалентная связь, образующаяся за счет пары электронов одного из партнеров по связи.
- 52. Семиполярная ковалентная связь
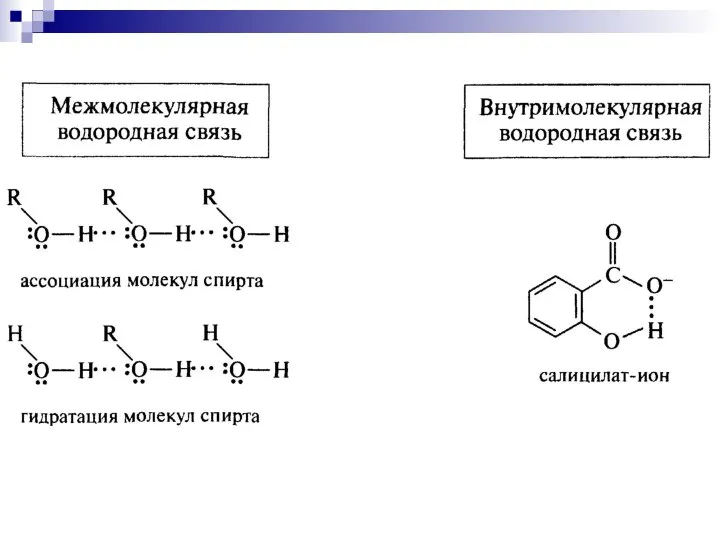
- 53. Водородная связь – притяжение протонизированного атома водорода, присоединённого к атому электроотрицательного элемента, к любому другому атому,
- 54. Водородная связь
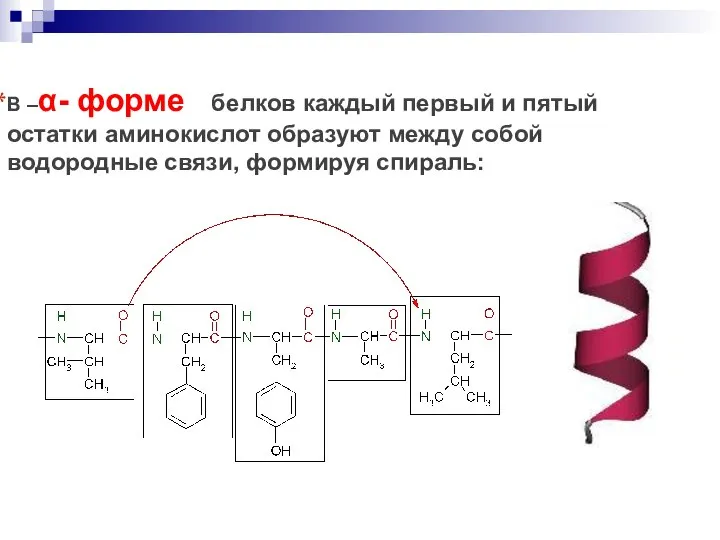
- 56. В –α- форме белков каждый первый и пятый остатки аминокислот образуют между собой водородные связи, формируя
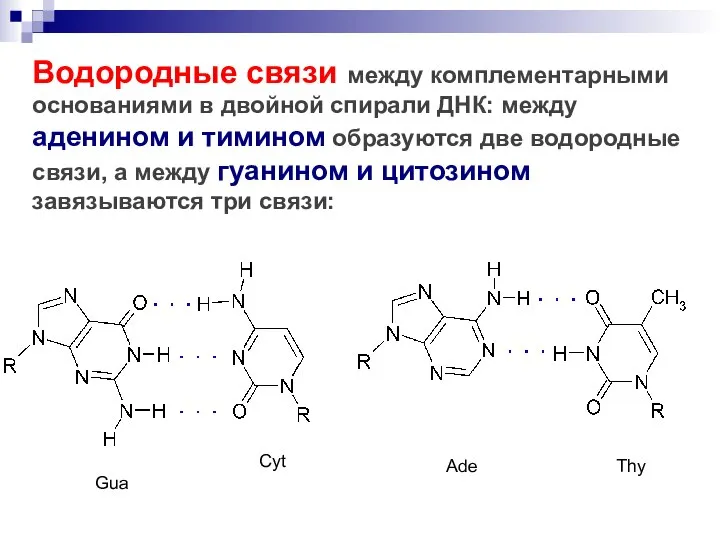
- 57. Водородные связи между комплементарными основаниями в двойной спирали ДНК: между аденином и тимином образуются две водородные
- 58. Локализованной, двухцентровой, называется двойная связь, в которой электронная плотность -связи охватывает только два ядра связываемых атомов.
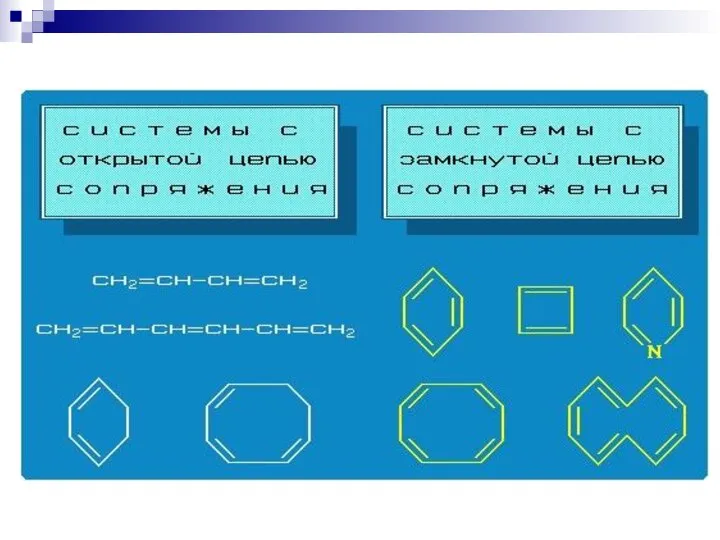
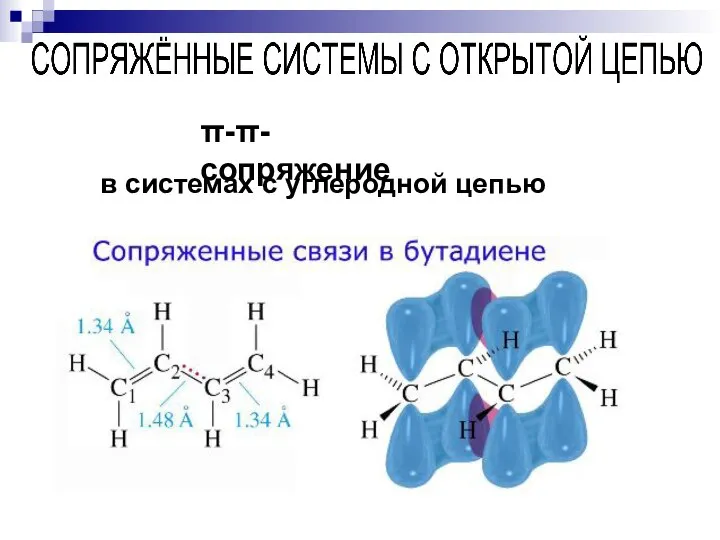
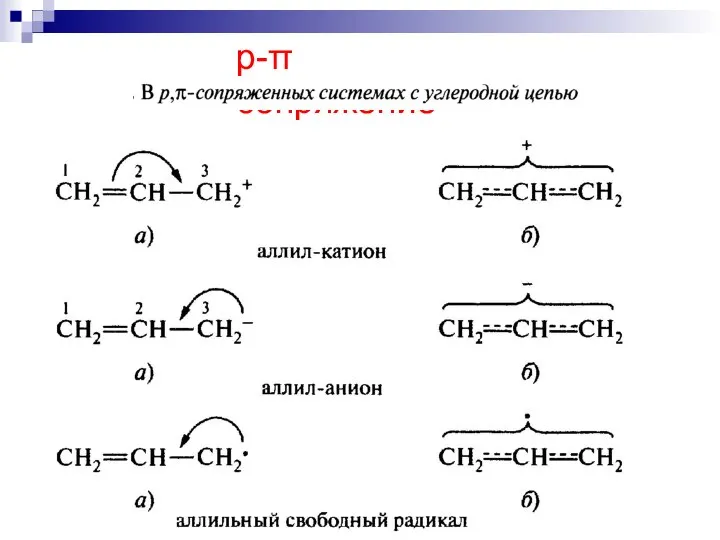
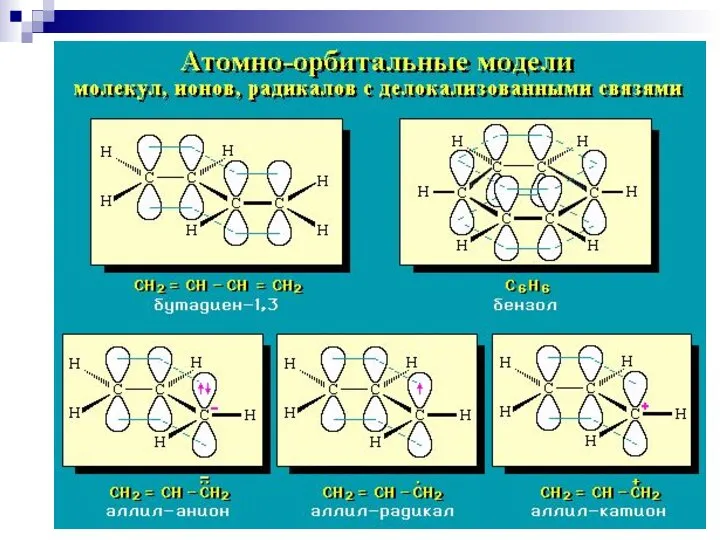
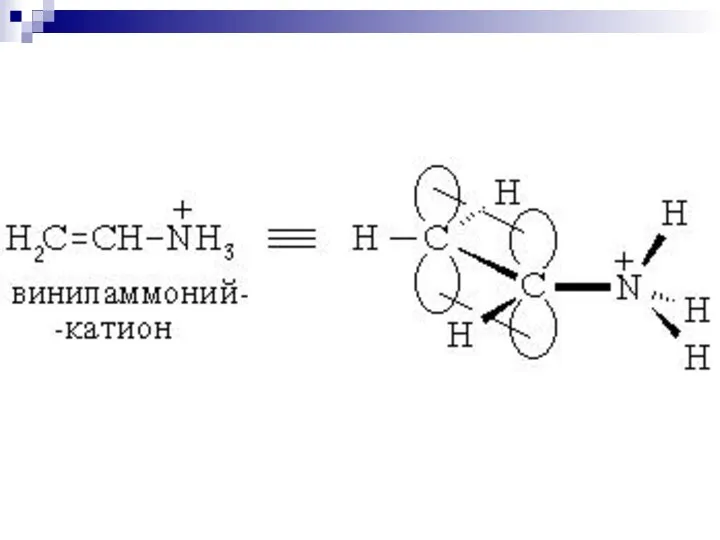
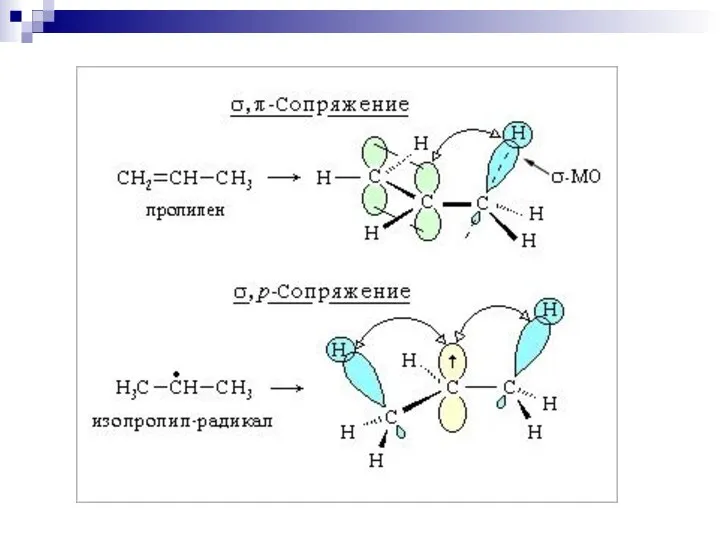
- 61. --сопряжение в системах с углеродной цепью
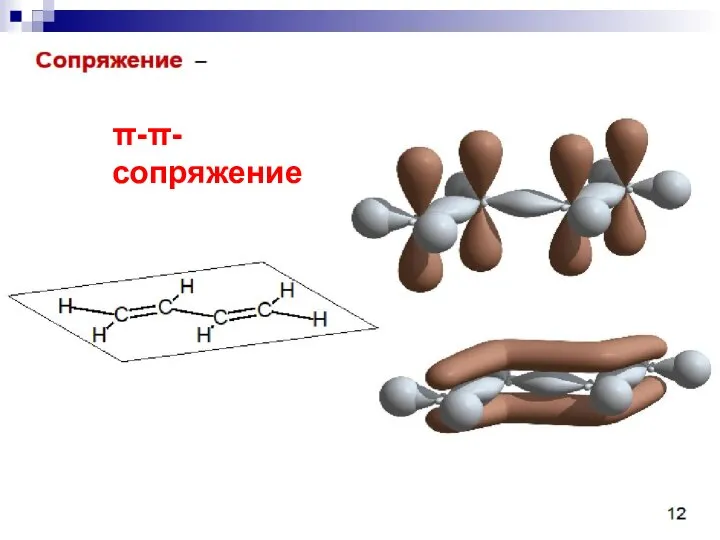
- 62. --сопряжение
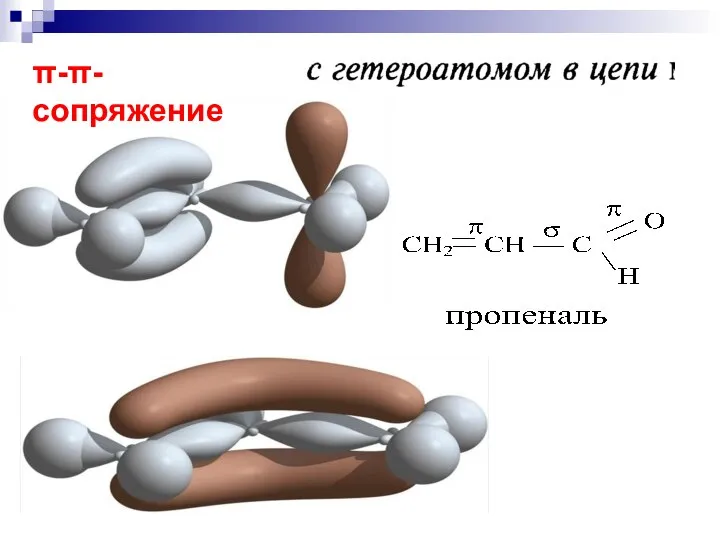
- 63. --сопряжение
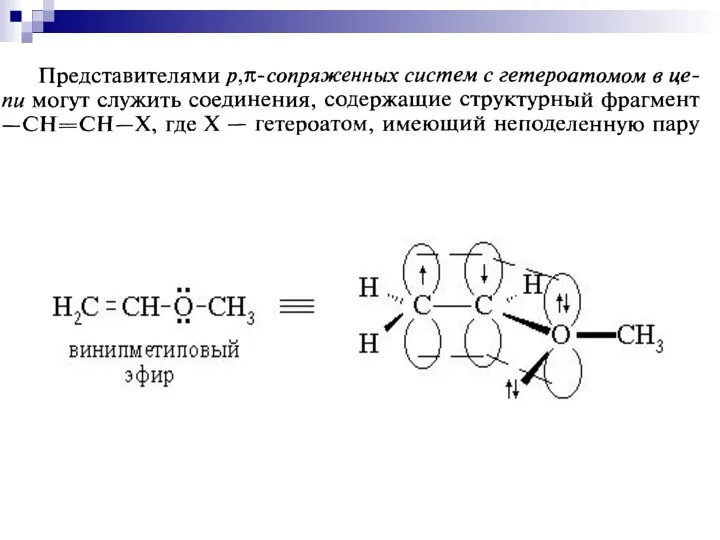
- 64. р- сопряжение
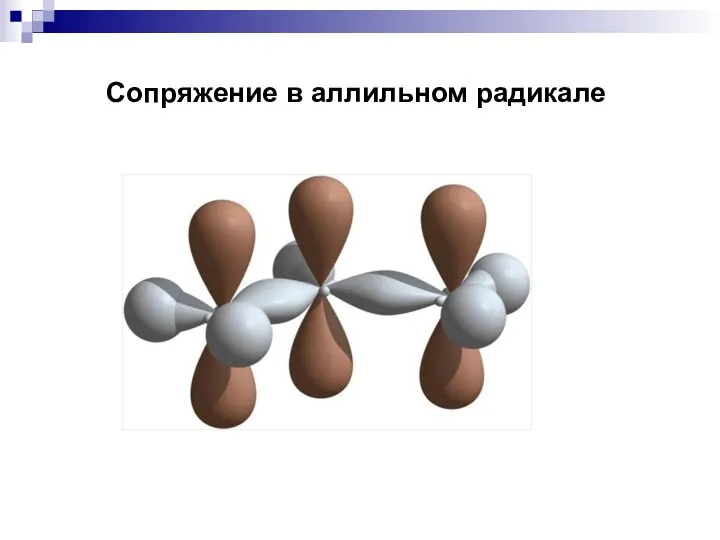
- 66. Сопряжение в аллильном радикале
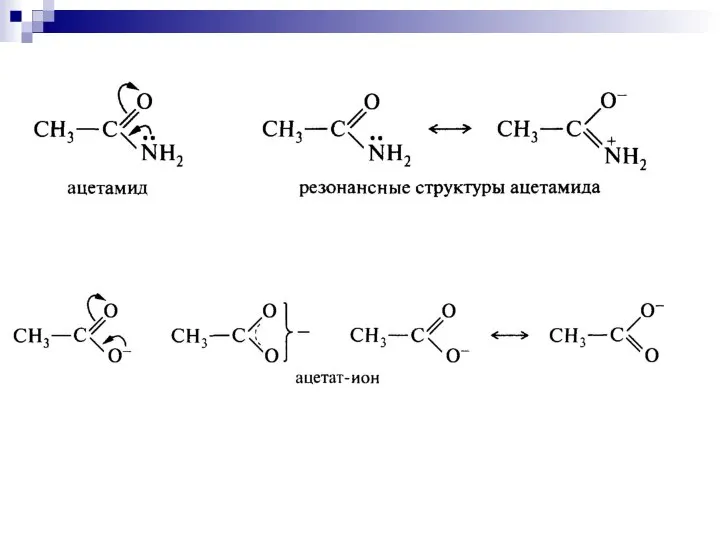
- 68. Теория резонанса. Распределение электронов в молекулах (в том числе сложных ионах или радикалах), является комбинацией (резонансом)
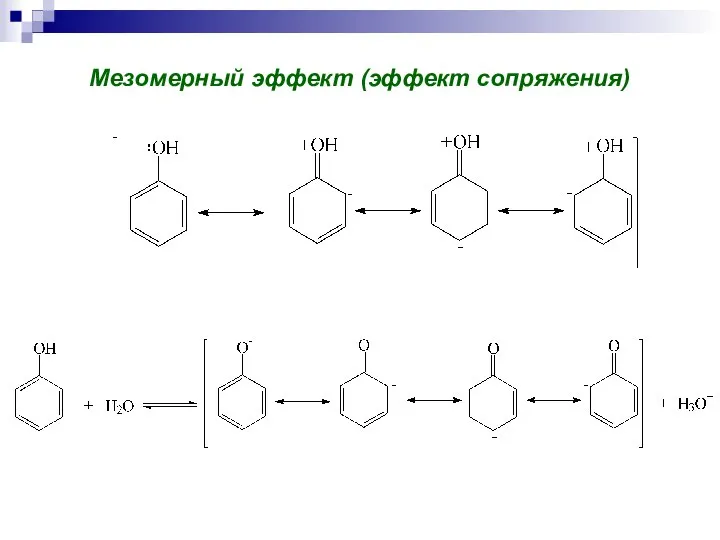
- 72. Мезомерный эффект (эффект сопряжения)
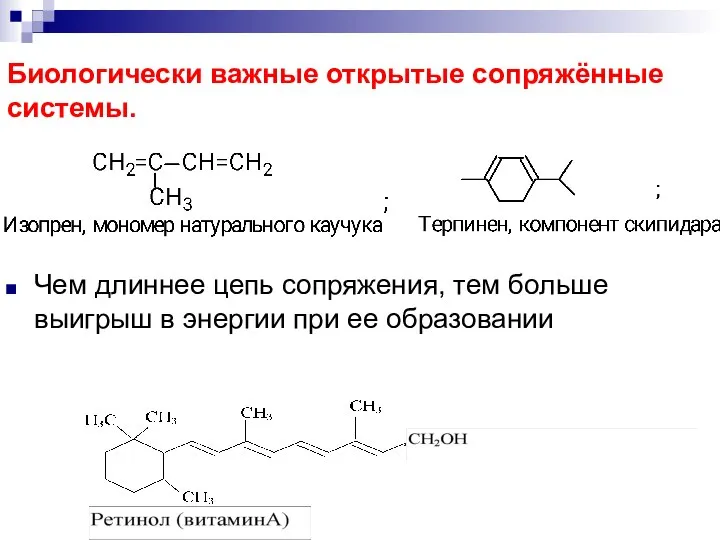
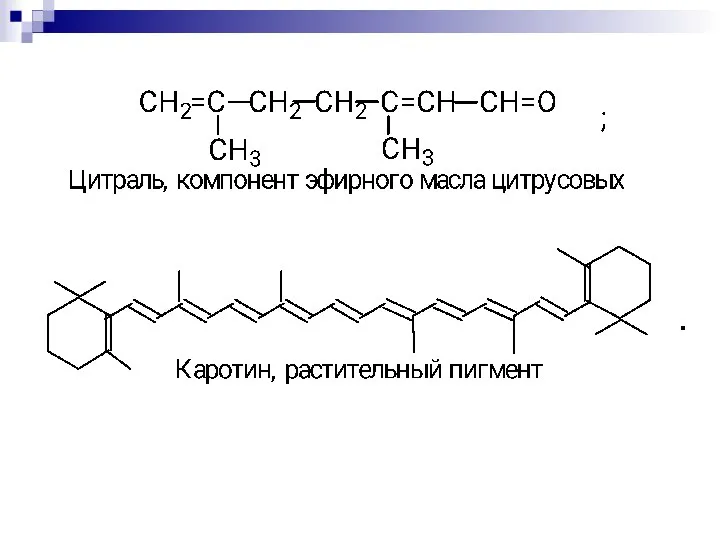
- 73. Биологически важные открытые сопряжённые системы. Чем длиннее цепь сопряжения, тем больше выигрыш в энергии при ее
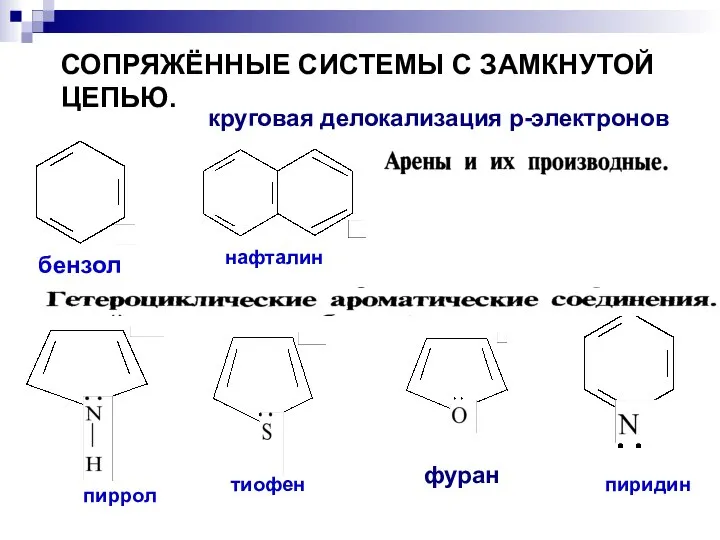
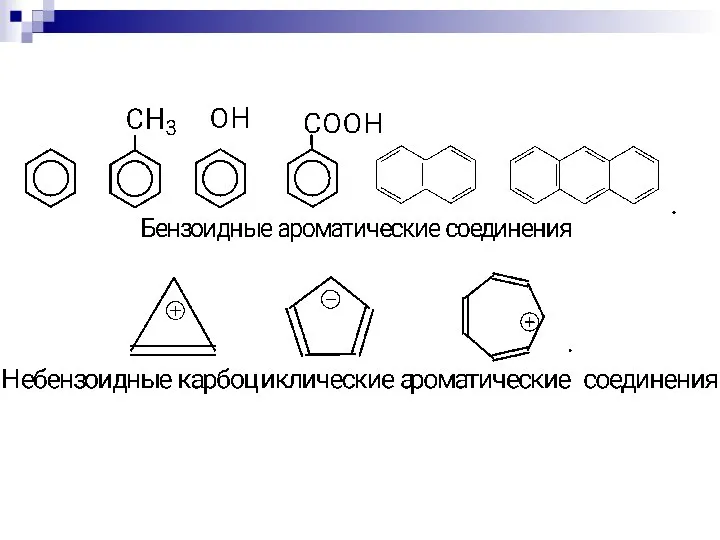
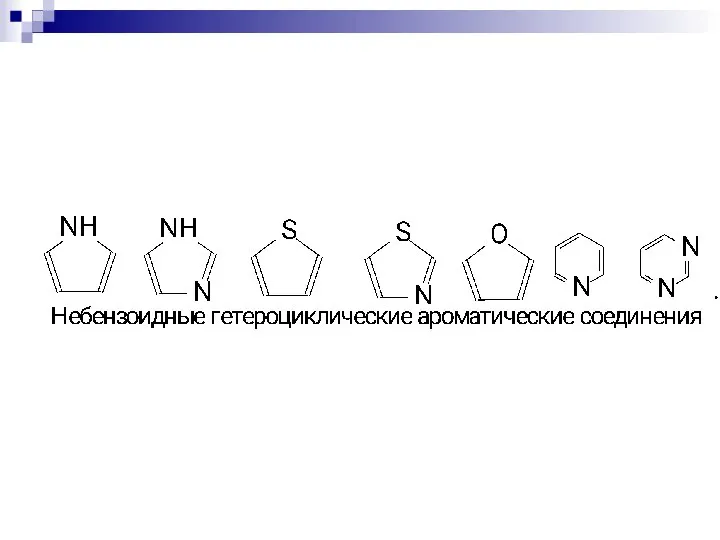
- 75. СОПРЯЖЁННЫЕ СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ. бензол нафталин пиррол тиофен пиридин круговая делокализация р-электронов фуран
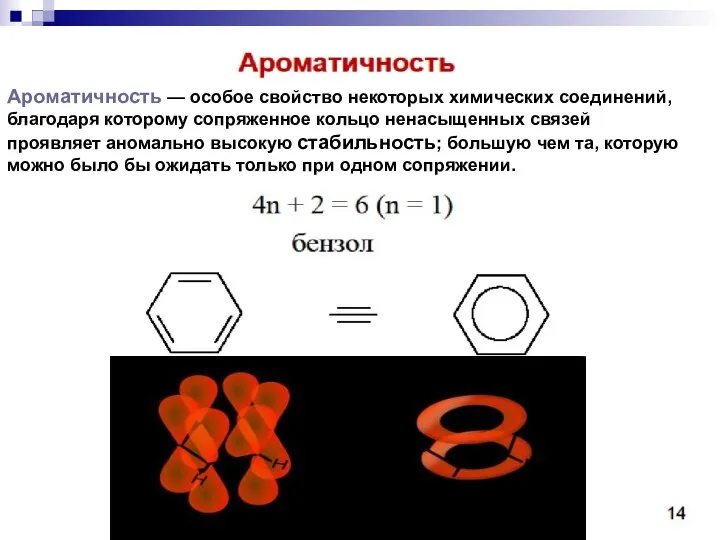
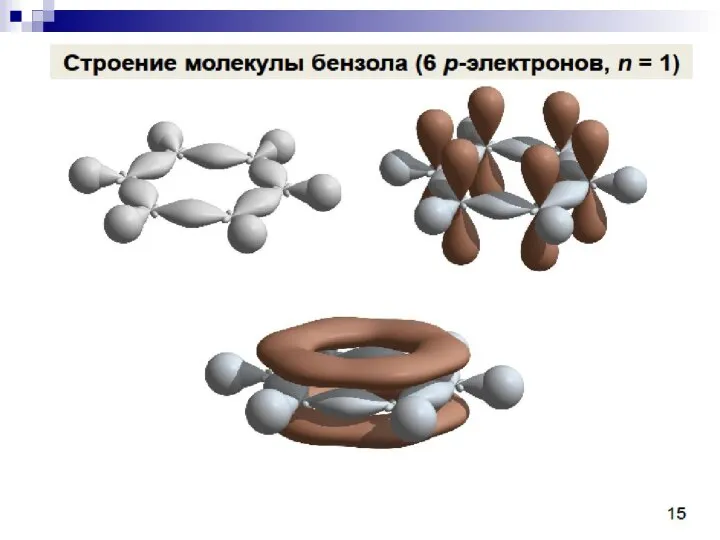
- 76. Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую
- 78. Ароматичность Эрих Арманд Артур Йозеф Хюккель ( Erich Armand Arthur Joseph Hückel ) (9 августа 1896,
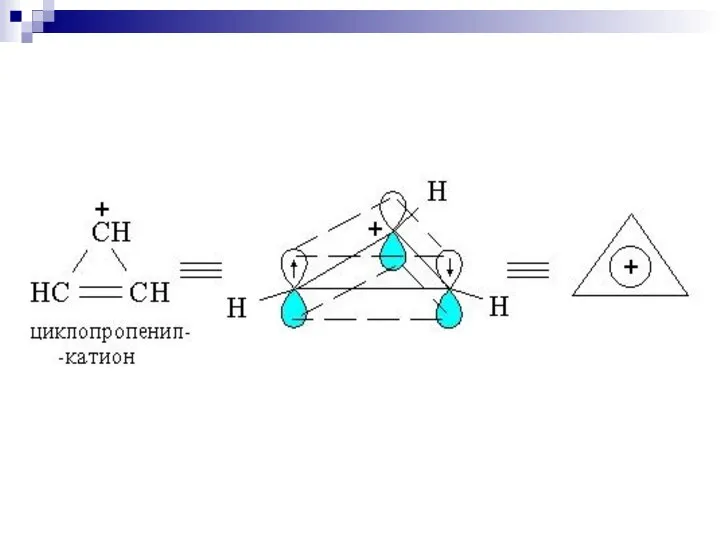
- 79. Правило Хюккеля. Система ароматична, если она обладает совокупностью следующих признаков: а) все атомы в цикле находятся
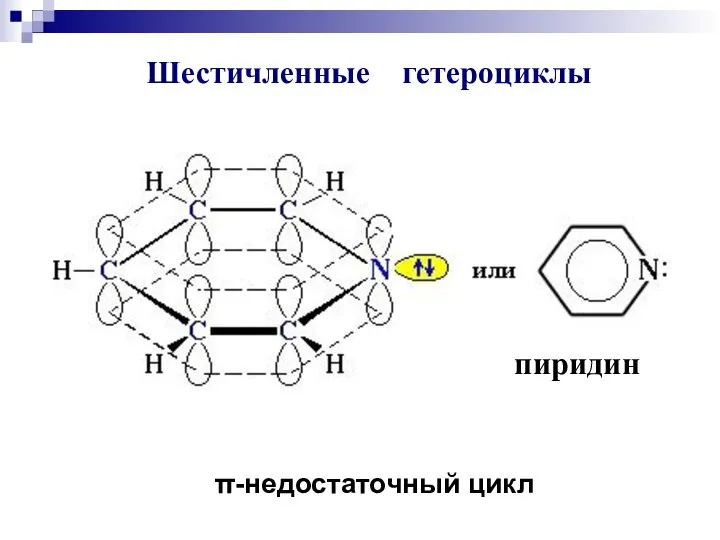
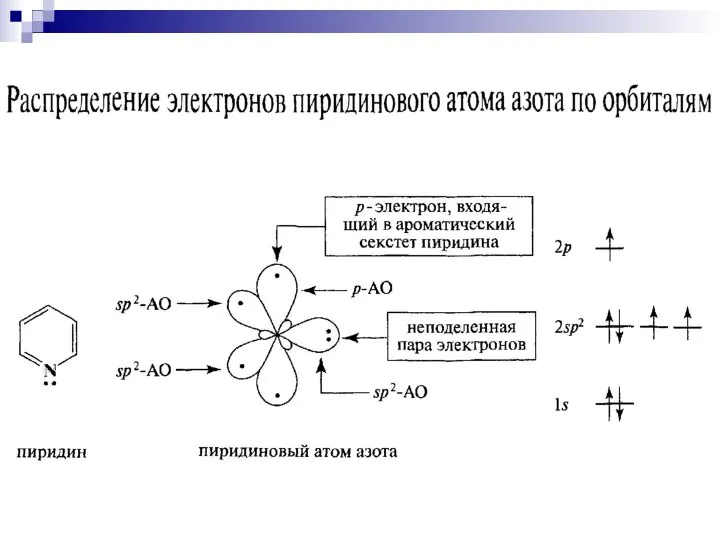
- 84. пиридин Шестичленные гетероциклы π-недостаточный цикл
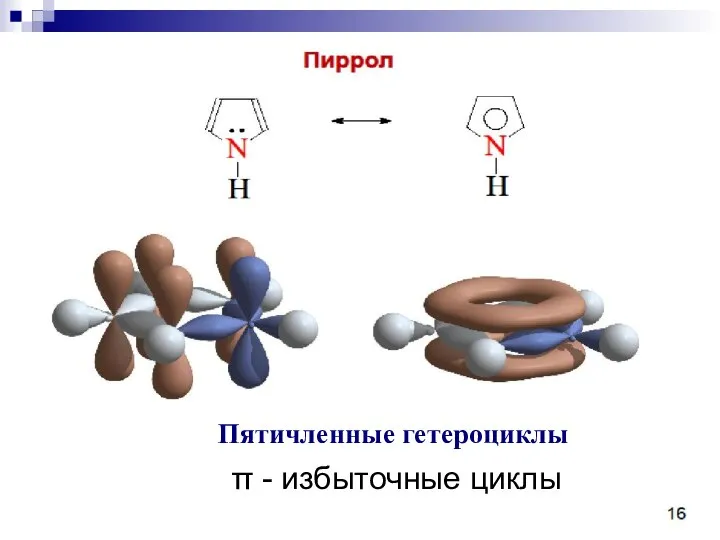
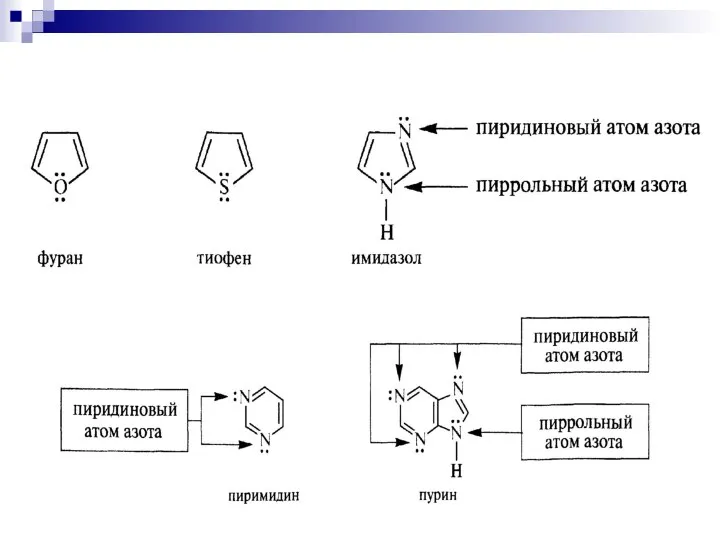
- 86. π - избыточные циклы Пятичленные гетероциклы
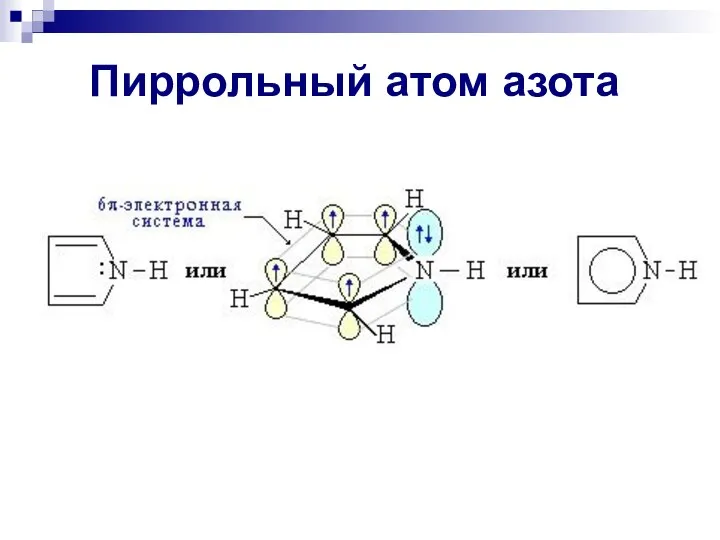
- 87. Пиррольный атом азота
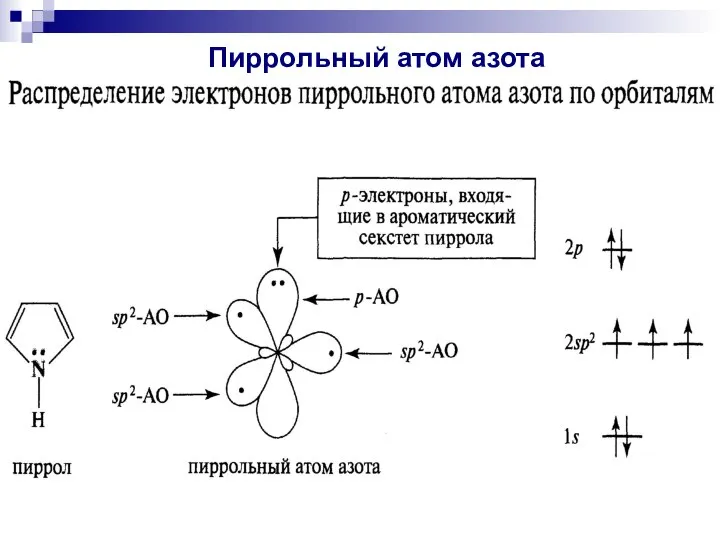
- 88. Пиррольный атом азота
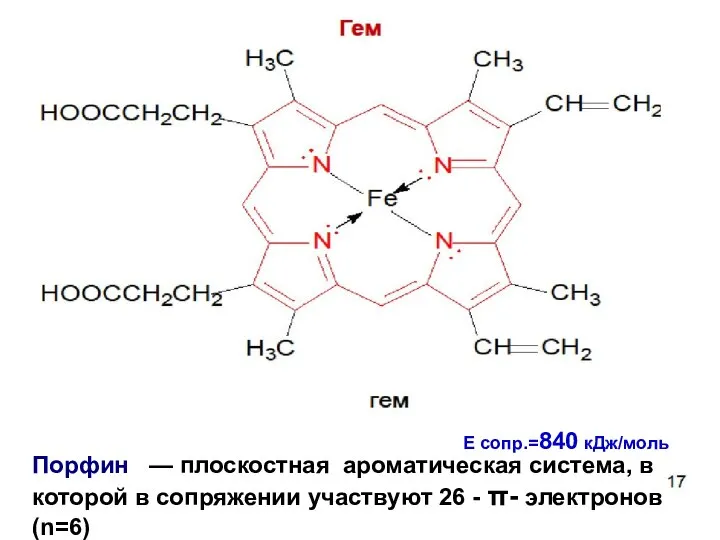
- 89. Порфин — плоскостная ароматическая система, в которой в сопряжении участвуют 26 - - электронов (n=6) Е
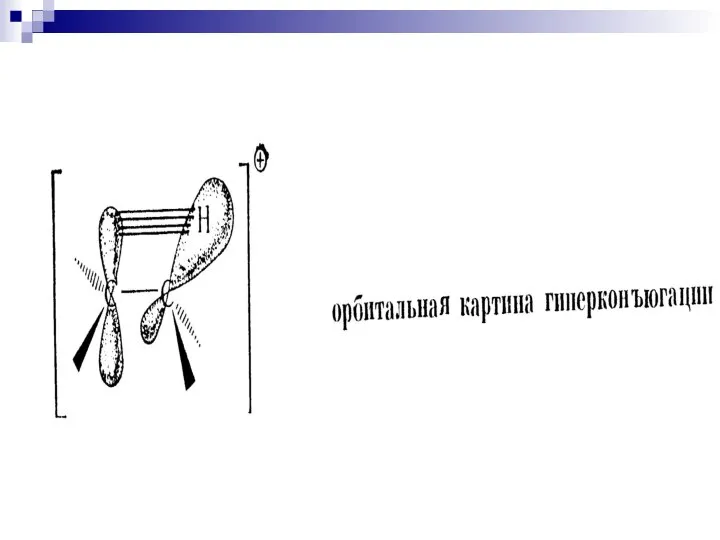
- 91. Взаимное влияние атомов в молекуле Сверхсопряжение (гиперконъюгация) 2-метилбутен-2 2-метилбутен-1 – стабилизация частично заполненной или свободной орбитали
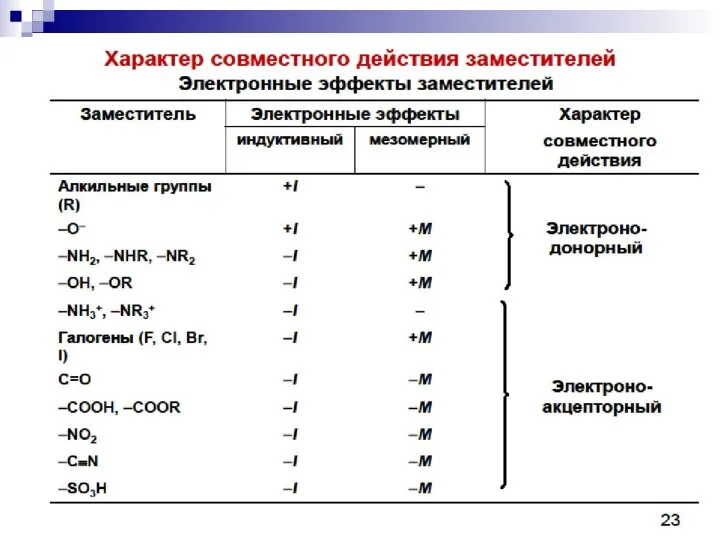
- 94. Взаимное влияние атомов в молекуле Индуктивный эффект Смещение электронной плотности по цепи -связей называется индуктивным эффектом
- 95. Электроноакцепторные заместители X, т.е. атом или группа атомов, смещающие электронную плотность -связи от атома углерода, проявляют
- 96. –I эффект проявляют 1. заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl,
- 97. +I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: 1. - насыщенные углеводородные радикалы (-CH3, -C2H5)
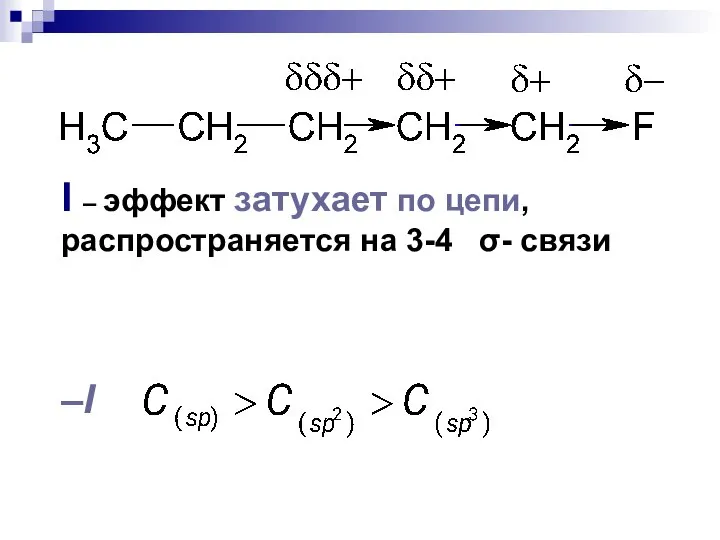
- 98. I – эффект затухает по цепи, распространяется на 3-4 σ- связи –I
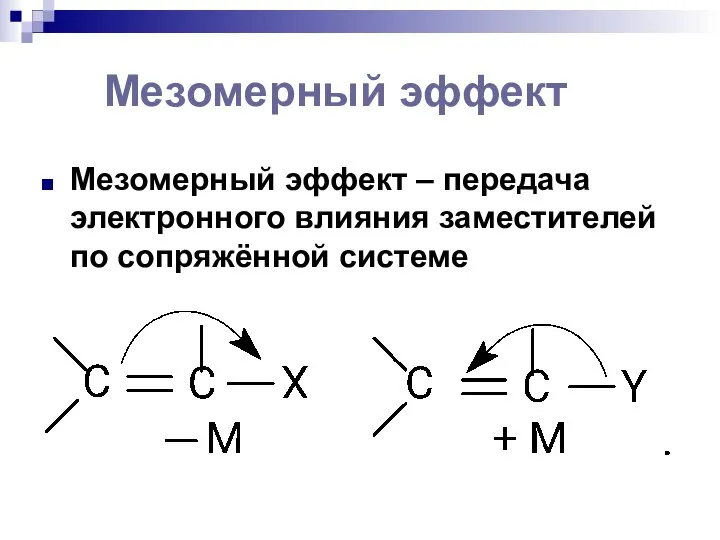
- 99. Мезомерный эффект Мезомерный эффект – передача электронного влияния заместителей по сопряжённой системе
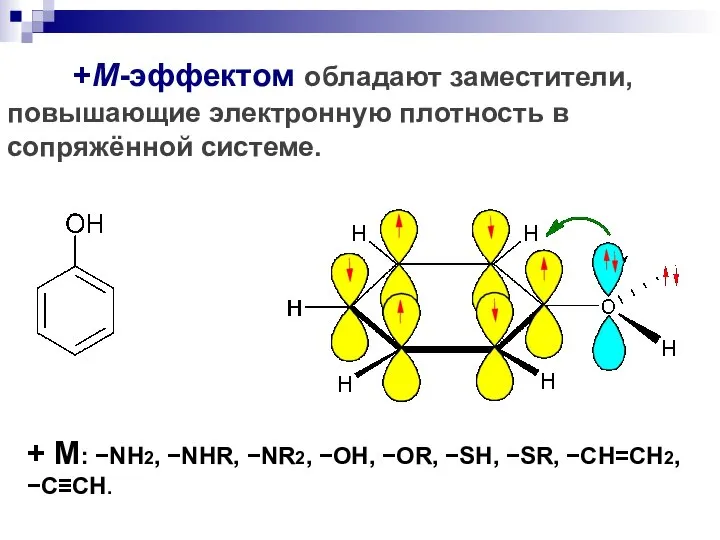
- 100. +М-эффектом обладают заместители, повышающие электронную плотность в сопряжённой системе. + М: NH2, NHR, NR2, OH, OR,
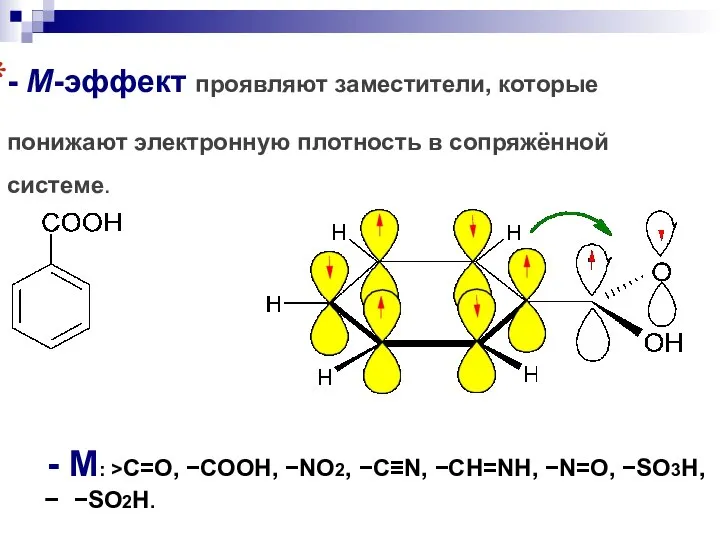
- 101. - М-эффект проявляют заместители, которые понижают электронную плотность в сопряжённой системе. - M: C=O, COOH, NO2,
- 104. Спасибо за внимание!
- 111. 2. Систематическая номенклатура ИЮПАК
- 114. Скачать презентацию





























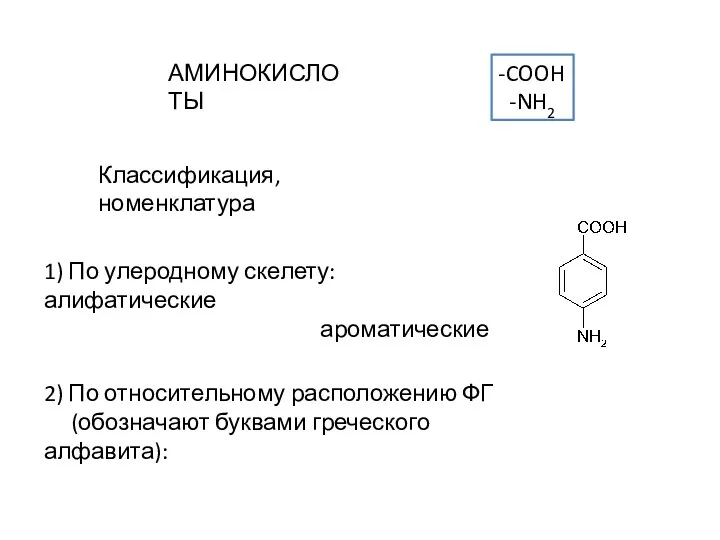 Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Фазовые равновесия
Фазовые равновесия Электролитическая диссоциация
Электролитическая диссоциация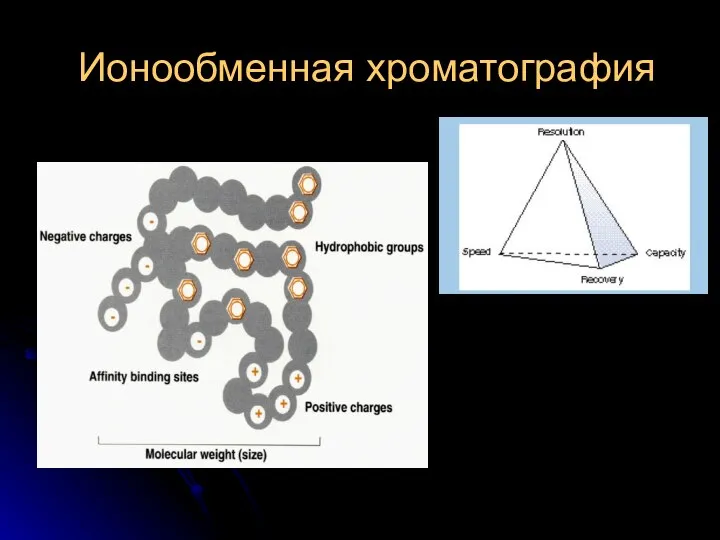 Ионообменная хроматография
Ионообменная хроматография Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Биохимия печени
Биохимия печени Потенциометрия. Методы потенциометрии, и их применение в медицине. Плюсы и минусы методов ПТ
Потенциометрия. Методы потенциометрии, и их применение в медицине. Плюсы и минусы методов ПТ Кристаллические решетки
Кристаллические решетки Атомные спектры
Атомные спектры Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде
Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде Высокопроизводительное моторное масло для бензиновых и дизельных двигателей
Высокопроизводительное моторное масло для бензиновых и дизельных двигателей Добавки, красители и консерванты в пищевых продуктах
Добавки, красители и консерванты в пищевых продуктах «Адамсит». Дигидрофенарсазинхлорид HN(C6H4)2AsCl
«Адамсит». Дигидрофенарсазинхлорид HN(C6H4)2AsCl Метасоматический процесс
Метасоматический процесс Относительная атомная масса
Относительная атомная масса Адские задания. ЕГЭ по химии
Адские задания. ЕГЭ по химии Презентация по Химии "Хімія в повсякденному житті" - скачать смотреть бесплатно
Презентация по Химии "Хімія в повсякденному житті" - скачать смотреть бесплатно Классификация неорганических веществ
Классификация неорганических веществ Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ Спирт. Спирты в природе. Влияние спирта на человека
Спирт. Спирты в природе. Влияние спирта на человека Физические и химические свойства воды
Физические и химические свойства воды Электрохимические методы. (Лекция 3)
Электрохимические методы. (Лекция 3) Такая знакомая сода
Такая знакомая сода Электролиз. 9 класс
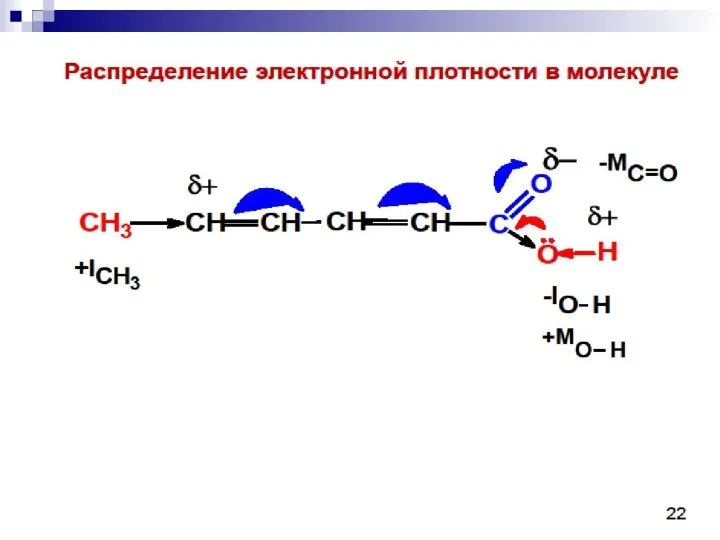
Электролиз. 9 класс Биохимия лёгких
Биохимия лёгких Кафедры биохимии УГМУ в прошлом и настоящем
Кафедры биохимии УГМУ в прошлом и настоящем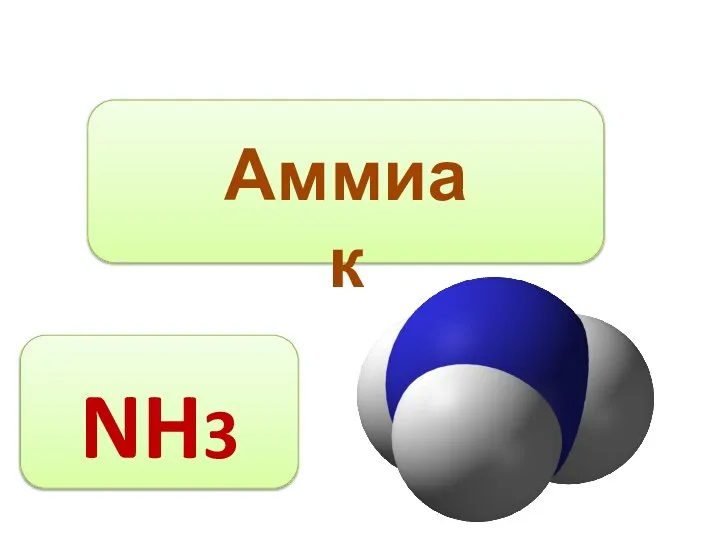 Состав вещества
Состав вещества