Содержание
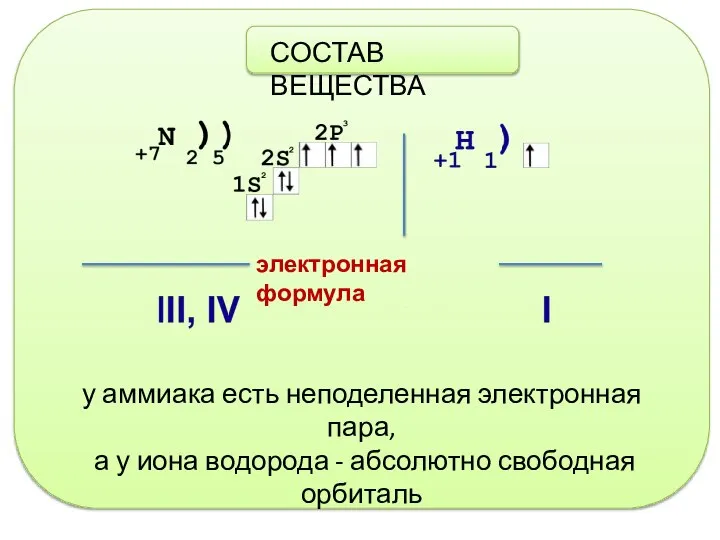
- 2. СОСТАВ ВЕЩЕСТВА у аммиака есть неподеленная электронная пара, а у иона водорода - абсолютно свободная орбиталь
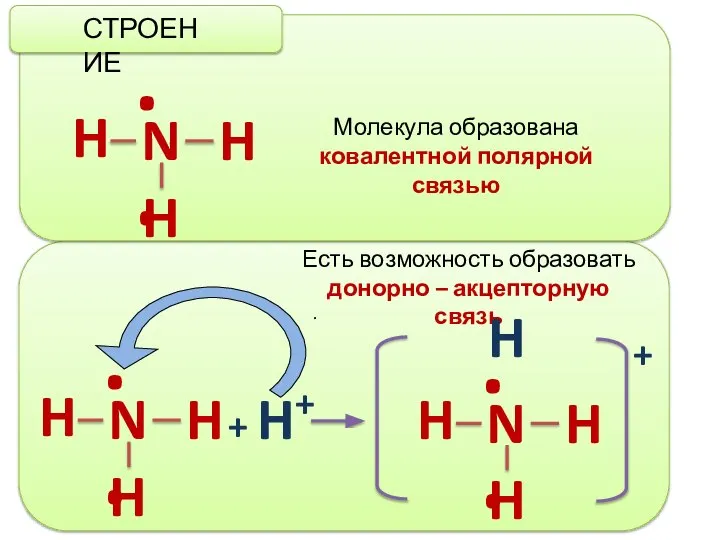
- 3. . СТРОЕНИЕ Молекула образована ковалентной полярной связью Есть возможность образовать донорно – акцепторную связь + H+
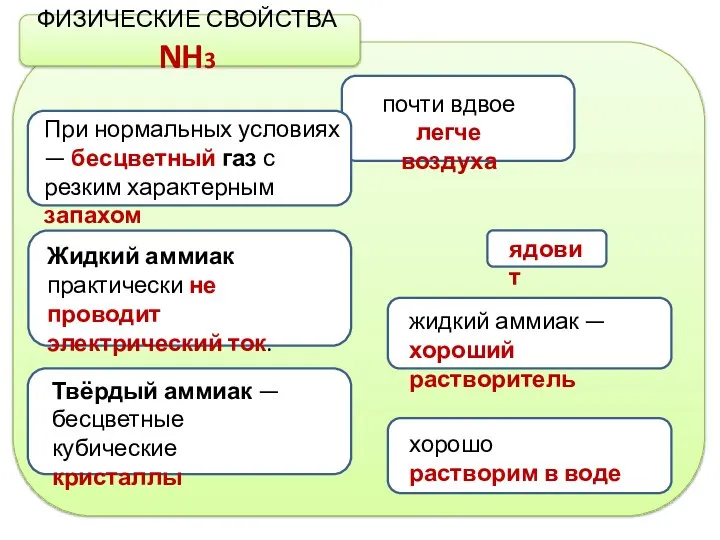
- 4. жидкий аммиак — хороший растворитель хорошо растворим в воде При нормальных условиях — бесцветный газ с
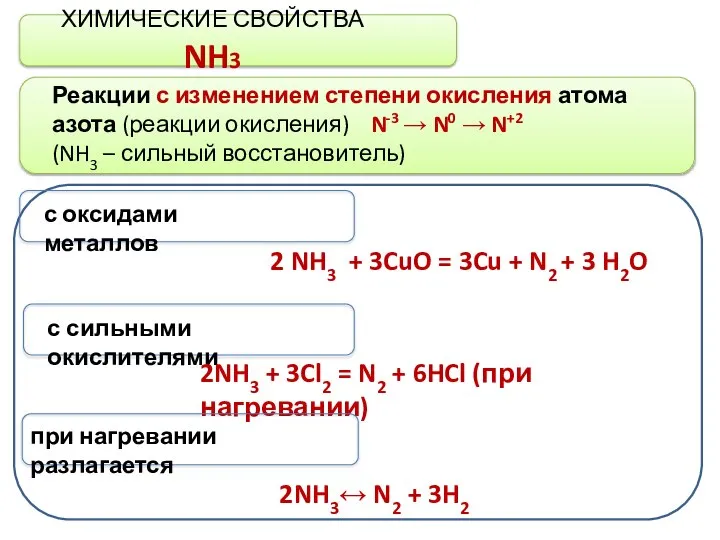
- 5. ХИМИЧЕСКИЕ СВОЙСТВА NH3 Реакции с изменением степени окисления атома азота (реакции окисления) N-3 → N0 →
- 6. ХИМИЧЕСКИЕ СВОЙСТВА NH3 Реакции с изменением степени окисления атома азота (реакции окисления) N-3 → N0 →
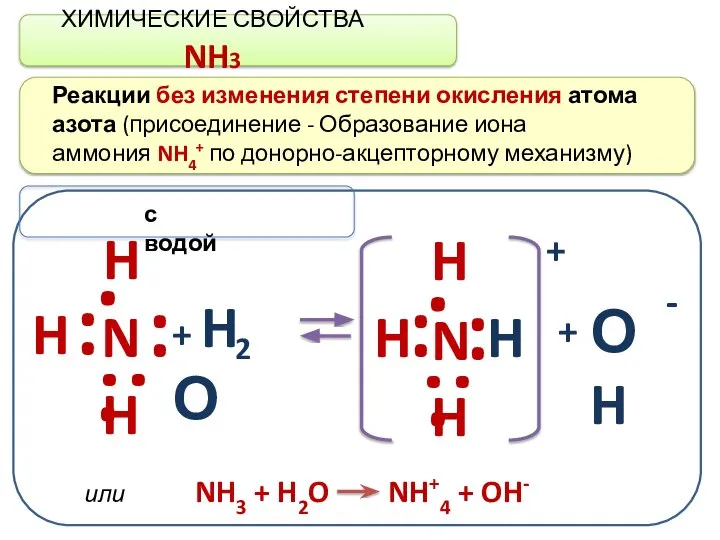
- 7. ХИМИЧЕСКИЕ СВОЙСТВА NH3 Реакции без изменения степени окисления атома азота (присоединение - Образование иона аммония NH4+
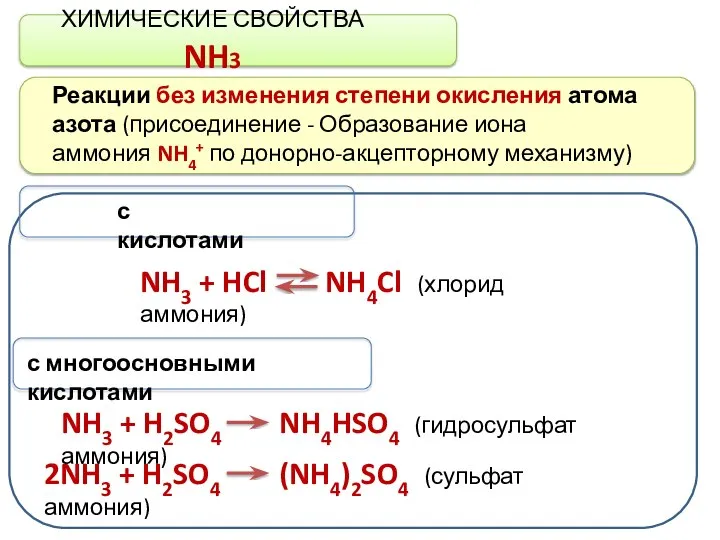
- 8. ХИМИЧЕСКИЕ СВОЙСТВА NH3 Реакции без изменения степени окисления атома азота (присоединение - Образование иона аммония NH4+
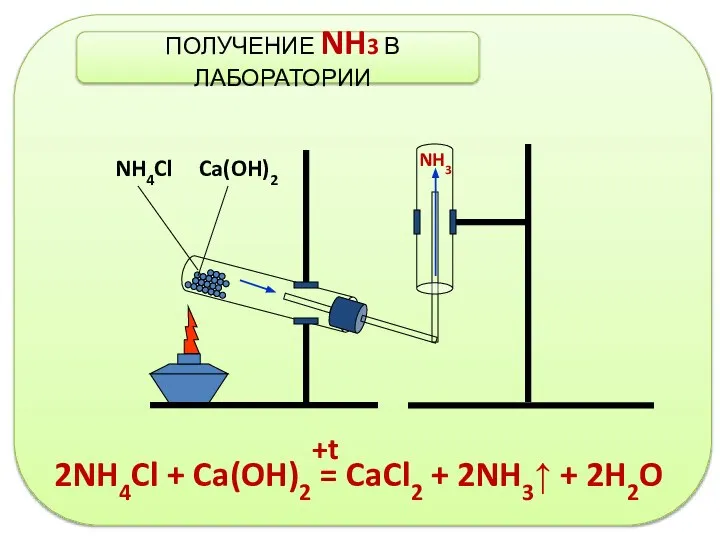
- 9. 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O +t NH4Cl Ca(OH)2 NH3 ПОЛУЧЕНИЕ NH3 В
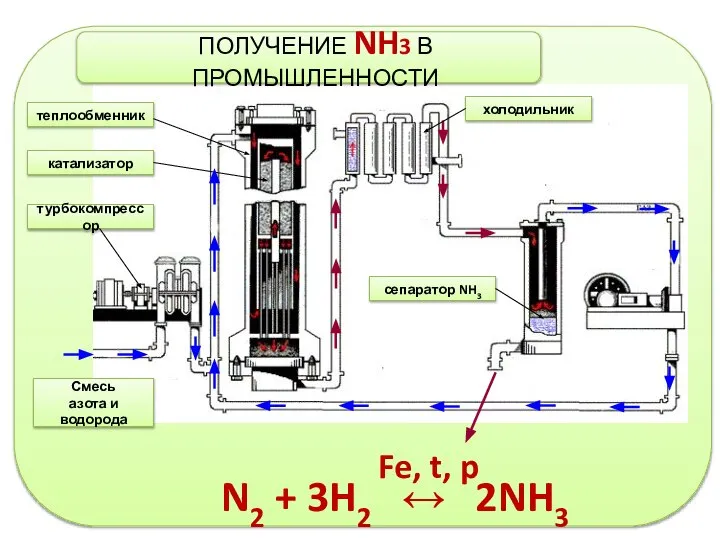
- 10. N2 + 3H2 ↔ 2NH3 Fe, t, p Смесь азота и водорода турбокомпрессор катализатор теплообменник холодильник
- 11. ПРИМЕНЕНИЕ NH3 в медицине (нашатырный спирт) для получения азотной кислоты производство удобрений в качестве дешевого хладагента
- 13. Скачать презентацию


 Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Вакуумное фильтрование
Вакуумное фильтрование Битумы природного происхождения
Битумы природного происхождения Растворение. Растворы
Растворение. Растворы Вещества
Вещества Пропан, C3H8
Пропан, C3H8 Презентация по Химии "Соединения" - скачать смотреть бесплатно
Презентация по Химии "Соединения" - скачать смотреть бесплатно Минералы и Близнецы
Минералы и Близнецы Озоновый слой. Механизмы образования и разрушения
Озоновый слой. Механизмы образования и разрушения Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Химические реакции (11 класс)
Химические реакции (11 класс) Диазо- и азосоединения
Диазо- и азосоединения Структура кристаллических полимеров
Структура кристаллических полимеров Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Железо. Физические и химические свойства
Железо. Физические и химические свойства Презентация по Химии "ЖИРНЫЕ КИСЛОТЫ СОСТАВНЫЕ ЧАСТИ ЛИПИДОВ" - скачать смотреть бесплатно
Презентация по Химии "ЖИРНЫЕ КИСЛОТЫ СОСТАВНЫЕ ЧАСТИ ЛИПИДОВ" - скачать смотреть бесплатно Работу выполнила: Ученица 9 класса ГОУ Лицея № 1524 Г.Москвы Себко Екатерина Научный руководитель: Учитель химии ГОУ Лицея № 1524 К
Работу выполнила: Ученица 9 класса ГОУ Лицея № 1524 Г.Москвы Себко Екатерина Научный руководитель: Учитель химии ГОУ Лицея № 1524 К Методы светорассеяния для исследования растворов (био) полимеров и наночастиц
Методы светорассеяния для исследования растворов (био) полимеров и наночастиц Презентация по Химии "Семь доисторических металлов" - скачать смотреть
Презентация по Химии "Семь доисторических металлов" - скачать смотреть  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Shapes of molecules
Shapes of molecules Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се
Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се Статья двумя способами. Приготовление катализатора
Статья двумя способами. Приготовление катализатора Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона
Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона Оксиды азота
Оксиды азота Тест по теме «Альдегиды и кетоны»
Тест по теме «Альдегиды и кетоны» Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Химическая очистка воды
Химическая очистка воды