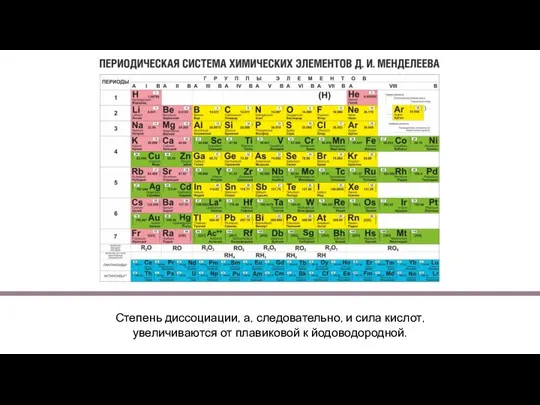
Содержание
- 2. Галогеноводородные кислоты
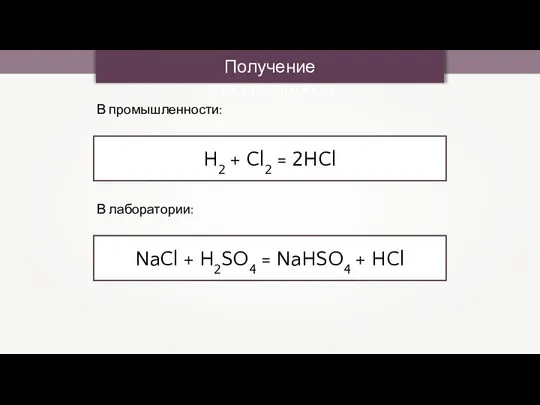
- 4. Получение хлороводорода В промышленности: H2 + Cl2 = 2HCl В лаборатории: NaCl + H2SO4 = NaHSO4
- 5. Соляная кислота — это бесцветная жидкость, которая дымится на воздухе. Соляная кислота тяжелее воды.
- 6. Химические свойства соляной кислоты Взаимодействие с металлами: 6HCl + 2Al = 2AlCl3 + 3H2↑ Взаимодействие с
- 8. Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды и йодиды. Большинство таких солей хорошо растворимы в воде.
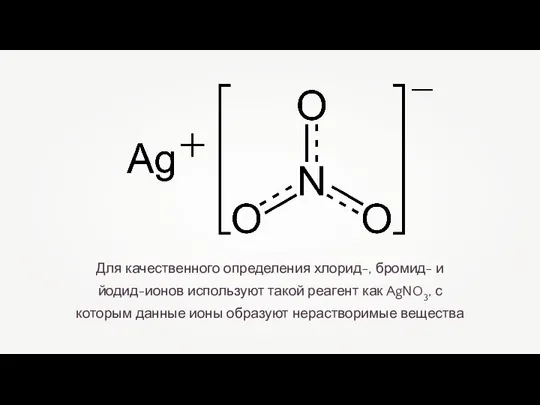
- 9. Для качественного определения хлорид-, бромид- и йодид-ионов используют такой реагент как AgNO3, с которым данные ионы
- 10. При взаимодействии хлоридов (и самой соляной кислоты) с нитратом серебра образуется белый творожистый осадок хлорида серебра.
- 11. Для определения ионов фтора чаще всего используют растворимые соли кальция, в результате реакции образуется нерастворимое вещество
- 12. Ввиду большой реакционной способности галогенов в природе они встречаются исключительно в виде соединений.
- 17. Скачать презентацию










 Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа Конкурс проектных работ «Химический элемент … – и это все о нем»
Конкурс проектных работ «Химический элемент … – и это все о нем» Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу
Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу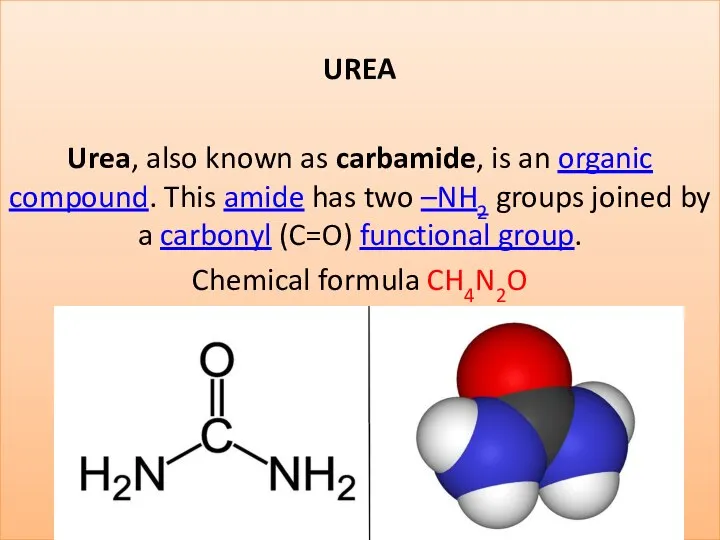 Urea (carbamide)
Urea (carbamide) Процессы минералообразования
Процессы минералообразования Предельные одноатомные спирты
Предельные одноатомные спирты  Занимательные опыты по химии
Занимательные опыты по химии Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама
Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2)
Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2) Дифференциация магмы
Дифференциация магмы Элементы кристаллохимии
Элементы кристаллохимии Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1
Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1 “B” (бор) как химический элемент
“B” (бор) как химический элемент Металлы в природе
Металлы в природе Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец Термохимия. Расчетные задачи. (Лекция 4.2)
Термохимия. Расчетные задачи. (Лекция 4.2)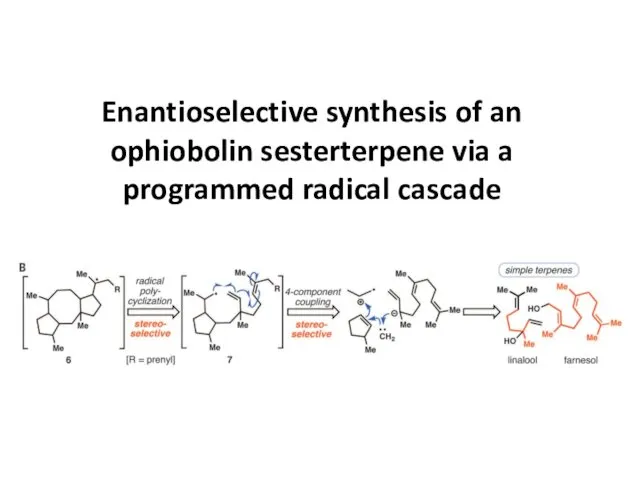 Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade
Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade Металлы и их соединения
Металлы и их соединения Введение в термические процессы вторичной переработки нефти
Введение в термические процессы вторичной переработки нефти Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль
Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль Жидкостная хроматография
Жидкостная хроматография Презентация по Химии "Тайна Е-621" - скачать смотреть
Презентация по Химии "Тайна Е-621" - скачать смотреть  Методические рекомендации по изучению курса «Коррозия и защита металлов»
Методические рекомендации по изучению курса «Коррозия и защита металлов» Применение этанола
Применение этанола Электропроводность растворов электролитов. Числа переноса
Электропроводность растворов электролитов. Числа переноса Етери. Ізомерія та номенклатура
Етери. Ізомерія та номенклатура Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы
Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы Презентация по Химии "Галогены" - скачать смотреть
Презентация по Химии "Галогены" - скачать смотреть