Содержание
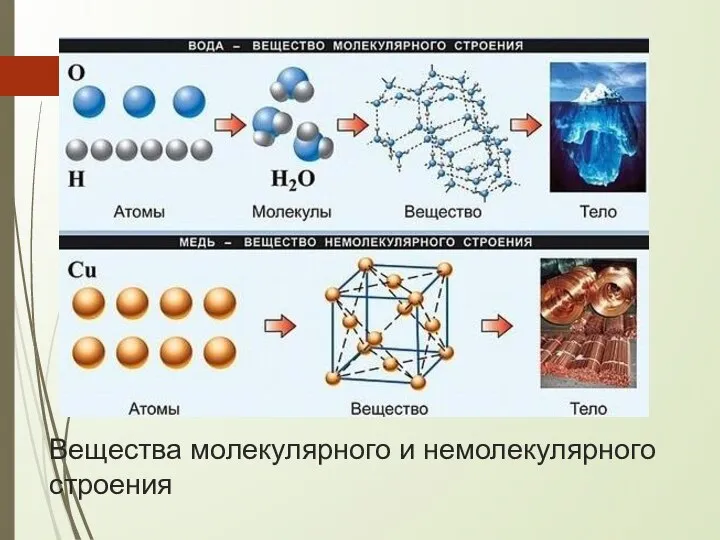
- 2. Вещества молекулярного и немолекулярного строения
- 3. Типы химической связи
- 4. Химическая связь 1) имеет электромагнитную природу 2) в результате образования связи происходит понижение энергии системы
- 5. 1. Ковалентная связь Наиболее прочный тип химической связи Есв до 800 кДж/моль
- 6. Ковалентная связь возникает: ̶ между атомами неМе ̶ за счет перекрывания атомных орбиталей с неспаренными электронами
- 7. Ковалентная связь при этом образуются: ̶ общая для двух атомов электронная пара, ̶ молекулярная орбиталь.
- 8. Электроотрицательность (ЭО) количественно описывает неметаллические свойства атома оценивает способность атома ХЭ притягивать к себе общую электронную
- 9. Электроотрицательность (ЭО) это способность атомов, принимающих участие в образовании ковалентной связи, притягивать к себе общую электронную
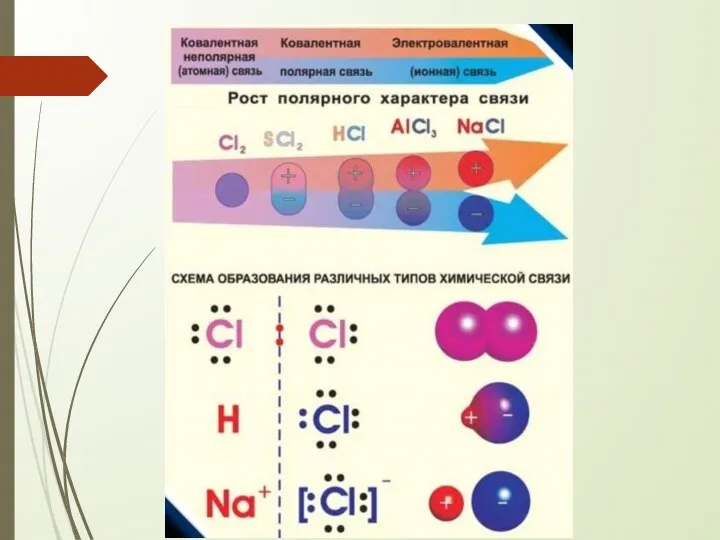
- 10. 1а. Ковалентная неполярная связь
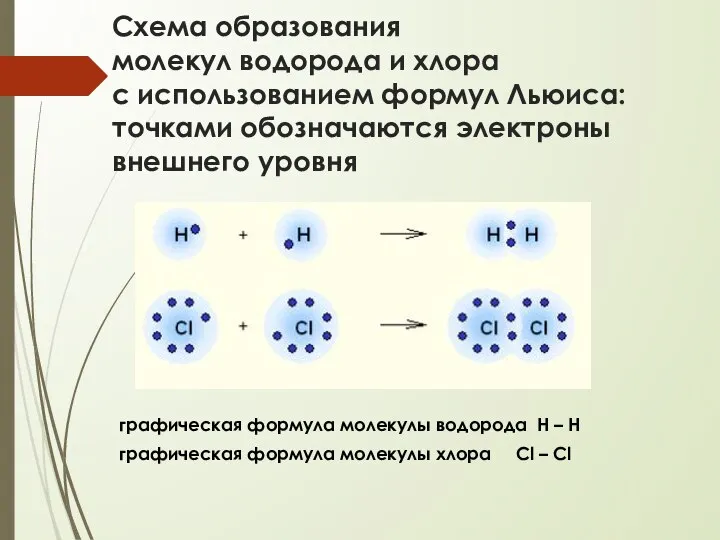
- 11. Схема образования молекул водорода и хлора с использованием формул Льюиса: точками обозначаются электроны внешнего уровня графическая
- 12. Ковалентная неполярная связь образуется между одинаковыми атомами неМе общая е-пара: расположена симметрично относительно центров атомов в
- 13. 1б. Ковалентная полярная связь
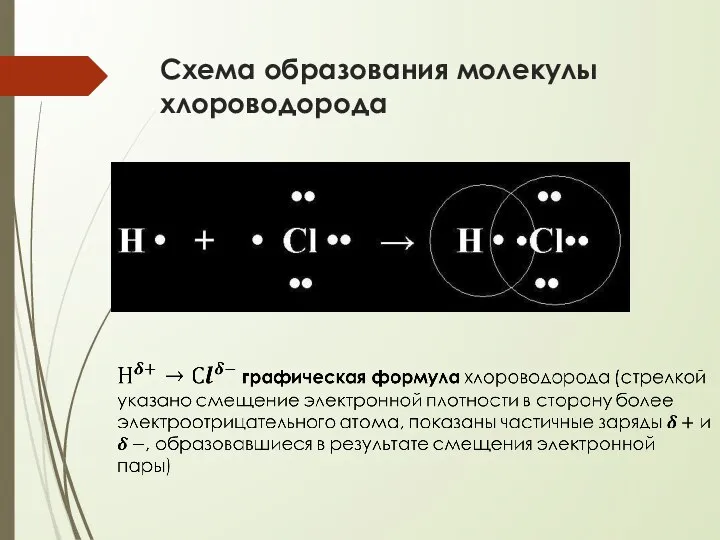
- 14. Схема образования молекулы хлороводорода
- 15. Ковалентная полярная связь образуется между атомами неМе с различной ЭО общая е-пара: сдвинута в сторону атома
- 16. 2. Ионная связь Есв около 600 кДж/моль
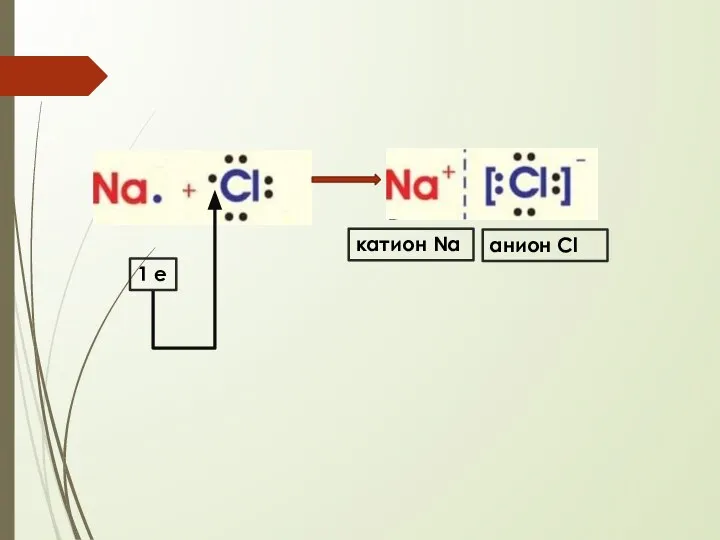
- 17. Ионная связь осуществляется за счет электростатического притяжения образовавшихся разноименных ионов (катионов и анионов)
- 18. Ионная связь предельный случай ковалентной полярной связи возникает между атомами типичного Ме и типичного неМе происходит
- 19. 1 е катион Na анион Cl
- 22. Скачать презентацию














 Основания
Основания Анаболические стероиды
Анаболические стероиды Ion exchange
Ion exchange Общая характеристика элементов IIIA-группы. Бор. Алюминий
Общая характеристика элементов IIIA-группы. Бор. Алюминий Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Презентация по Химии "Термодинамика и электрохимия" - скачать смотреть бесплатно
Презентация по Химии "Термодинамика и электрохимия" - скачать смотреть бесплатно Скорость химичесой реакции и химическое равновесие
Скорость химичесой реакции и химическое равновесие Физические и физико-химические свойства и характеристики грунтов. (Лекция 2)
Физические и физико-химические свойства и характеристики грунтов. (Лекция 2) Металлы, их свойства и область применения
Металлы, их свойства и область применения Сложные эфиры. Жиры
Сложные эфиры. Жиры A quantum computer
A quantum computer Способы выражения состава раствора. Решение задач
Способы выражения состава раствора. Решение задач Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия
Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия Органика вокруг нас
Органика вокруг нас «Контейнерная химия»: комплексоны, комплексообразование, применение
«Контейнерная химия»: комплексоны, комплексообразование, применение Тема: физико-химический анализ хлеба. Цель: Физико - химический анализ разных разных сортов хлеба. Задачи: 1.Определить физико-хими
Тема: физико-химический анализ хлеба. Цель: Физико - химический анализ разных разных сортов хлеба. Задачи: 1.Определить физико-хими Карбоновые кислоты
Карбоновые кислоты Синтетические органические соединения
Синтетические органические соединения Развитие теории восстановления металлов
Развитие теории восстановления металлов Спирты
Спирты Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Увлекательная химия
Увлекательная химия Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Общая химия
Общая химия Презентация по Химии "Кристалл – основа жизни на земле" - скачать смотреть
Презентация по Химии "Кристалл – основа жизни на земле" - скачать смотреть