Содержание
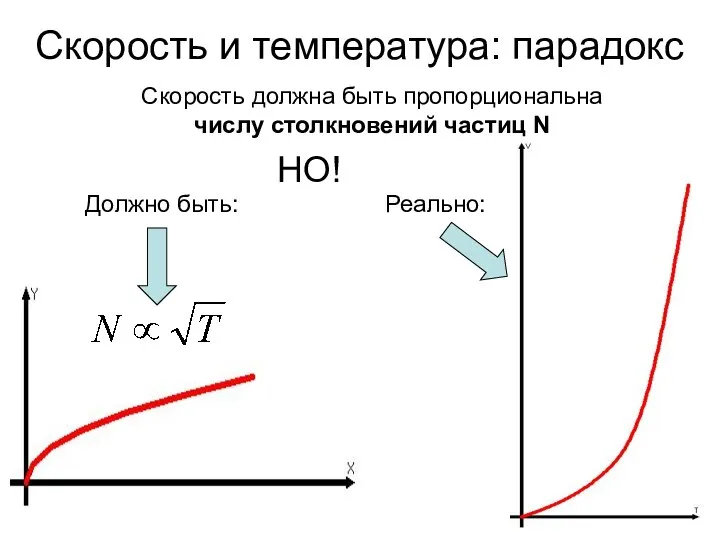
- 2. Скорость и температура: парадокс Скорость должна быть пропорциональна числу столкновений частиц N НО! Реально: Должно быть:
- 3. Правило Вант-Гоффа С повышением температуры на каждые 10оС скорость реакции возрастает в 2 – 4 раза
- 4. Применение правила Вант-Гоффа Во сколько раз увеличится скорость реакции при повышении температуры с 20оС до 100оC,
- 5. Ограничения правила Вант-Гоффа Является весьма грубым приближением, для точной оценки не годится; Абсолютно неприменимо для больших
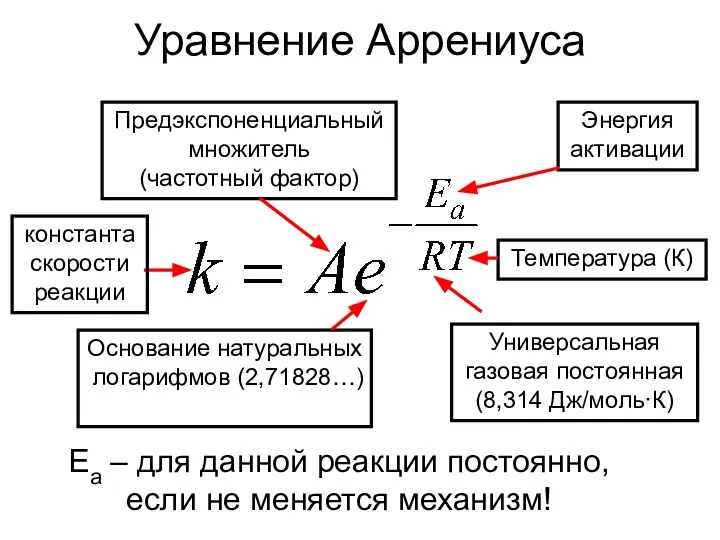
- 6. Уравнение Аррениуса константа скорости реакции Предэкспоненциальный множитель (частотный фактор) Энергия активации Температура (К) Универсальная газовая постоянная
- 7. О чем говорит уравнение Аррениуса Зависимость скорости реакции от температуры – экспоненциальная Чем больше энергия активации,
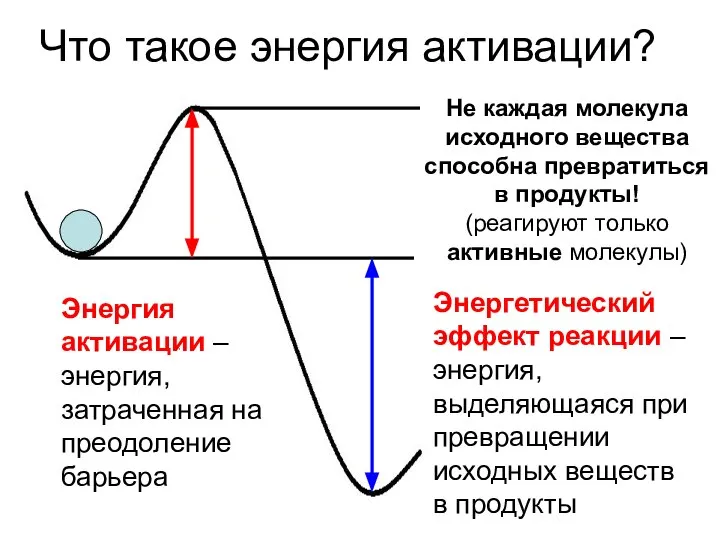
- 8. Что такое энергия активации? Энергия активации – энергия, затраченная на преодоление барьера Энергетический эффект реакции –
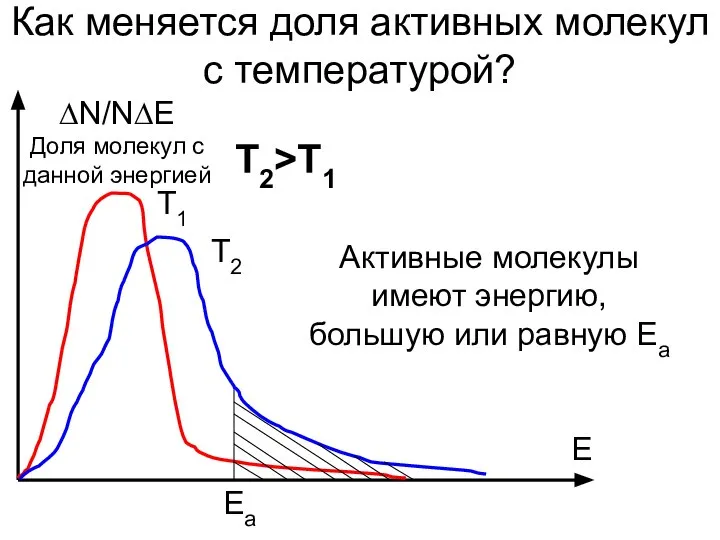
- 9. Как меняется доля активных молекул с температурой? ∆N/N∆E Доля молекул с данной энергией E Т1 Т2
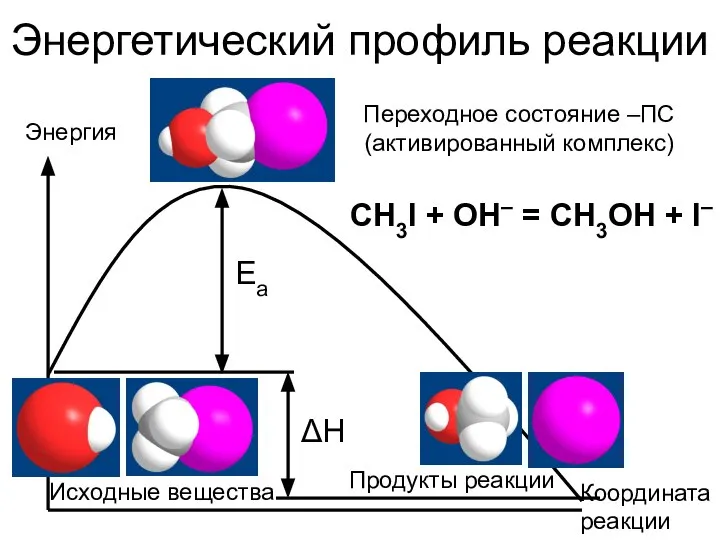
- 10. Энергетический профиль реакции Энергия Координата реакции CH3I + OH– = CH3OH + I– Ea Исходные вещества
- 11. На что это похоже? Перевал – переходное состояние Исходные вещества Энергия активации
- 12. Что из этого следует? Чем меньше энергия активации и чем устойчивее переходное состояние, тем легче протекает
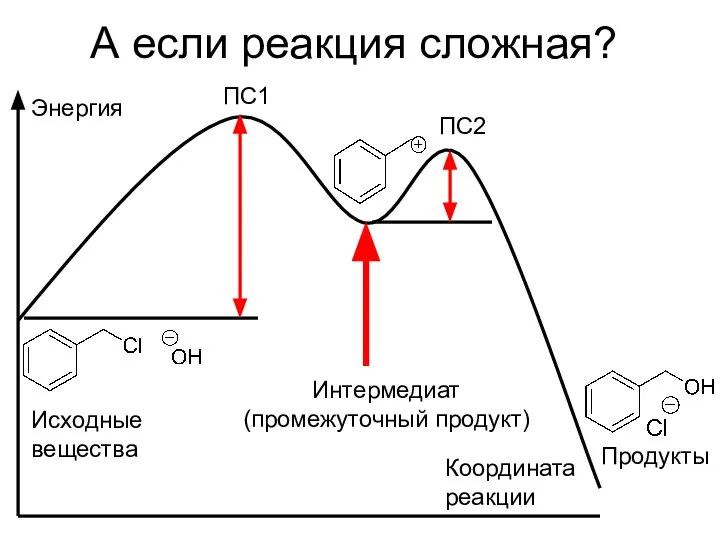
- 13. А если реакция сложная? Энергия ПС1 ПС2 Интермедиат (промежуточный продукт) Координата реакции Исходные вещества Продукты
- 14. Зачем все это нужно? Чем устойчивее ПС (меньше энергия активации), тем выше скорость данной стадии; Состояния,
- 16. Скачать презентацию







 Вода, ее физические и химические свойства, гигиеническое и экологическое значение (лекция №3)
Вода, ее физические и химические свойства, гигиеническое и экологическое значение (лекция №3) Природні джерела вуглеводнів Підготувала: Савчук Ірина
Природні джерела вуглеводнів Підготувала: Савчук Ірина  Минеральные компоненты молока и молочных продуктов. Макроэлементы
Минеральные компоненты молока и молочных продуктов. Макроэлементы Дифференциация магмы
Дифференциация магмы Phosphorus
Phosphorus Композиционные материалы
Композиционные материалы Водородные соединения неметаллов
Водородные соединения неметаллов Повторение 8 класса. Основные понятия химии
Повторение 8 класса. Основные понятия химии Химия вокруг нас
Химия вокруг нас Силикаты. Породообразующие минералы
Силикаты. Породообразующие минералы Сложные эфиры. Жиры. Мыло
Сложные эфиры. Жиры. Мыло Читаем формулы, определяем класс неорганических веществ. Называем вещества
Читаем формулы, определяем класс неорганических веществ. Называем вещества Буферные системы
Буферные системы Азот — газ, простое химическое вещество, неметалл
Азот — газ, простое химическое вещество, неметалл Полиуретановые полимеры
Полиуретановые полимеры ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 1.ОВР.Классификация ОВР. 2.Метод электронного баланса. 3.Метод полуреакций.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 1.ОВР.Классификация ОВР. 2.Метод электронного баланса. 3.Метод полуреакций.  Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз 2
Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз 2 Урок химии на дне океана. Задача 13
Урок химии на дне океана. Задача 13 Белки, или протеины
Белки, или протеины Теория валентных связей
Теория валентных связей Презентация по Химии "Сильнодіючі отруйні речовини: поняття та класифікація." - скачать смотреть бесплатно
Презентация по Химии "Сильнодіючі отруйні речовини: поняття та класифікація." - скачать смотреть бесплатно Види пластмаси
Види пластмаси  Модуль Химия на кухне. Жиры
Модуль Химия на кухне. Жиры Урок химии в 8 классе Козлова Валентина Васильевна НОУ СОШ №50 ОАО «РЖД» пгт Ерофей Павлович Сковородинский район
Урок химии в 8 классе Козлова Валентина Васильевна НОУ СОШ №50 ОАО «РЖД» пгт Ерофей Павлович Сковородинский район  Применение дизельных топлив
Применение дизельных топлив Лекция 4. Химическая термодинамика
Лекция 4. Химическая термодинамика Гигиенические нормативы. Химические факторы окружающей среды
Гигиенические нормативы. Химические факторы окружающей среды Презентация по Химии "Химические вещества в архитектуре города Минусинска" - скачать смотреть
Презентация по Химии "Химические вещества в архитектуре города Минусинска" - скачать смотреть