Содержание
- 2. 3. Металлы, стоящие в ряду напряжений левее водорода (имеющие более отрицательный электродный потенциал по отношению к
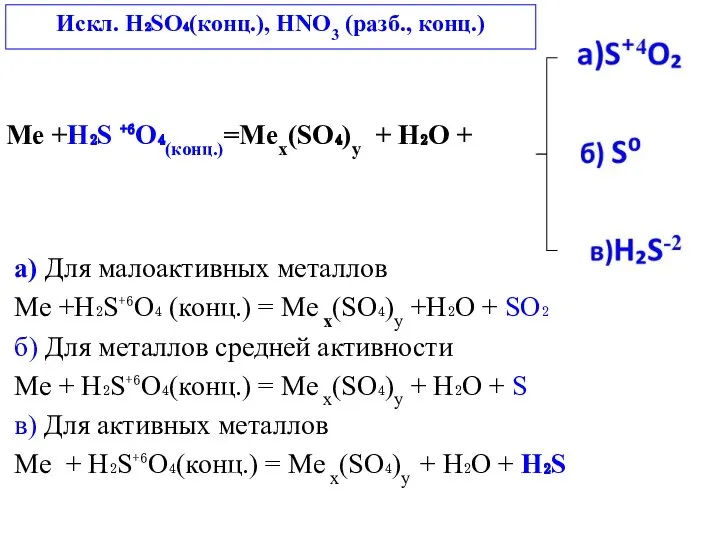
- 3. Me +H₂S ⁺⁶O₄(конц.)=Meх(SO₄)у + H₂O + a) Для малоактивных металлов Me +H₂S⁺⁶O₄ (конц.) = Me х(SO₄)у
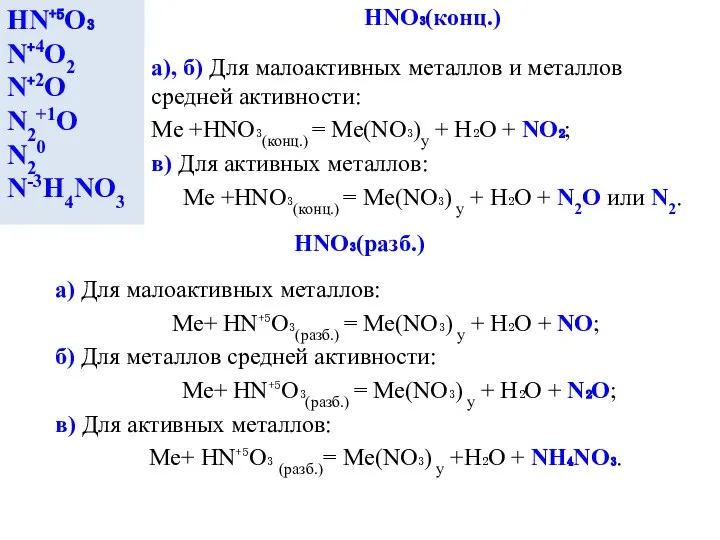
- 4. HNO₃(конц.) HN⁺⁵O₃ N⁺4O2 N⁺2O N2+1O N20 N-3H4NO3 a), б) Для малоактивных металлов и металлов средней активности:
- 5. Составьте схему и разберите работу гальванического элемента, который описывается схемой: А(-) Mg ⏐ MgSO4 ⏐ ⏐
- 7. Скачать презентацию
3. Металлы, стоящие в ряду напряжений левее водорода (имеющие более отрицательный
3. Металлы, стоящие в ряду напряжений левее водорода (имеющие более отрицательный
Mg + HCl (разб.) = MgCl₂ + H₂↑;
Zn + HCl (конц.) = ZnCl₂ + H₂↑;
Zn + H₂SO₄(разб.) = ZnSO₄ + H₂↑ .
2. Предыдущие металлы вытесняют последующие из растворов их солей (т.е. вытесняют металлы, которые имеют большую величину стандартного потенциала):
Zn + H2SO4 = Cu + ZnSO4
Zn0 – 2ē → Zn2+ |1 – окисление, восстановитель
Cu2+ + 2ē → Cu0 |1 – восстановление, окислитель
Me +H₂S ⁺⁶O₄(конц.)=Meх(SO₄)у + H₂O +
a) Для малоактивных металлов
Me +H₂S⁺⁶O₄ (конц.)
Me +H₂S ⁺⁶O₄(конц.)=Meх(SO₄)у + H₂O +
a) Для малоактивных металлов
Me +H₂S⁺⁶O₄ (конц.)
б) Для металлов средней активности
Me + H₂S⁺⁶O₄(конц.) = Me х(SO₄)у + H₂O + S
в) Для активных металлов
Me + H₂S⁺⁶O₄(конц.) = Me х(SO₄)у + H₂O + H₂S
Искл. H₂SO₄(конц.), НNO3 (разб., конц.)
HNO₃(конц.)
HN⁺⁵O₃
N⁺4O2
N⁺2O
N2+1O
N20
N-3H4NO3
a), б) Для малоактивных металлов и металлов средней активности:
Me +HNO₃(конц.) =
HNO₃(конц.)
HN⁺⁵O₃
N⁺4O2
N⁺2O
N2+1O
N20
N-3H4NO3
a), б) Для малоактивных металлов и металлов средней активности:
Me +HNO₃(конц.) =
в) Для активных металлов:
Me +HNO₃(конц.) = Me(NO₃) у + H₂O + N2O или N2.
HNO₃(разб.)
a) Для малоактивных металлов:
Me+ HN⁺⁵O₃(разб.) = Me(NO₃) у + H₂O + NO;
б) Для металлов средней активности:
Me+ HN⁺⁵O₃(разб.) = Me(NO₃) у + H₂O + N₂O;
в) Для активных металлов:
Me+ HN⁺⁵O₃ (разб.)= Me(NO₃) у +H₂O + NH₄NO₃.
Составьте схему и разберите работу гальванического элемента, который описывается схемой:
А(-)
Составьте схему и разберите работу гальванического элемента, который описывается схемой:
А(-)
С1=10-2 моль/л, C2= 1 моль/л.
Решение:
1.
2. Т.к.
А(–) Mg⏐ MgSO4 || ZnSO4 ⏐ Zn K(+ )
10-2 моль/л 1моль/л
Уравнения электродных процессов:
А(-): Mg0 − 2ē = Mg2+ − окисление (анодный процесс);
К(+): Zn2+ + 2ē = Zn0 − восстановление (катодный процесс).
Mg0 + Zn2+ = Mg2+ + Zn0.
ЭДС = ϕК − ϕА = −0,76 − (−2,43) = 1,67 (В),
ΔG = - 2 . 96500 . 1,67 = - 332,31 кДж,
ΔG < 0 – реакция протекает самопроизвольно.
ē
ПРИМЕР 2


 Волокна
Волокна  Задачи на смеси и сплавы (7 класс)
Задачи на смеси и сплавы (7 класс) Химическая термодинамика
Химическая термодинамика Презентация по Химии "Производство серной кислоты (польза и вред)" - скачать смотреть
Презентация по Химии "Производство серной кислоты (польза и вред)" - скачать смотреть  Комплексные соединения
Комплексные соединения Теория химического строения органических соединений А.М. Бутлерова (ТХС)
Теория химического строения органических соединений А.М. Бутлерова (ТХС) Медицинская биохимия как наука. Вводная лекция
Медицинская биохимия как наука. Вводная лекция Выращивание кристаллов неорганических веществ Проект Кийко Елизаветы ученицы 3 Б класса МОУ «Гимназия №17 г.
Выращивание кристаллов неорганических веществ Проект Кийко Елизаветы ученицы 3 Б класса МОУ «Гимназия №17 г. Химическая связь
Химическая связь Строение атома
Строение атома Химическая связь
Химическая связь Викторина «Своя игра» в рамках декады по биологии, географии и химии
Викторина «Своя игра» в рамках декады по биологии, географии и химии  Гидрокаталитические процессы
Гидрокаталитические процессы Метаболизм процесіндегі липидтер мен нуклеин қышқылдарының орны
Метаболизм процесіндегі липидтер мен нуклеин қышқылдарының орны Методы выделения и анализа биологически активных веществ
Методы выделения и анализа биологически активных веществ Теория радиационной деформации в «некубических» металлах: явление анизотропной диффузии
Теория радиационной деформации в «некубических» металлах: явление анизотропной диффузии Структура почвы. (Лекция 9)
Структура почвы. (Лекция 9) Химическая термодинамика
Химическая термодинамика Моделирование химического состава азот-аргон-алюминиевой плазмы
Моделирование химического состава азот-аргон-алюминиевой плазмы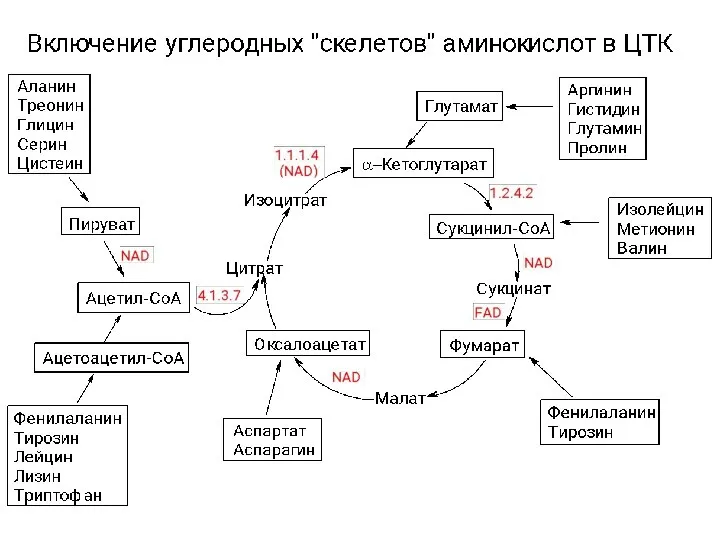 Катаболизм аминокислот
Катаболизм аминокислот Подготовил: Денис Специально для PowerPoint.Net.Ru
Подготовил: Денис Специально для PowerPoint.Net.Ru  Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Побочная подгруппа II группы. Цинк, ртуть и их соединения
Побочная подгруппа II группы. Цинк, ртуть и их соединения Выбор и назначение антибиотиков в соответствии со свойствами идентифицированного микроорганизма - возбудителя инфекции
Выбор и назначение антибиотиков в соответствии со свойствами идентифицированного микроорганизма - возбудителя инфекции Аттестацианная работа. Основы исследовательской деятельности по химии
Аттестацианная работа. Основы исследовательской деятельности по химии Синтез наноматериалов на границах раздела жидкость - жидкость и жидкость - воздух. Метод Ленгмюра - Блоджетт
Синтез наноматериалов на границах раздела жидкость - жидкость и жидкость - воздух. Метод Ленгмюра - Блоджетт Воздух. Постоянные компоненты воздуха
Воздух. Постоянные компоненты воздуха История мыловарения. Мыло своими руками
История мыловарения. Мыло своими руками