Содержание
- 2. ОБЩАЯ ХАРАКТЕРИСТИКА ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ Переходные элементы – это такие элементы у которых в нейтральных свободных атомах,
- 3. ОБЩАЯ ХАРАКТЕРИСТИКА ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ Общие свойства ПЭ: являются «типичными» металлами широкий выбор степеней окисления, кислотно-основных и
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ Общие свойства ПЭ: их ионы и соединения хотя бы в какой-нибудь степени
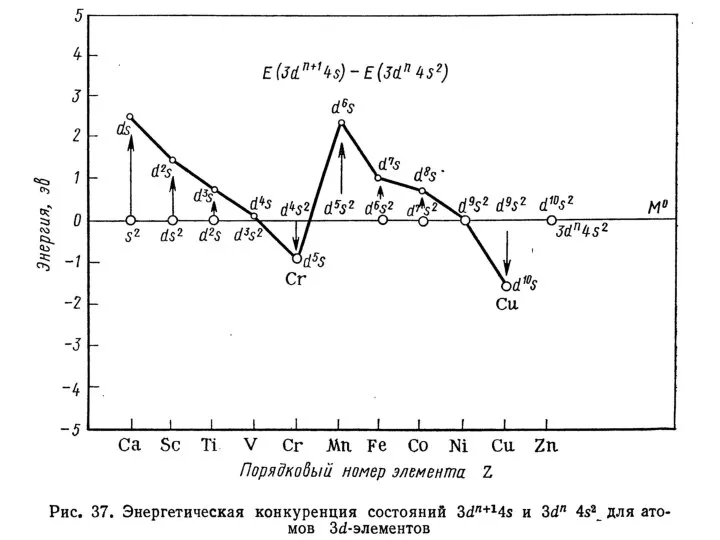
- 5. ЭЛЕКТРОННОЕ СТРОЕНИЕ Лантаноиды, актиноиды и отдельные ряды d-группы подразделяются на «ранние» и «поздние» 4-й период: Sc,
- 6. ЭЛЕКТРОННОЕ СТРОЕНИЕ Закономерности изменения свойств: относительно пониженная валентность атомов «поздних» элементов пониженная кратность связей атомов «поздних»
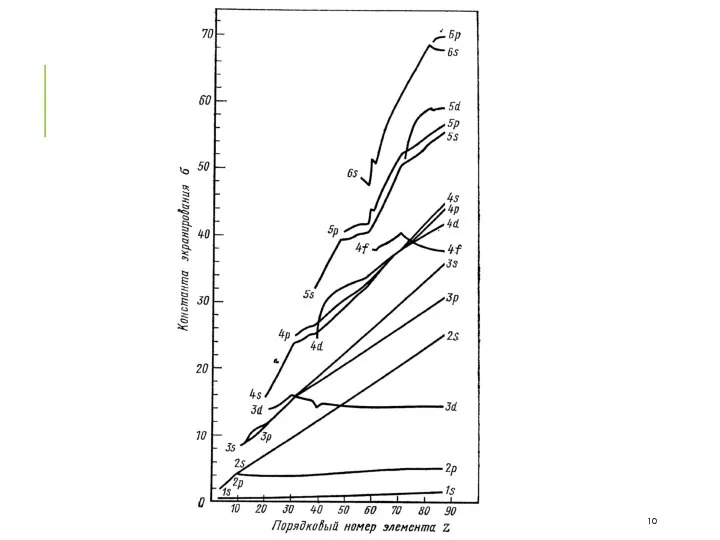
- 7. d-ЭЛЕМЕНТЫ ЭЛЕКТРОННОЕ СТРОЕНИЕ 1-й ряд переходных элементов 2-й ряд переходных элементов
- 8. d-ЭЛЕМЕНТЫ ОБЩИЕ СВОЙСТВА высокая прочность и твердость высокая тепло- и электропроводность многие растворяются в минеральных кислотах-неокислителях
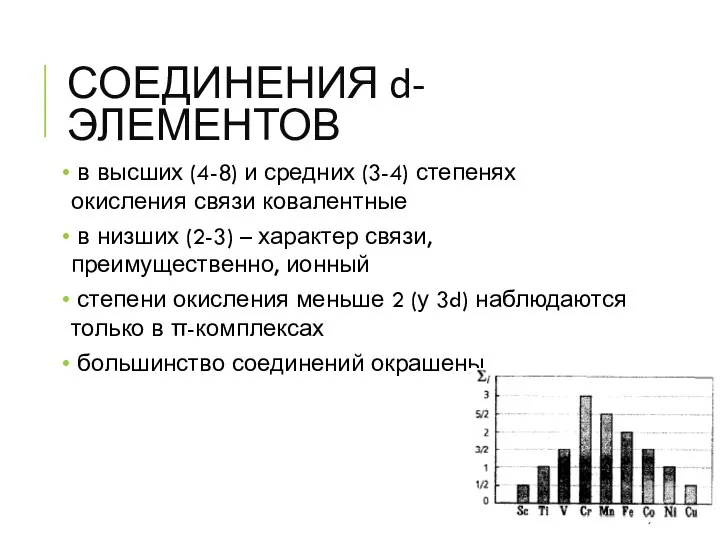
- 9. СОЕДИНЕНИЯ d-ЭЛЕМЕНТОВ в высших (4-8) и средних (3-4) степенях окисления связи ковалентные в низших (2-3) –
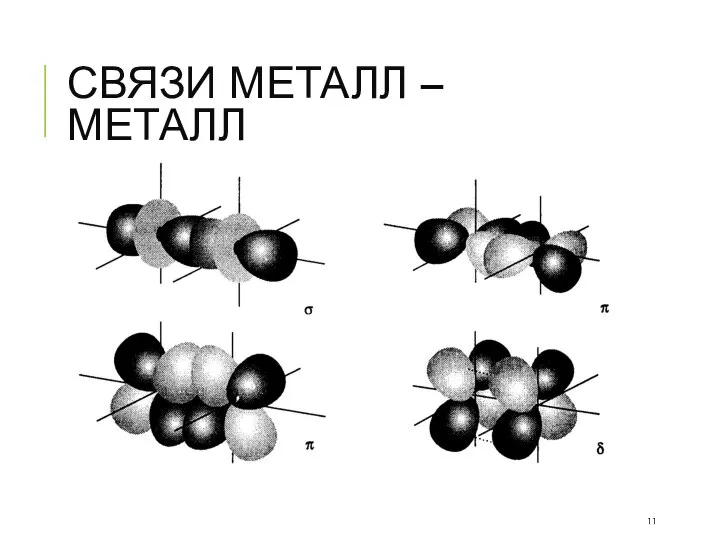
- 11. СВЯЗИ МЕТАЛЛ – МЕТАЛЛ
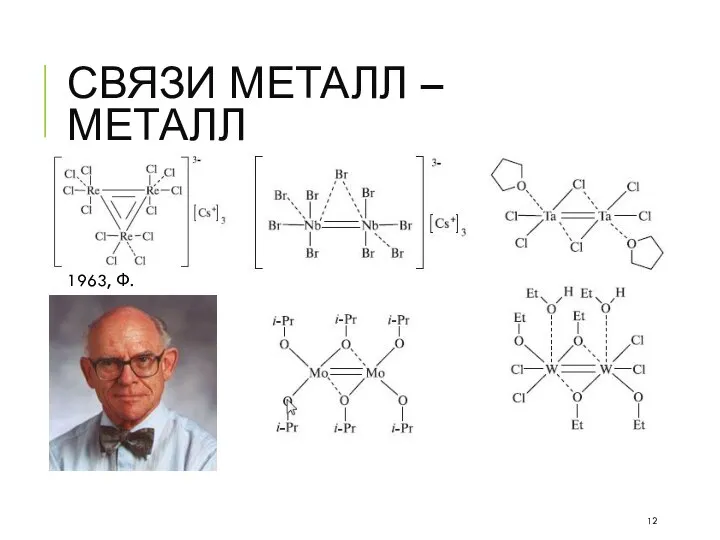
- 12. СВЯЗИ МЕТАЛЛ – МЕТАЛЛ 1963, Ф. Коттон
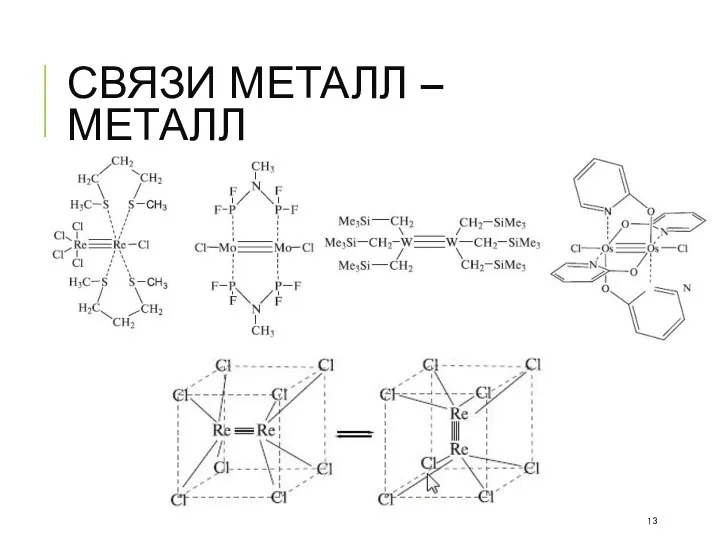
- 13. СВЯЗИ МЕТАЛЛ – МЕТАЛЛ
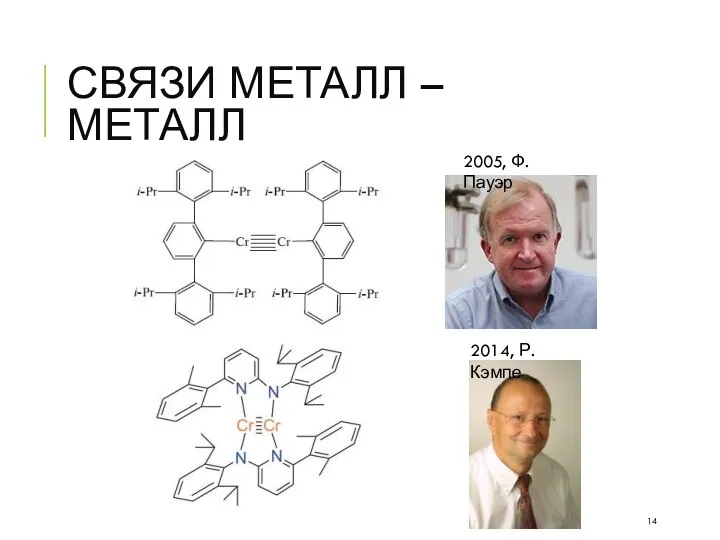
- 14. СВЯЗИ МЕТАЛЛ – МЕТАЛЛ 2005, Ф. Пауэр 2014, Р. Кэмпе
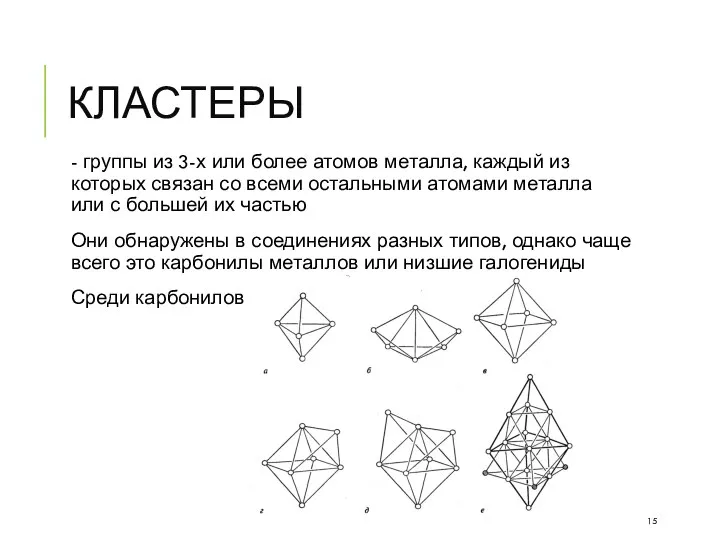
- 15. КЛАСТЕРЫ - группы из 3-х или более атомов металла, каждый из которых связан со всеми остальными
- 17. Скачать презентацию






 Отчет по ПП.03.01 «Лаборант химического анализа»
Отчет по ПП.03.01 «Лаборант химического анализа» Оцет Яковлев Олексій 11-В
Оцет Яковлев Олексій 11-В  Металлы. Из истории металлов
Металлы. Из истории металлов Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Титан және оның қорытпалары
Титан және оның қорытпалары Алканы
Алканы Фильтрование. Лекция 5
Фильтрование. Лекция 5 Комплексні сполуки
Комплексні сполуки Весь смысл жизни заключается в бесконечном завоевании неизвестного, в вечном усилии познать больше Эмиль Золя
Весь смысл жизни заключается в бесконечном завоевании неизвестного, в вечном усилии познать больше Эмиль Золя  Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) А.М. Бутлеровтың химиялык кұрылыс теориясы
А.М. Бутлеровтың химиялык кұрылыс теориясы Химия - моя жизнь
Химия - моя жизнь Изучение свойств природных индикаторов, содержащихся в растениях
Изучение свойств природных индикаторов, содержащихся в растениях Взаимодействие перфторбензоциклобутена и его перфторалкил- и пентафторфенилпроизводных с CO в среде SbF5
Взаимодействие перфторбензоциклобутена и его перфторалкил- и пентафторфенилпроизводных с CO в среде SbF5 Презентация для класса Вода
Презентация для класса Вода Дисперсные
Дисперсные Кислоты. Классификация кислот
Кислоты. Классификация кислот Білки
Білки  Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Кислоты
Кислоты Хлор. Химический элемент
Хлор. Химический элемент Азот. Строение атома и молекулы
Азот. Строение атома и молекулы Месторождения хрома
Месторождения хрома Методы упрочнения металлических сплавов. Тема 2.3
Методы упрочнения металлических сплавов. Тема 2.3 Минеральные удобрения: польза и вред
Минеральные удобрения: польза и вред Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Эфиры. Жиры
Эфиры. Жиры Чистые вещества и смеси веществ
Чистые вещества и смеси веществ