Содержание
- 2. Постановка гипотезы: Если железо реагирует со слабым окислителем, то будет проявлять ст.ок +2, если с сильным
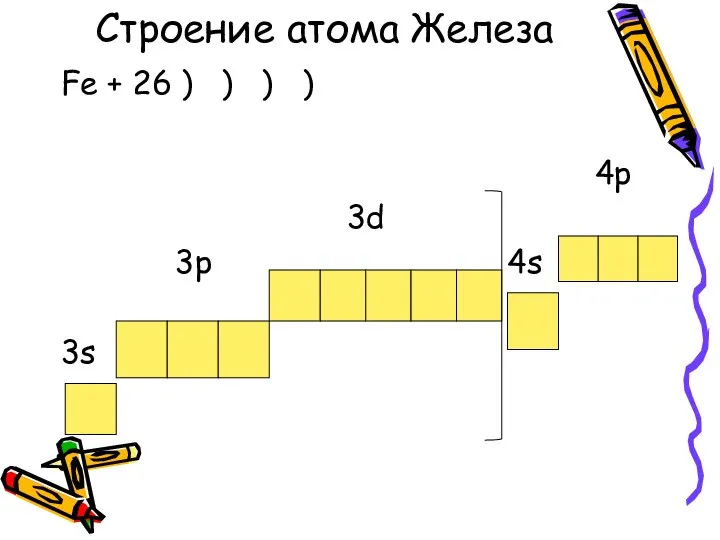
- 3. Строение атома Железа Fe + 26 ) ) ) ) 4p 3d 3p 4s 3s
- 4. 1 группа Творческое задание. Небольшое количество железной стружки поместили на чашу весов Р, а на чашу
- 5. 2 группа Fe + S = FeS (сульфид железа (II)) Fe + Cl2 = FeCl3 (сульфид
- 6. 3 группа Опустите железный гвоздик в пробирку с водой. Пользуясь литературой, объясните наблюдение. Пользуясь литературой, напишите
- 7. 4 группа 1) Опустите железную скрепку в пробирку 2) Добавить 2мл соляной кислоты 3) Пробирку нагревают
- 8. Взаимодействие железа с кислотами С раствором серной кислоты Fe реагирует обычно, окисляясь до +2. А в
- 9. Fe + H2SO4 = Fe2(SO4)3 + SO2 + H2O
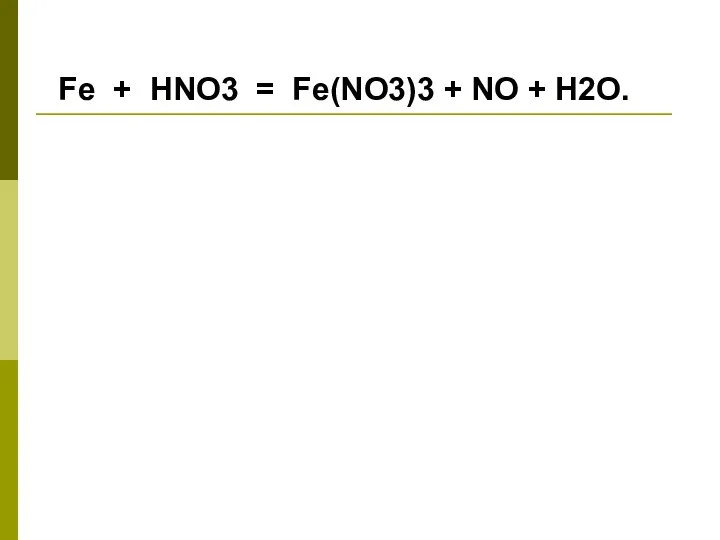
- 10. Fe + HNO3 = Fe(NO3)3 + NO + H2O.
- 11. 5 группа 1) В две пробирки налейте по 4мл сульфата меди (II) 2) Первую пробирку поставьте
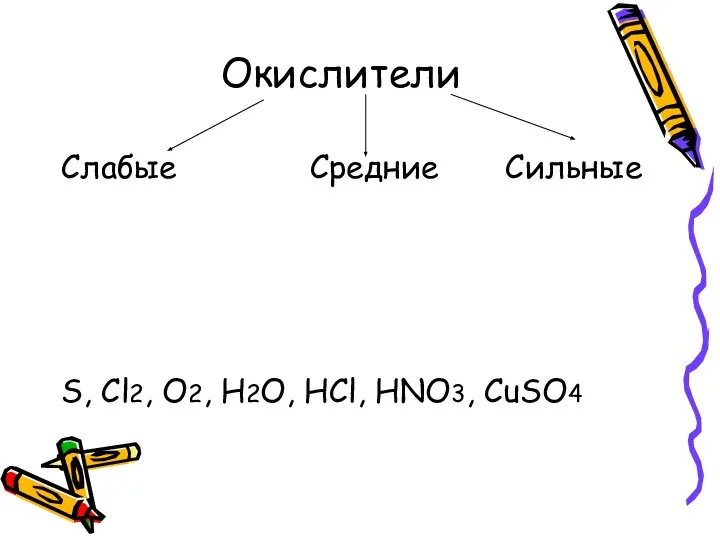
- 12. Окислители Слабые Средние Сильные S, Cl2, O2, H2O, HCl, HNO3, CuSO4
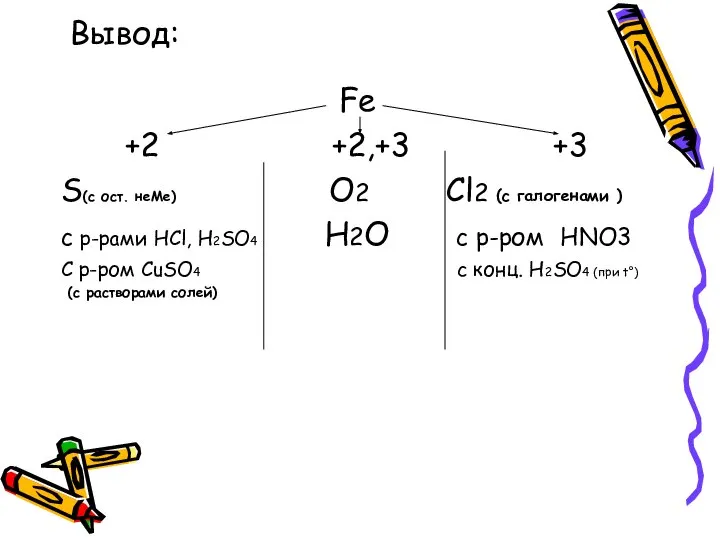
- 13. Вывод: Fe +2 +2,+3 +3 S(с ост. неМе) O2 Cl2 (c галогенами ) c р-рами HCl,
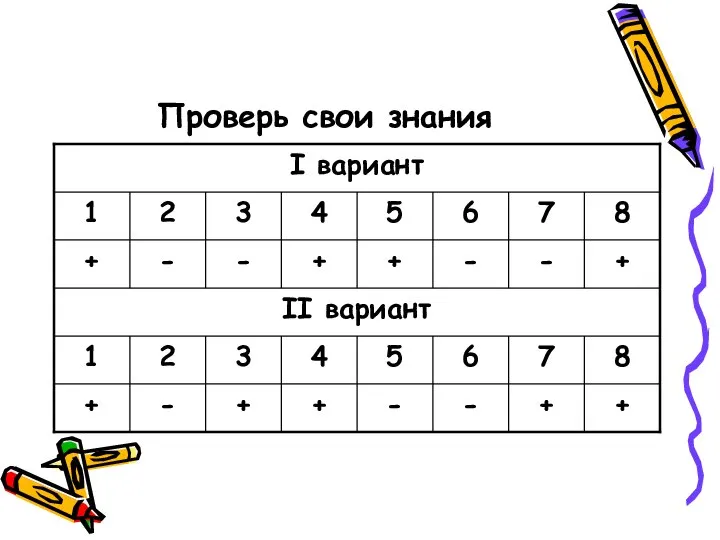
- 14. Проверь свои знания
- 16. Скачать презентацию








 Металлы; их классификация, строения и свойства
Металлы; их классификация, строения и свойства Молекулы и атомы. Простые и сложные вещества
Молекулы и атомы. Простые и сложные вещества Ароматические углеводороды. (Лекция 7)
Ароматические углеводороды. (Лекция 7) Открытие водорода
Открытие водорода Теория создание стекла, оптические кристаллы
Теория создание стекла, оптические кристаллы Энтропия и уравнение состояния идеального газа
Энтропия и уравнение состояния идеального газа Презентация по Химии "Хімія і екологія" - скачать смотреть бесплатно
Презентация по Химии "Хімія і екологія" - скачать смотреть бесплатно Химическое равновесие
Химическое равновесие Химия элементов VIIIA группы
Химия элементов VIIIA группы Спирти та етери. Медико-біологічне значення
Спирти та етери. Медико-біологічне значення Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Colligative properties of solutions
Colligative properties of solutions Химические средства гигиены и косметики
Химические средства гигиены и косметики Метан биогенный, абиогенный
Метан биогенный, абиогенный Стероиды, их химическое и пространственное строение
Стероиды, их химическое и пространственное строение Теория возникновения электродного потенциала Нернста
Теория возникновения электродного потенциала Нернста Коллекция учебных динамических слайдов по химии (8 класс)
Коллекция учебных динамических слайдов по химии (8 класс) Решение расчетных задач по химии
Решение расчетных задач по химии Растворы. Часть 1
Растворы. Часть 1 Задача №2 «Спящий Амур». Команда гимназии №1 «Берлинская лазурь»
Задача №2 «Спящий Амур». Команда гимназии №1 «Берлинская лазурь» Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Кальций
Кальций Коррозия металлов
Коррозия металлов Расчет температуры вспышки. Классификация горючести жидкости
Расчет температуры вспышки. Классификация горючести жидкости Нанохимия Выполнили Кириллова Анастасия и Ильц Алина
Нанохимия Выполнили Кириллова Анастасия и Ильц Алина  Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение Мұнай, құрамыөңдеу әдістері
Мұнай, құрамыөңдеу әдістері Аттестационная работа. Влияние внеклассного мероприятия Неделя химии в школе на познавательную активность учащихся
Аттестационная работа. Влияние внеклассного мероприятия Неделя химии в школе на познавательную активность учащихся