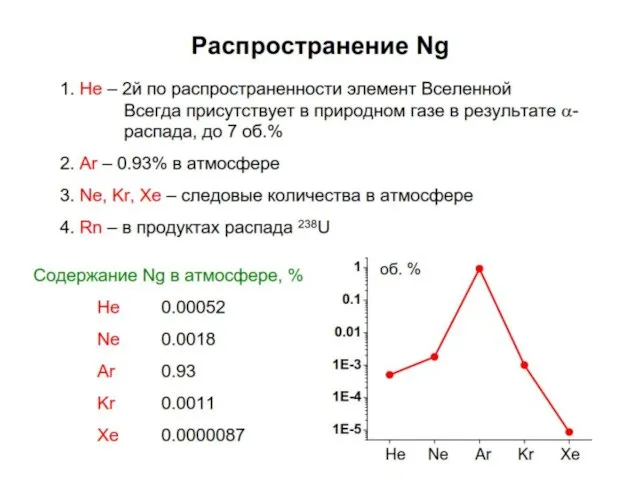
Содержание
- 5. ИНЕРТНЫЕ ГАЗЫ
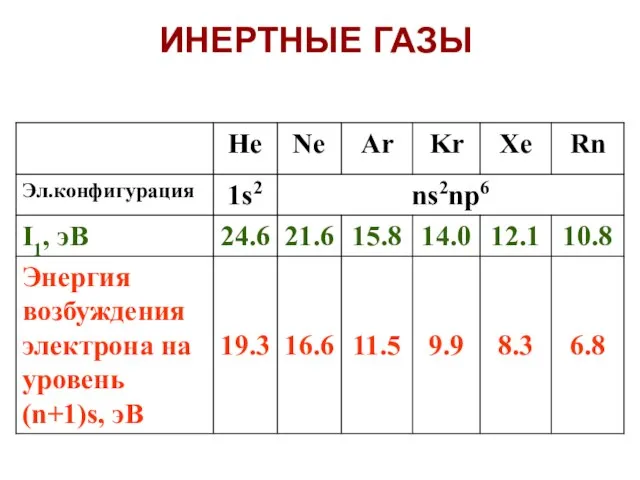
- 6. Значения I1 слишком велики, чтобы затраты энергии на образование катиона Э+ были компенсированы энергией, выделяющейся при
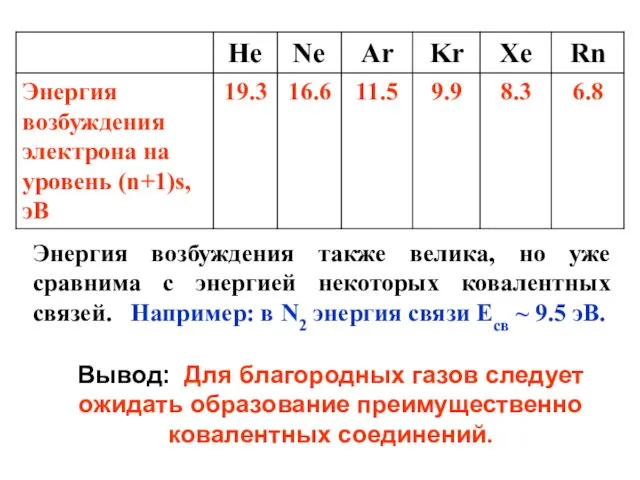
- 7. Энергия возбуждения также велика, но уже сравнима с энергией некоторых ковалентных связей. Например: в N2 энергия
- 8. В природе инертные газы образуются в результате различных ядерных реакций. Часть инертных газов имеет космогенное происхождение.
- 9. Способность инертных газов к образованию химических соединений открыта сравнительно недавно. В настоящее время лучше изучена химия
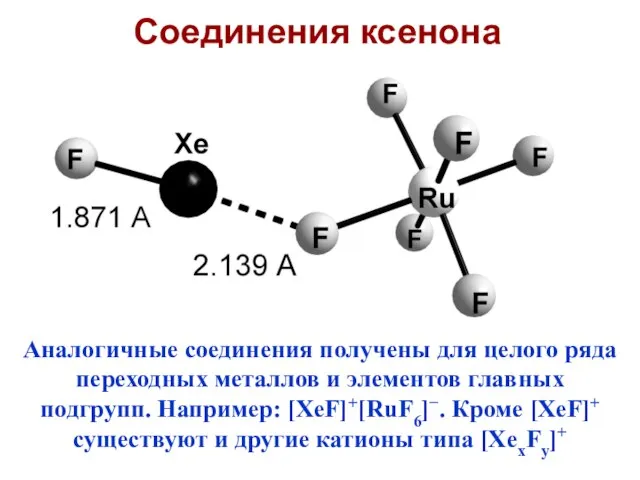
- 10. Соединения ксенона Ксенон – первый разрушил миф о химической инертности благородных газов. Первые соединения получены Нилом
- 11. Изучая реакцию O2 + PtF6 Бартлетт установил, что в ней образуется соль катиона диоксигенила O2+: O2
- 12. Далее он обратил внимание на то, что потенциал ионизации дикислорода и ксенона очень близки по значению:
- 13. Позднее были уточнены строение и состав этой соли. На самом деле (в соответствии с нашим начальным
- 14. Аналогичные соединения получены для целого ряда переходных металлов и элементов главных подгрупп. Например: [XeF]+[RuF6]−. Кроме [XeF]+
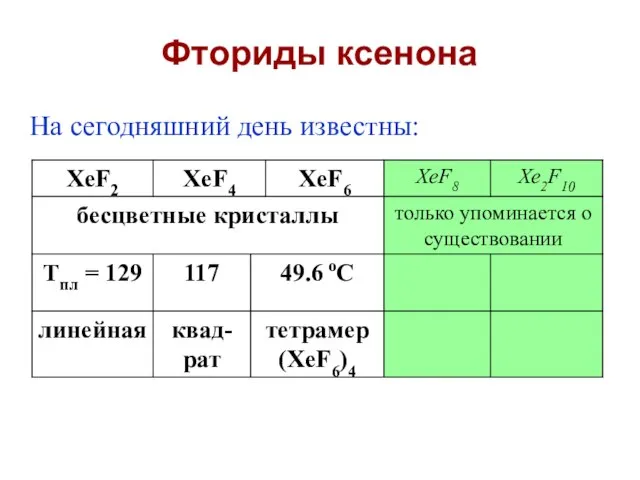
- 15. Фториды ксенона На сегодняшний день известны:
- 16. Xe + F2 = XeF2 (смесь Xe/F2 – 1:2, hν, 25 оС) Xe + 2F2 =
- 17. Химические свойства фторидов ксенона Окислительные свойства: сильные окислители XeF2(aq) + 2H+ + 2e = Xe +
- 18. Соединения других благородных газов
- 19. Соединения криптона Соединения криптона менее устойчивы, чем ксенона. Например: XeF2 – термод. стабилен ( ). KrF2
- 20. KrF2 медленно разлагается при комнатной температуре. Это требует особого, нетрадиционного, подхода к синтезу! Для получение KrF2
- 21. Применение инертных газов
- 22. 1) создание инертной атмосферы при проведении химических реакций и технических процессов, требующих отсутствия кислорода (литье из
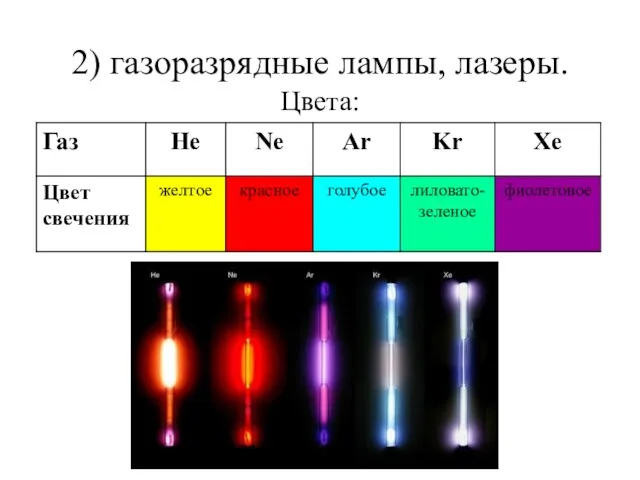
- 23. 2) газоразрядные лампы, лазеры. Цвета:
- 24. 3) гелий-кислородные дыхательные смеси для подводников (гелий в отличие от азота практически не растворяется в плазме
- 25. Структура ПС Лантаниды (лантаноиды) – 4f-элементы (ид – от греч. следующий за; оид – от греч.
- 26. Последовательность заполнения орбиталей Правило Клечковского: орбитальная энергия последовательно повышается по мере увеличения суммы главного квантового числа
- 27. Название Электроны в атоме Каждый электрон в атоме характеризуется четырьмя квантовыми числами Принцип Паули: в одном
- 28. Орбитальное число ℓ Электроны в атоме Главное квантовое число n: 1. Характеризует энергию взаимодействия электрона с
- 29. 1 определение переходных элементов Переходные элементы – элементы, расположенные в побочных подгруппах больших периодов периодической системы;
- 30. 2 определение переходных элементов 2) Переходные элементы – элементы, в атомах или ионах которых d- или
- 31. В то время как непереходные элементы в каждом периоде изменяются от металлов к неметаллам, все переходные
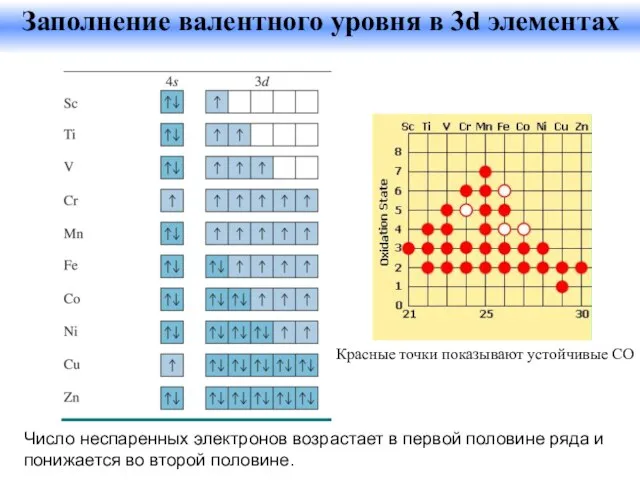
- 32. Число неспаренных электронов возрастает в первой половине ряда и понижается во второй половине. Заполнение валентного уровня
- 33. Разнообразие степеней окисления Количество возможных СО возрастает от Sc к Mn. Для Mn реализуются все возможные
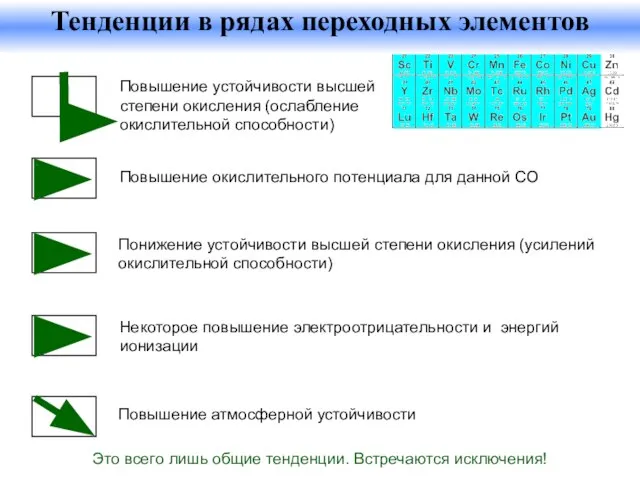
- 34. Повышение устойчивости высшей степени окисления (ослабление окислительной способности) Повышение окислительного потенциала для данной СО Понижение устойчивости
- 35. Координационные соединения переходных металлов
- 36. Соединения, состоящие из других, более простых соединений называются комплексными. Центральный атом – окружен молекулами или ионами
- 37. [Co(NH3)6]3+ – комплекс (катионный комплекс); [Co(NH3)6]Cl3 – комплексное соединение (соль). [Fe(CO)5] – комплекс и комплексное соединение.
- 38. Строение комплексного соединения K3 [Fe(CN)6] Ион-комплексообразователь (центральный атом) Лиганды от лат. ligare – связывать, соединять Координационное
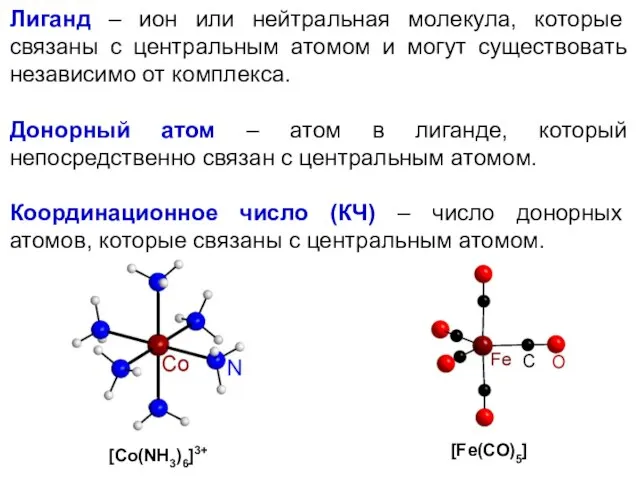
- 39. Строение комплексного соединения Комплексное соединение состоит из: 1) внутренней сферы [комплекс] 2) внешней сферы (противоион) [Ni(NH3)6]Cl2
- 40. Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом и могут существовать независимо от
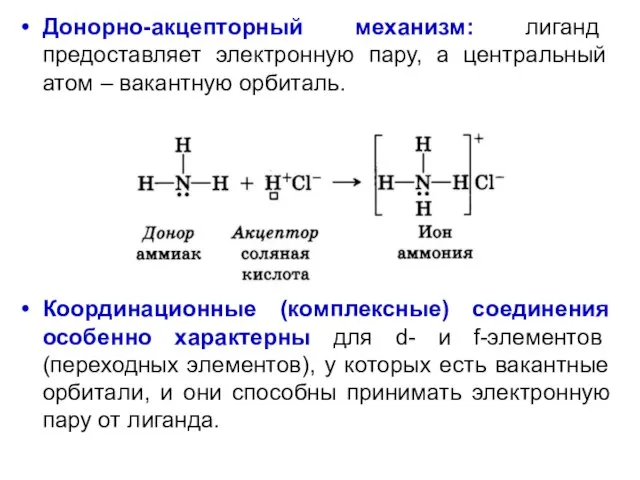
- 41. Донорно-акцепторный механизм: лиганд предоставляет электронную пару, а центральный атом – вакантную орбиталь. Координационные (комплексные) соединения особенно
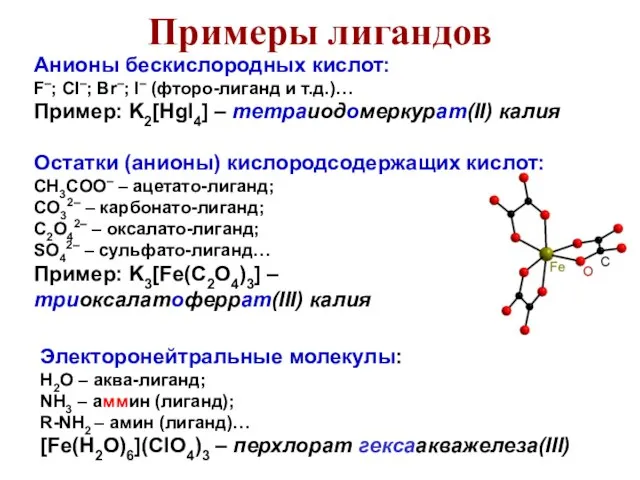
- 42. Анионы бескислородных кислот: F–; Cl–; Br–; I– (фторо-лиганд и т.д.)… Пример: K2[HgI4] – тетраиодомеркурат(II) калия Остатки
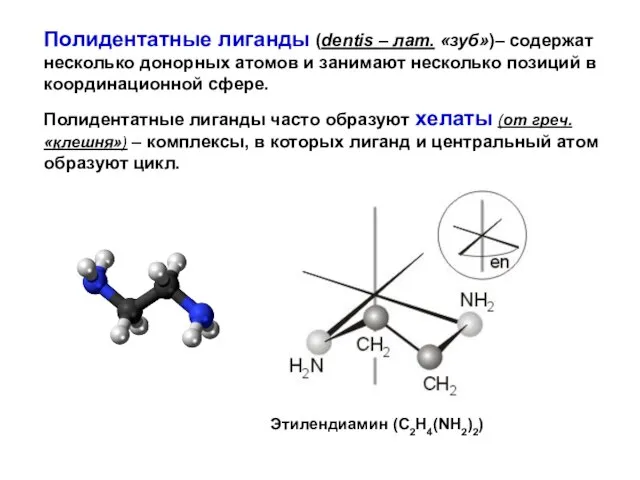
- 43. Полидентатные лиганды (dentis – лат. «зуб»)– содержат несколько донорных атомов и занимают несколько позиций в координационной
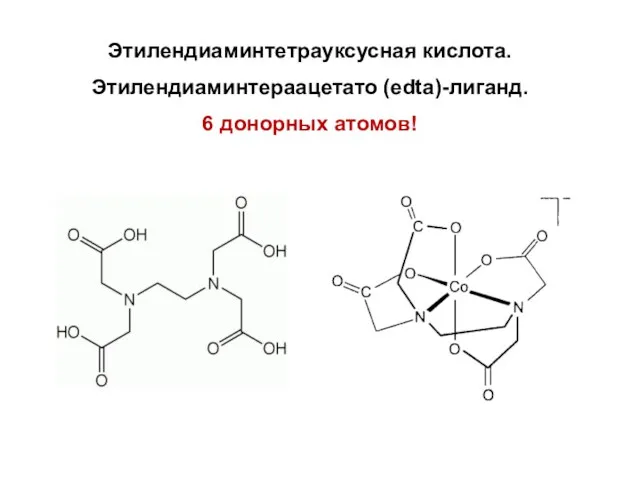
- 44. Этилендиаминтетрауксусная кислота. Этилендиаминтераацетато (edta)-лиганд. 6 донорных атомов!
- 45. ИЗОМЕРИЯ (от др.-греч. ἴσος – «равный», μέρος – «доля, часть») Явление, заключающееся в существовании химических соединений
- 46. Цис- и транс- изомеры, для квадратных частиц. [Pt(Gly)2] – диглицинатоплатина (II) Транс- менее растворим в воде,
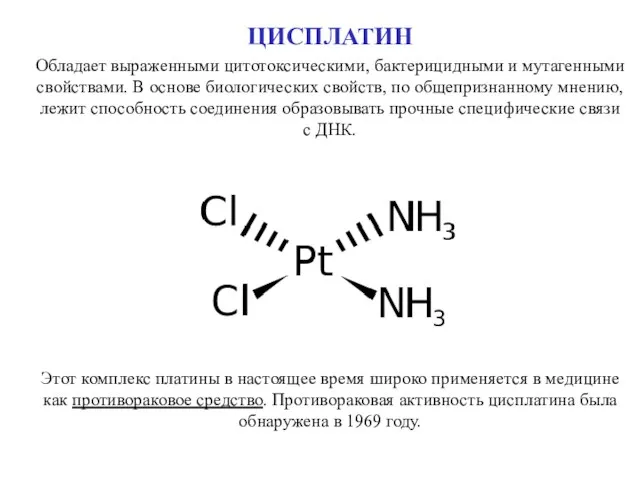
- 47. ЦИСПЛАТИН Обладает выраженными цитотоксическими, бактерицидными и мутагенными свойствами. В основе биологических свойств, по общепризнанному мнению, лежит
- 48. ос- (mer-) реберный гран- (fac-) граневой Для октаэдрических частиц [Pt(NH3)2Cl4] [Co(NH3)3Cl3] транс- (trans-) цис- (cis-) Геометрическая
- 49. Лиганды во внутренней и внешней координационной сфере меняются местами. [Co(NH3)5Cl]CN – пентаамминхлорокобальт (II) цианид [Co(NH3)5СN]Cl –
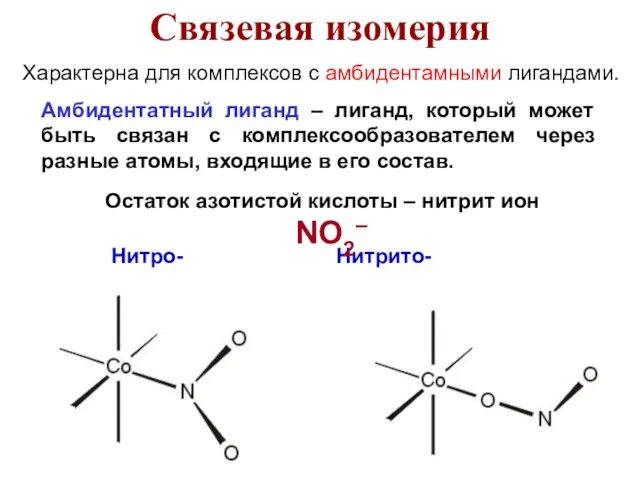
- 50. Характерна для комплексов с амбидентамными лигандами. Амбидентатный лиганд – лиганд, который может быть связан с комплексообразователем
- 51. для комплексных солей, в которых и катион и анион являются комплексными (CuPt(NH3)4Cl4) [Cu(NH3)4][PtCl4] – фиолетовый цвет
- 52. Cd2+ + CN– = [Cd(CN)]+ K1 = [Cd(CN)+]/[Cd2+][CN–]; [Cd(CN)]+ + CN– = [Cd(CN)2] K2 = [Cd(CN)2]/[
- 53. Константа образования характеризует устойчивость комплексов (в водных растворах). Константа образования характеризует прочность связывания лиганда с металлом
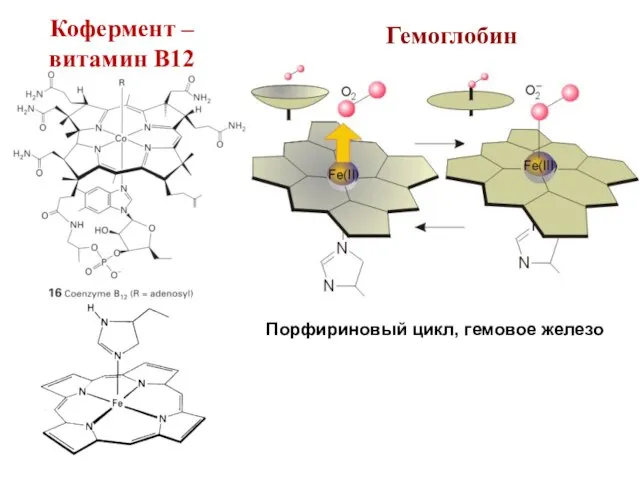
- 54. Гемоглобин Порфириновый цикл, гемовое железо Кофермент – витамин В12
- 55. Побочная подгруппа III группы ПС
- 56. Редкоземельные элементы (РЗЭ) Редкоземельные элементы (РЗЭ) – d-элементы Sc, Y, La (скандний, иттрий, лантан) и 14
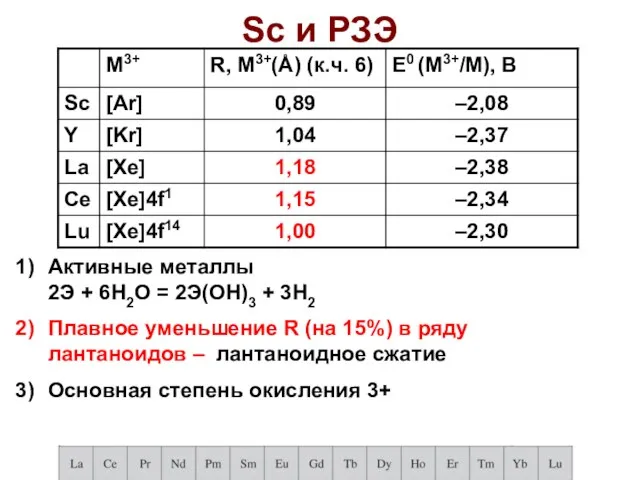
- 57. Sc и РЗЭ Активные металлы 2Э + 6H2О = 2Э(ОН)3 + 3H2 Плавное уменьшение R (на
- 58. Лантаноидное сжатие У лантаноидов (как и у актиноидов) увеличение атомного номера приводит не к повышению, а
- 59. Содержание в земной коре и минералы Sc – 36 место. Тортвейтит ((Sc,Y)2Si2O7) и стерреттит (Sc[PO4]·2H2O). Y
- 60. Открытие элементов Sc – элемент был предсказан Менделевым (как эка-бор) и открыт в 1879 году шведским
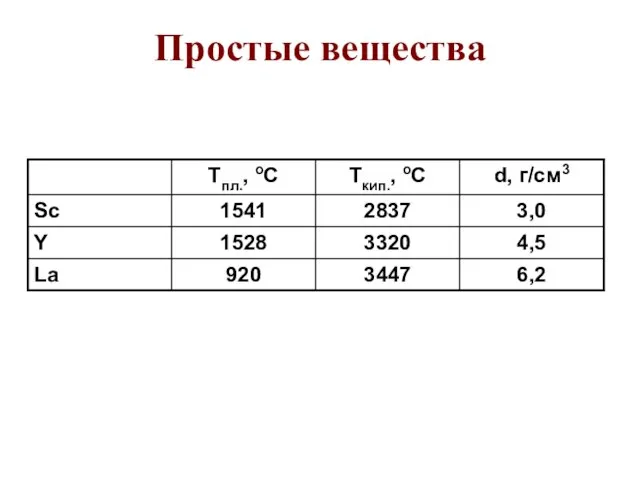
- 61. Простые вещества
- 62. Изменение свойств Sc(OH)3 ? La(OH)3 увеличение основных свойств. Примеры: 2Sc(OH)3 + 3H2SO4 = Sc2(SO4)3 + 3H2O;
- 63. Получение и свойства 1) 2MCl3 + 3Ca = 3CaCl2 + 2М – кальциетермия 2) М2O3 +
- 64. Химические свойства Ярко выражены основные свойства. Исключение – скандий (в горячей, конц. щелочи): 2Sc + 6NaOH
- 65. Основные соединения Оксиды M2O3 – тугоплавкие, плохо растворимы в воде, растворимы в кислотах Но: La2O3 +
- 66. Комплексы лантаноидов Аквакомплексы [M(H2O)9]3+ лабильны (замещение лигандов за 10–7 – 10–9 с) Предпочитают координацию по кислороду
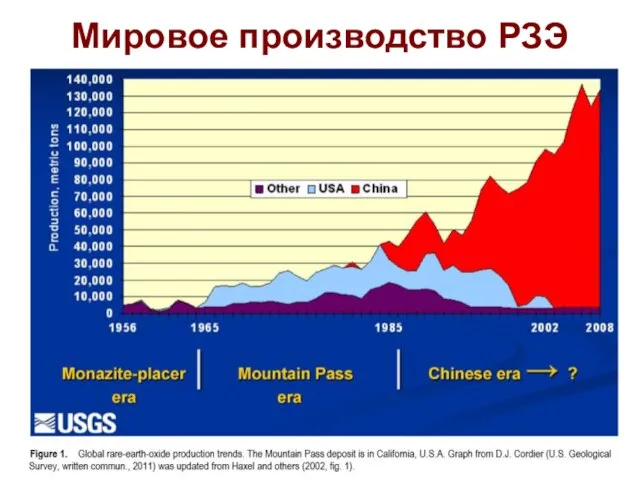
- 67. Применение РЗЭ LaNi5 – хранение водорода в аккумуляторах; Y – в ядерных реакторах; LnBa2Cu3O7-x – сверпроводниках;
- 68. Мировое производство РЗЭ
- 69. Побочная подгруппа IV группы ПС
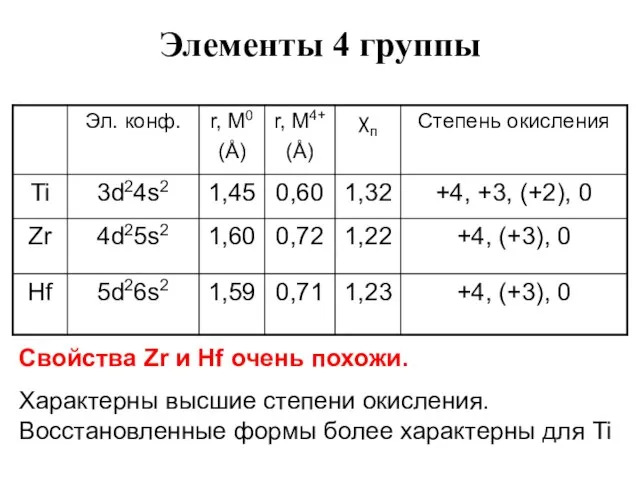
- 70. Элементы 4 группы Свойства Zr и Hf очень похожи. Характерны высшие степени окисления. Восстановленные формы более
- 71. Содержание в земной коре и минералы Ti – 9 место, рутил (TiO2), ильменит (FeTiO3), перовскит (CaTiO3)
- 72. Открытие элементов Ti – в 1791 г. англ. Грегор, в 1795 г. нем. Клапрот. Титаны –
- 73. Простые вещества Получение сложное, MO2 + 2C + 2Cl2 = MCl4 + 2CO MCl4 + 2Mg
- 74. Свойства простых веществ M+ H2 = MH2 (при выс. Т) - устойчивы M + C =
- 75. Свойства простых веществ M + O2 (или 2S) = MO2 (или MS2) (при нагревании порошков) Ti
- 76. (комплексообразование) M + 6HF = H2[MF6] + 3H2 M + 4CH3COOH + 6F– = [MF6]2– +
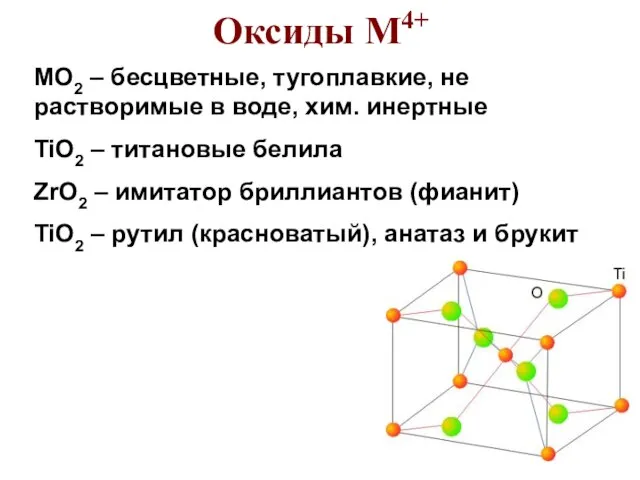
- 77. Оксиды М4+ MO2 – бесцветные, тугоплавкие, не растворимые в воде, хим. инертные TiO2 – титановые белила
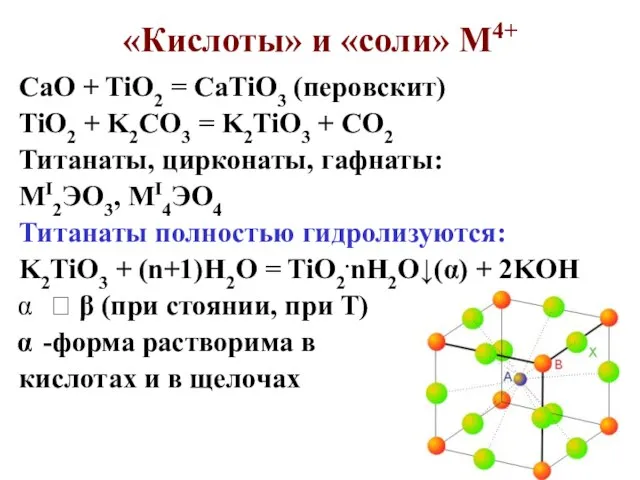
- 78. «Кислоты» и «соли» М4+ CaO + TiO2 = CaTiO3 (перовскит) TiO2 + K2CO3 = K2TiO3 +
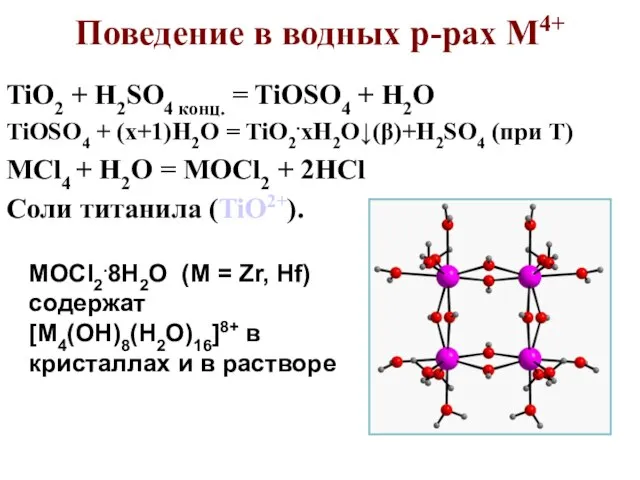
- 79. Поведение в водных р-рах M4+ TiO2 + H2SO4 конц. = TiOSO4 + H2O TiOSO4 + (x+1)H2O
- 80. Побочная подгруппа V группы ПС
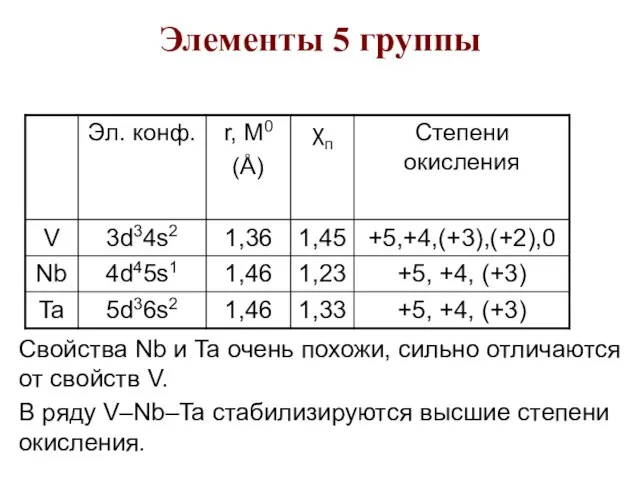
- 81. Элементы 5 группы Свойства Nb и Ta очень похожи, сильно отличаются от свойств V. В ряду
- 82. Содержание в земной коре и минералы V – 20 место, рассеян, VS2.V2S5 – патронит. Добывают из
- 83. Открытие элементов V – в 1801 г. мексиканец Дель Рио, затем в 1830 г. швед Сефстрём.
- 84. Простые вещества Получение сложное, проблема разделения Nb и Ta M2O5 + 5Ca = 5CaO + 2M
- 85. Известный "автомобильный король" Генри Форд сказал: "Если бы не было ванадия" - не было бы автомобиля".
- 86. Простые вещества Химически инертные 2V + 12HF = 2H[VF6] + 5H2 V + 6HNO3конц. = [VO2]NO3
- 87. ВАНАДИЙ 2+ VO основные VSO4 3+ V2O3 свойства V2(SO4)3 [VO]SO4 сульфат ванадила 4+ VO2 K4V4O9 ванадит
- 89. Скачать презентацию


























![[Co(NH3)6]3+ – комплекс (катионный комплекс); [Co(NH3)6]Cl3 – комплексное соединение (соль). [Fe(CO)5]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-36.jpg)
![Строение комплексного соединения K3 [Fe(CN)6] Ион-комплексообразователь (центральный атом) Лиганды от лат.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-37.jpg)
![Строение комплексного соединения Комплексное соединение состоит из: 1) внутренней сферы [комплекс]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-38.jpg)

![Цис- и транс- изомеры, для квадратных частиц. [Pt(Gly)2] – диглицинатоплатина (II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-45.jpg)
![ос- (mer-) реберный гран- (fac-) граневой Для октаэдрических частиц [Pt(NH3)2Cl4] [Co(NH3)3Cl3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-47.jpg)
![Лиганды во внутренней и внешней координационной сфере меняются местами. [Co(NH3)5Cl]CN –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-48.jpg)

![Cd2+ + CN– = [Cd(CN)]+ K1 = [Cd(CN)+]/[Cd2+][CN–]; [Cd(CN)]+ + CN–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-51.jpg)









![Комплексы лантаноидов Аквакомплексы [M(H2O)9]3+ лабильны (замещение лигандов за 10–7 – 10–9](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-65.jpg)






![(комплексообразование) M + 6HF = H2[MF6] + 3H2 M + 4CH3COOH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-75.jpg)




![Простые вещества Химически инертные 2V + 12HF = 2H[VF6] + 5H2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-85.jpg)
![ВАНАДИЙ 2+ VO основные VSO4 3+ V2O3 свойства V2(SO4)3 [VO]SO4 сульфат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/551584/slide-86.jpg)
 Презентация Соединения химических элементов 8 класс.
Презентация Соединения химических элементов 8 класс.  Презентация по Химии "Волокнистые материалы вокруг нас" - скачать смотреть
Презентация по Химии "Волокнистые материалы вокруг нас" - скачать смотреть  Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование Электроды 1 рода
Электроды 1 рода Анилин. История создания
Анилин. История создания Применение кремния
Применение кремния Состав, свойства и перегонка нефти. Нефтепродукты
Состав, свойства и перегонка нефти. Нефтепродукты Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Предельные углеводороды
Предельные углеводороды Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Курс хімії за 11 клас
Курс хімії за 11 клас Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы
Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Химия ғажайыптар әлемі
Химия ғажайыптар әлемі КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n
КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n Нітратна кислота. Нітрати Підготувала:Рибальчук Вікторія
Нітратна кислота. Нітрати Підготувала:Рибальчук Вікторія  Введение в общую химию. Основные понятия химии
Введение в общую химию. Основные понятия химии Качественные и количественные методы обработки хроматограмм
Качественные и количественные методы обработки хроматограмм Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез
Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment
Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment Оксид цинка
Оксид цинка Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть
Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть  Презентация по Химии "«Основания»" - скачать смотреть
Презентация по Химии "«Основания»" - скачать смотреть  Кристалл Гришина Л.А., учитель физики МКС(К) ОУ С (К) ОШ 37 I II вида г. Новосибирск
Кристалл Гришина Л.А., учитель физики МКС(К) ОУ С (К) ОШ 37 I II вида г. Новосибирск Сверхпроводимость как явление микромира
Сверхпроводимость как явление микромира Электролиз. Урок химии 11 класс
Электролиз. Урок химии 11 класс Неорганические соединения галогенов
Неорганические соединения галогенов