Содержание
- 2. Железо – химический элемент Степень окисления +2, +3
- 3. Железо – простое вещество
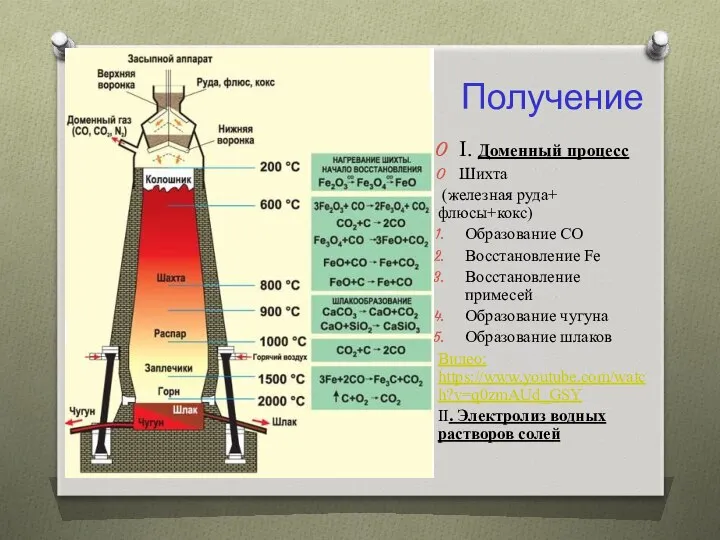
- 5. Получение I. Доменный процесс Шихта (железная руда+ флюсы+кокс) Образование СО Восстановление Fe Восстановление примесей Образование чугуна
- 6. Химические свойства 1. С неметаллами 2Fe+3Cl2→2FeCl3 (200 °С) 2Fe + 3Br2 –t°→ 2FeBr3 (FeI2) Fe +
- 7. 2. С водой 4Fe + 3O2 + 6H2 O → 4Fe(OH)3 3Fe + 4H2O –t°→ Fe3O4
- 8. 3. С кислотами
- 9. Fe + 2HCl → FeCl2 + H2 Fe + H2SO4(разб.) → FeSO4 + H2 В концентрированных
- 10. 5. С щелочными расплавами окислителей Окислители – нитраты калия и натрия, хлорат калия и др. 6.
- 11. Оксид алюминия Физические свойства А1203 — белый порошок или очень твёрдые кристаллы, тугоплавкий. Получение
- 13. Химические свойства FeO Основный FеО + 2НС1 (разб.) = FеС12 + Н2O FеО + 4НNO3 (конц.)
- 14. Химические свойства Fe2O3 Амфотерный Fе2O3 + 6НС1 (разб.) →2FеС13 + ЗН2O (t) Fе2O3 + 2NaОН (конц.)
- 15. Химические свойства Fe3O4 Fe3O4+ 8НС1 (разб.) = FеС12 + 2FеС13 + 4Н2O Fe3O4+ 8НI (разб.) =
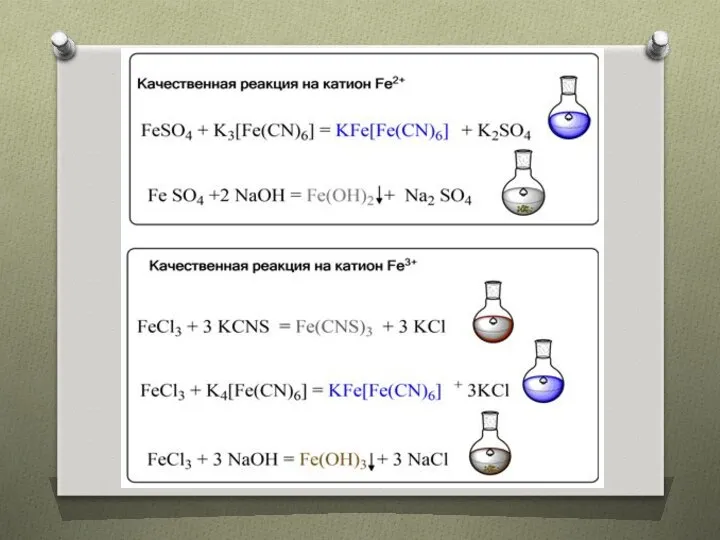
- 16. Гидроксиды железа Fe(OH)2 – белое твердое кристаллическое вещество, из раствора вы падает в виде серо-зеленого осадка
- 17. Fe(OH)3 – амфотерный гидроксид Fе(ОН)3 + 3НС1 (разб.) =FеС13 + 2Н2O Fе(ОН)3 + 3NaOH (конц.) →
- 18. Соли железа Ферраты – сильные окислители (сильнее дихромата и перманганата) 2К2FеO4+ 2(NH3. Н2O) →2 Fе(ОН)3 +
- 19. Cоли железа (II) FeSO4 +Mg = Fe + MgSO4 4Fe(NO3)2 = 2Fe2O3 +8NO2 + O2 4
- 20. Cоли железа (III) FeCl3 + Н2O = Fe(OH)2Cl + HCl (сильнокислая среда) 2FeCl3 + 3Na2CO3 +
- 25. Скачать презентацию




















 Презентация по Химии "Спирты" - скачать смотреть _
Презентация по Химии "Спирты" - скачать смотреть _ Химическое производство и химический процесс. (Тема 1)
Химическое производство и химический процесс. (Тема 1) Химия и производство
Химия и производство  Золото. Серебро. Металлы платиновой группы
Золото. Серебро. Металлы платиновой группы Минералы натрия
Минералы натрия General aspects of chemical structure and reactivity of organic compounds
General aspects of chemical structure and reactivity of organic compounds ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ПРИРОДНЫХ ЭНЕРГОНОСИТЕЛЕЙ И УГЛЕРОДНЫХ МАТЕРИАЛОВ Преподаватель Левашова Альбина Ивановна, к.т.н. Франци
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ПРИРОДНЫХ ЭНЕРГОНОСИТЕЛЕЙ И УГЛЕРОДНЫХ МАТЕРИАЛОВ Преподаватель Левашова Альбина Ивановна, к.т.н. Франци Лекарственное растительное сырье, содержащее производные простых фенолов
Лекарственное растительное сырье, содержащее производные простых фенолов Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии Кремний. Нахождение в природе. Свойства
Кремний. Нахождение в природе. Свойства Химические методы определения U, Pu, Th
Химические методы определения U, Pu, Th От простых правил к сложным структурам. Метод валентных связей. Принцип VSEPR
От простых правил к сложным структурам. Метод валентных связей. Принцип VSEPR Пищевые отравления солями тяжелых металлов Zn, Cu, Pb, Hg, Cd. Гигиенические требования к посуде пищевого назначения
Пищевые отравления солями тяжелых металлов Zn, Cu, Pb, Hg, Cd. Гигиенические требования к посуде пищевого назначения Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Исследование орехов мендаля на содержание цианид-ионов
Исследование орехов мендаля на содержание цианид-ионов Биогенные элементы. Классификация. Топография биогенных элементов в организме человека
Биогенные элементы. Классификация. Топография биогенных элементов в организме человека Строение атома
Строение атома Презентация по Химии "Металлическая связь" - скачать смотреть
Презентация по Химии "Металлическая связь" - скачать смотреть  Химические свойства предельных одноатомных спиртов
Химические свойства предельных одноатомных спиртов Ямр на ядрах 14n, 15n. 19f, 31p, лантаноїдні зсуваючі реагенти
Ямр на ядрах 14n, 15n. 19f, 31p, лантаноїдні зсуваючі реагенти Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород
Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород Электролитическая диссоциация
Электролитическая диссоциация Изменение агрегатного состояния вещества. Двигатели внутреннего сгорания
Изменение агрегатного состояния вещества. Двигатели внутреннего сгорания Химические реакторы
Химические реакторы Диаграмма состояния системы железо – углерод
Диаграмма состояния системы железо – углерод Презентация по химии Типы изомерии
Презентация по химии Типы изомерии  Различные способы решения задач на смеси, сплавы, растворы
Различные способы решения задач на смеси, сплавы, растворы Стиральные порошки и средства для стирки 2016
Стиральные порошки и средства для стирки 2016