Содержание
- 2. Элементы VI группы главной подгруппы. O Халькогены, т.е S « рождающие руды». Se Te Po
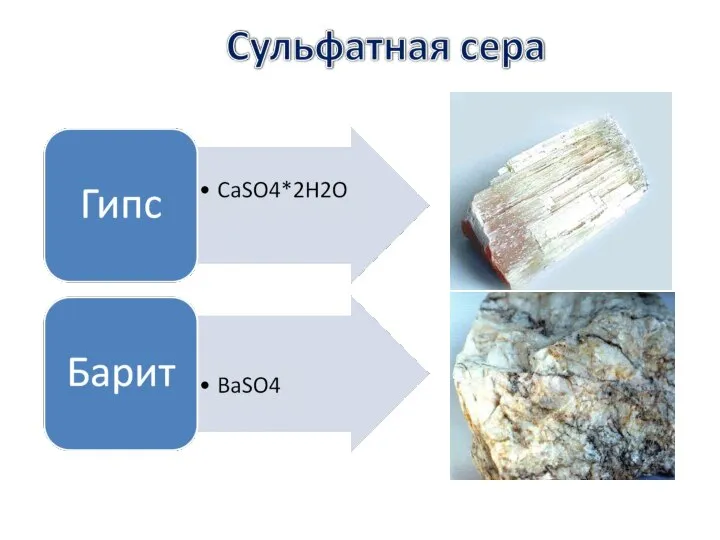
- 3. Se и Te -минералов не образуют Ро - очень редкий радиоактивный элемент
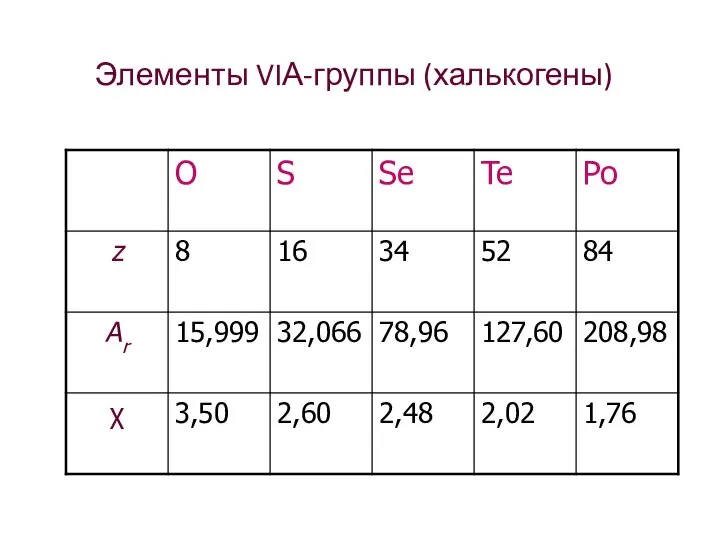
- 4. Элементы VIА-группы (халькогены)
- 5. Кислород
- 6. Кислород Кислород – самый распространенный элемент на Земле (49,5% масс.). Кислород существует в самородном виде (воздух)
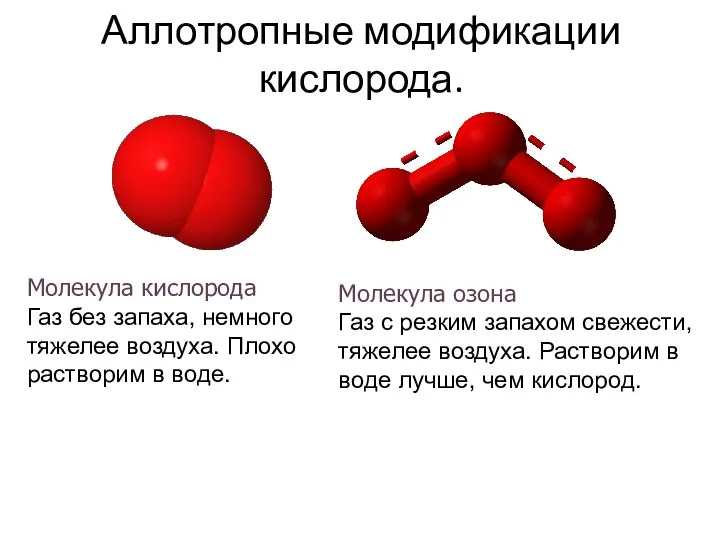
- 7. Аллотропные модификации кислорода. Молекула озона Газ с резким запахом свежести, тяжелее воздуха. Растворим в воде лучше,
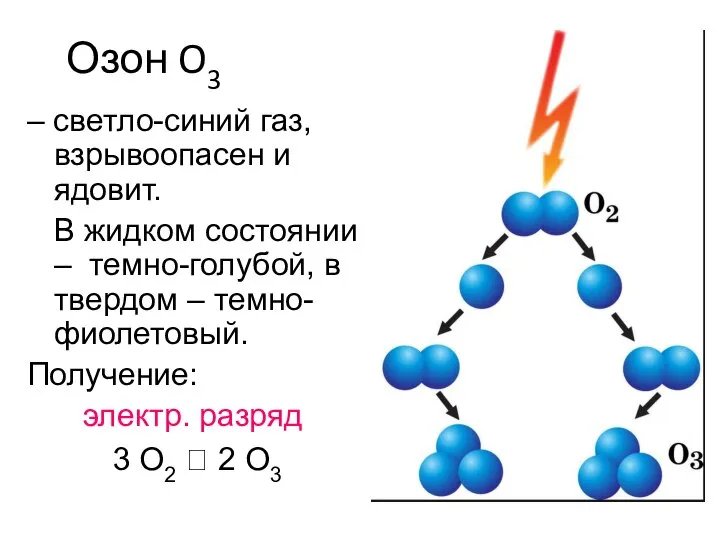
- 8. Озон O3 – светло-синий газ, взрывоопасен и ядовит. В жидком состоянии – темно-голубой, в твердом –
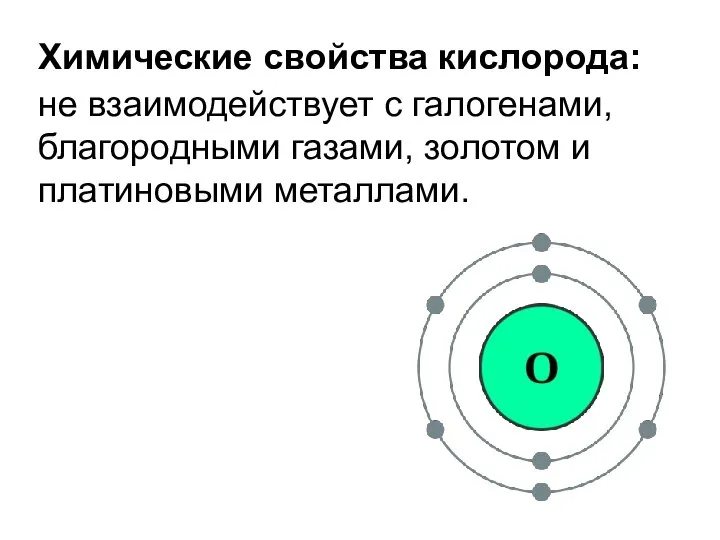
- 9. Химические свойства кислорода: не взаимодействует с галогенами, благородными газами, золотом и платиновыми металлами.
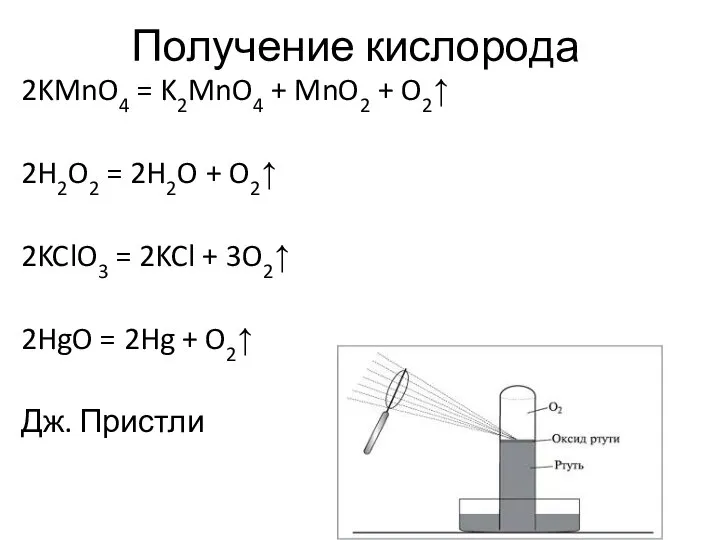
- 10. Получение кислорода 2KMnO4 = K2MnO4 + MnO2 + O2↑ 2H2O2 = 2H2O + O2↑ 2KClO3 =
- 11. Кислород активно взаимодействует со щелочными металлами даже без нагревания. Металлы средней и низкой активности реагируют с
- 12. Реакция горения При взаимодействии металлов и неметаллов с кислородом зачастую происходит выделение большого количества тепла и
- 13. Взаимодействие кислорода с азотом происходит только при нагревании свыше 2000 °C или же при электрическом разряде.
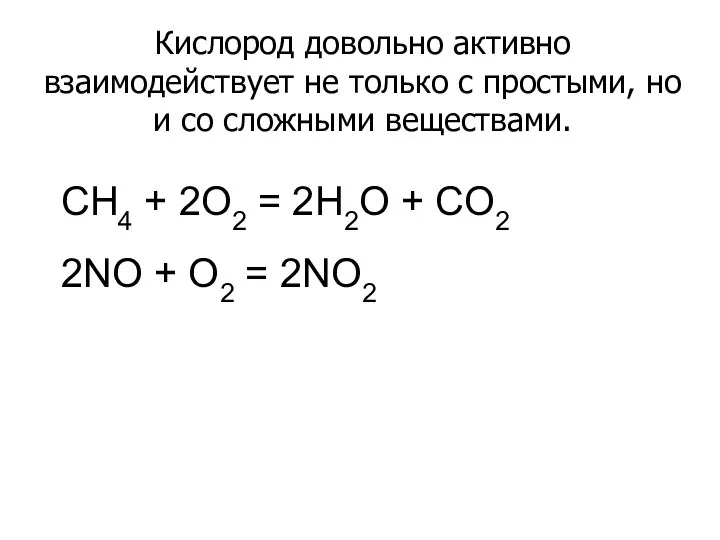
- 14. Кислород довольно активно взаимодействует не только с простыми, но и со сложными веществами. CH4 + 2O2
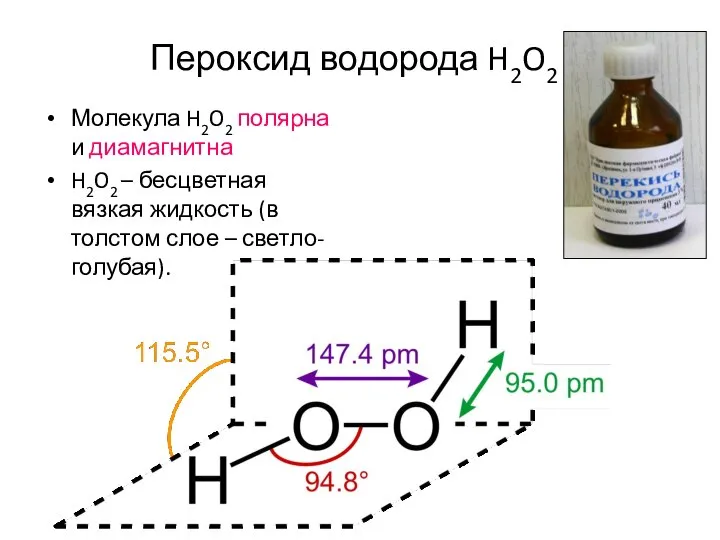
- 15. Пероксид водорода H2O2 Молекула H2O2 полярна и диамагнитна H2O2 – бесцветная вязкая жидкость (в толстом слое
- 16. Пероксид водорода H2O2 В разбавленных растворах пероксид водорода неустойчив и самопроизвольно диспропорционирует: 2H2O2–I = 2H2O–II +
- 17. Сера
- 19. Сера- химический элемент Сера - химический элемент ΙΙΙ( малого) периода,3 ряда, VΙ(А) группы Атомный номер 16
- 20. Шкала степеней окисления серы SO3, H2SO4, K2SO4, SF6 SO2, Na2SO3, SF4, SCl4 Na2S2, FeS2 H2S, Na2S,
- 24. Физические свойства. — твердое агрегатное состояние — желтого цвета — не растворима в воде — не
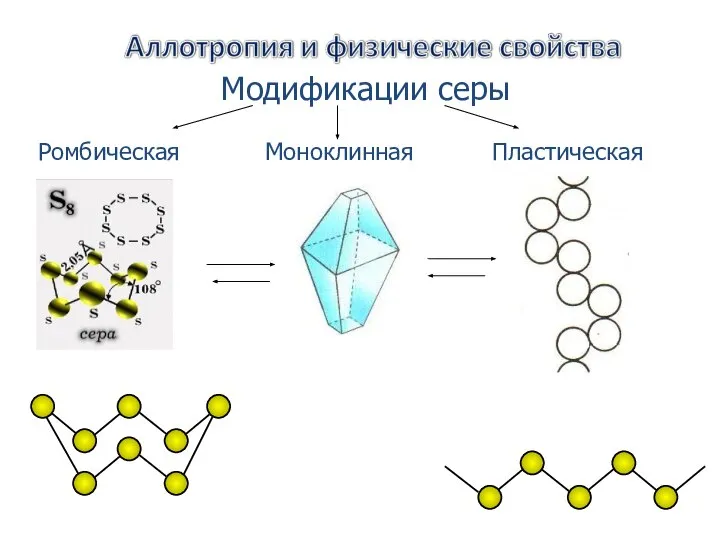
- 25. Модификации серы Ромбическая Моноклинная Пластическая
- 27. Обычная ромбическая сера состоит из циклических молекул S8. Кристаллы ромбической серы представляют собой октаэдры со срезанными
- 28. Пластическая сера Резиноподобное вещество коричневого цвета.
- 29. 1. Выплавление из горных пород FeS2 → FeS + S (без доступа воздуха) 2. В лаборатории
- 30. Mg + S = MgS 2Al + 3S = Al2S3 Взаимодействует со многими металлами, кроме золота
- 31. Zn + S = ZnS С остальными металлами сера реагирует при нагревании: Окислительные свойства сера проявляет
- 32. S + O2 = SO2 Из неметаллов с серой не реагируют только азот, йод и благородные
- 33. Взаимодействие с кислотами S + H2SO4(конц.) = SO2 ↑ + H2O S + 6HNO3 (конц.) =
- 34. Взаимодействие со щелочами S + KOH = K2S + K2SO3 + H2O Химические свойства серы
- 35. СЕРА в организме человека Сера входит в состав белков(волосы) Сера- составная часть активных веществ: витаминов и
- 36. Применение серы
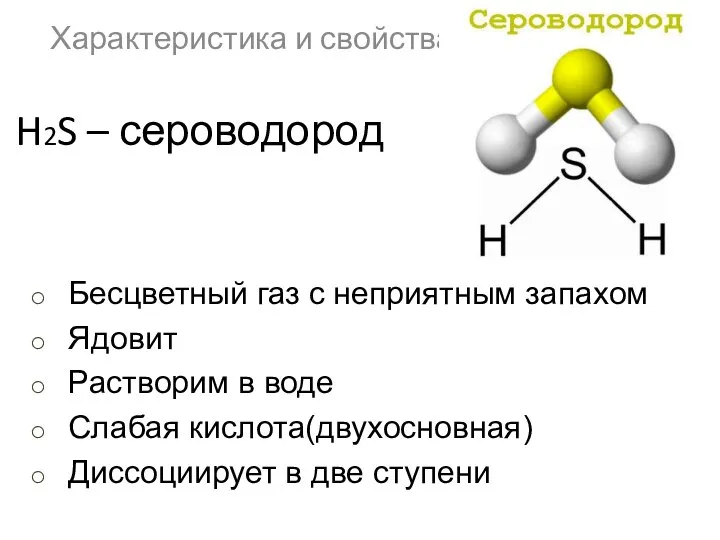
- 37. H2S – сероводород Характеристика и свойства Бесцветный газ с неприятным запахом Ядовит Растворим в воде Слабая
- 39. Получение. H2 + S → H2S Вытеснение сероводорода из сульфидов сильными кислотами HCl + FeS →
- 40. Диссоциация. Диссоциация происходит в 2 ступени: H2S → H+ + HS- HS- → 2H+ + S2-
- 41. Химические свойства !! Только восстановитель 2H2S + O2(недост) → 2S + 2H2O 2H2S + 3O2(изб) →
- 42. SO2 – сернистый газ Характеристика и свойства Бесцветный газ с резким запахом Ядовит Тяжелее воздуха Хорошо
- 43. Получение. 1. В промышленности: обжиг сульфидов 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 2. В лаборатории:
- 44. Химические свойства SO2 + H2O ↔ H2SO3 2NaOH + SO2 → Na2SO3 + H2O (NaHSO3) SO2
- 45. SO3 – серный ангидрид Характеристика и свойства Бесцветная жидкость При температуре Гигроскопичен
- 46. Получение. В промышленности 2SO2 + O2 → 2SO3 В лаборатории Fe2(SO4)3 → Fe2O3 + 3SO3 to,
- 47. Химические свойства SO3 + H2O → H2SO4
- 48. Серная кислота в природе Кислотное озеро на глубине вулкана Малый Семячик Кипящее озеро (Курильские острова) Европа
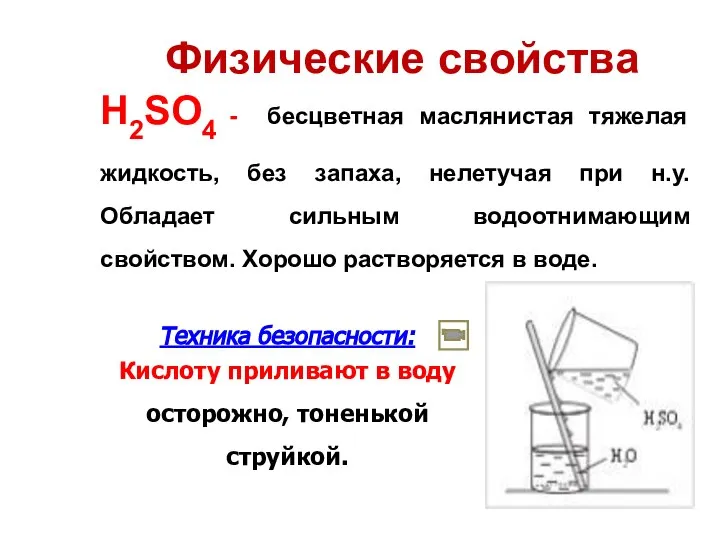
- 49. Физические свойства H2SO4 - бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при н.у. Обладает сильным водоотнимающим
- 50. Разбавление серной кислоты https://www.youtube.com/watch?v=55AzmbliyyI
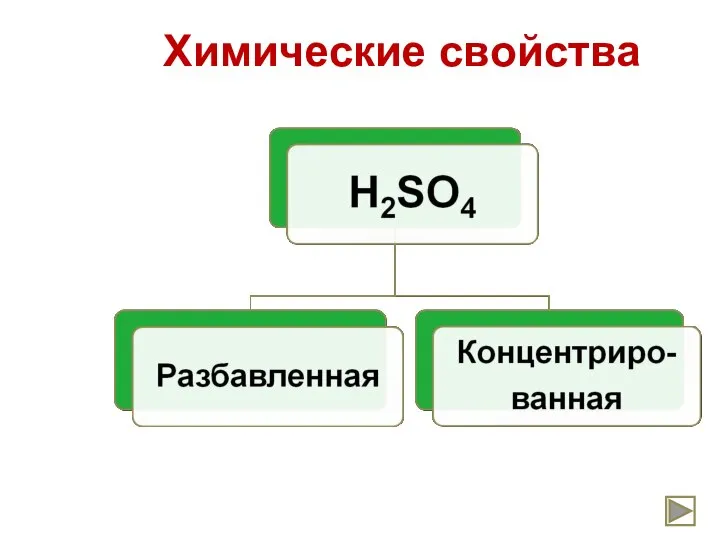
- 51. Химические свойства
- 52. Химические свойства разбавленной H2SO4 1. Взаимодействие с металлами (Стоящими до Н в ЭРНМ) Zn + H2SO4
- 53. Химические свойства разбавленной H2SO4 2. Взаимодействие с основными и амфотерными оксидами H2SO4 + CuO = CuSO4
- 54. Химические свойства разбавленной H2SO4 3. Взаимодействие с основаниями: а) щелочами H2SO4 + 2NaOH = Na2SO4 +
- 55. Химические свойства разбавленной H2SO4 4. Взаимодействие с солями H2SO4 + BaCl2 = BaSO4↓+ 2HCl Качественная реакция
- 56. Химические свойства концентрированной H2SO4 Концентрированная H2SO4 - сильный окислитель за счет S(+6) 1. Взаимодействие с металлами
- 57. СВОЙСТВА СЕРНОЙ КИСЛОТЫ https://www.youtube.com/watch?v=NbG1fq5MkAg
- 58. Соли серной кислоты
- 59. СПАСИБО ЗА ВНИМАНИЕ!
- 60. Задание. Определите степени окисления серы в соединениях : SO2, H2S, SO3, CaS, Na2SO4, NaHS, KHSO4, MgSO4,
- 61. Тест 1. Концентрированная серная кислота при комнатной температуре не действует на каждое из двух веществ: А)
- 62. Тест (ответы) 1 – Г 2 – Б 3 – Г 4 – А
- 63. 1.Распределение электронов по энергетическим уровням в атоме серы: А. 2, 6. В. 2, 8, 6. Б.
- 64. 3.Свойство, характерное для серы: А.Хорошо растворима в воде. Б.Имеет металлический блеск. В.Твердое вещество желтого цвета. Г.Проводит
- 66. Скачать презентацию

















































 Тема: «Вода – основа жизни на Земле»
Тема: «Вода – основа жизни на Земле» Живая и мертвая вода
Живая и мертвая вода Химиялық қару
Химиялық қару Э.М. Спиридонов. Эволюция минералов вольфрама в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов вольфрама в зоне гипергенеза Химические реакции. Скорость химической реакции
Химические реакции. Скорость химической реакции Фосфор
Фосфор Водород, нахождение в природе. Получение водорода и его физические свойства
Водород, нахождение в природе. Получение водорода и его физические свойства Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Вода ценный дар природы. Биологическая роль воды
Вода ценный дар природы. Биологическая роль воды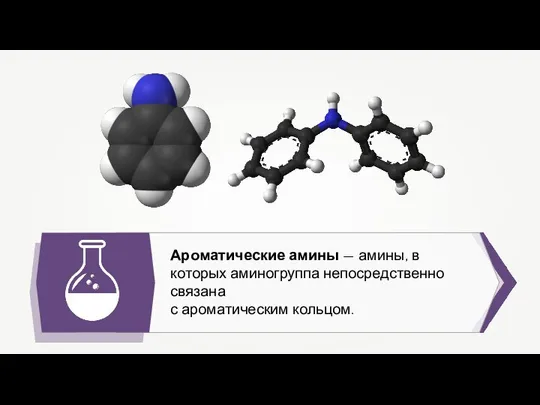 Ароматические амины
Ароматические амины Жартылый өткізгіштікке ие химиялық элементтер
Жартылый өткізгіштікке ие химиялық элементтер Configuratia electronica. Sistemul periodic al elementelor. (Curs 3)
Configuratia electronica. Sistemul periodic al elementelor. (Curs 3) Условная оптимизация методом классического математического анализа с применением множителей
Условная оптимизация методом классического математического анализа с применением множителей Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно Природные источники углеводородов
Природные источники углеводородов Презентация Дисперсные системы
Презентация Дисперсные системы  Chemical Reactions and Stoichiometry
Chemical Reactions and Stoichiometry Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Интерактивное пособие по химии
Интерактивное пособие по химии Воздействие слюны на крахмал
Воздействие слюны на крахмал Белки - 4. Обмен сложных белков. Нуклеопротеиды
Белки - 4. Обмен сложных белков. Нуклеопротеиды Истинные и псевдо-коллоиды
Истинные и псевдо-коллоиды Тема урока: «Серная кислота» 9 класс
Тема урока: «Серная кислота» 9 класс  Угольная кислота и ее соли
Угольная кислота и ее соли Тема урока: «Скорость химических реакций.» Цель урока : Знать определение скорости реагирующих веществ, от реакций; зависимости с
Тема урока: «Скорость химических реакций.» Цель урока : Знать определение скорости реагирующих веществ, от реакций; зависимости с Основы кристаллографии
Основы кристаллографии ЙОД
ЙОД