Содержание
- 2. FAMILIA RETROVIRIDAE. VIRUSUL HIV ŞI INFECŢIA HIV/SIDA Prima descriere clinică a SIDA – 1981 1983–HIV a
- 3. Epidemia la nivel mondial Finele anului 2020 37.7 mln persoane trăiau cu HIV 79.3 mln au
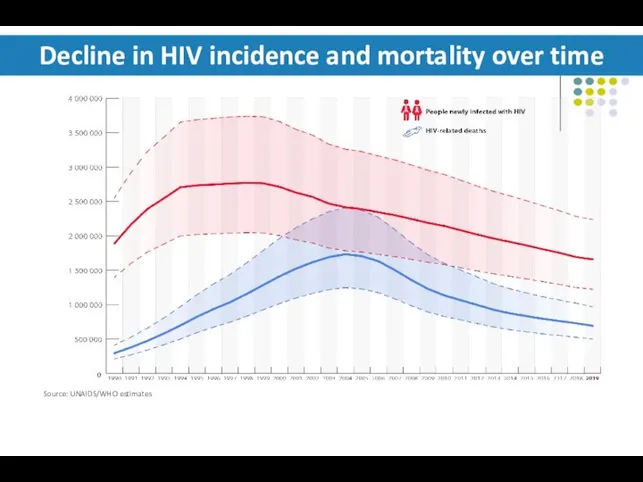
- 5. Decline in HIV incidence and mortality over time Source: UNAIDS/WHO estimates
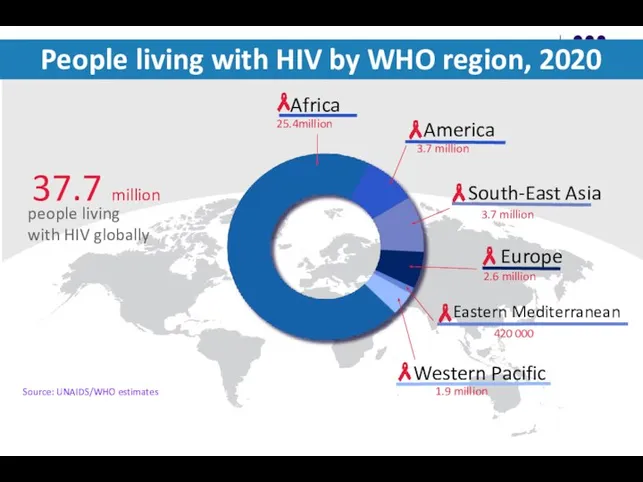
- 6. People living with HIV by WHO region, 2020 Source: UNAIDS/WHO estimates
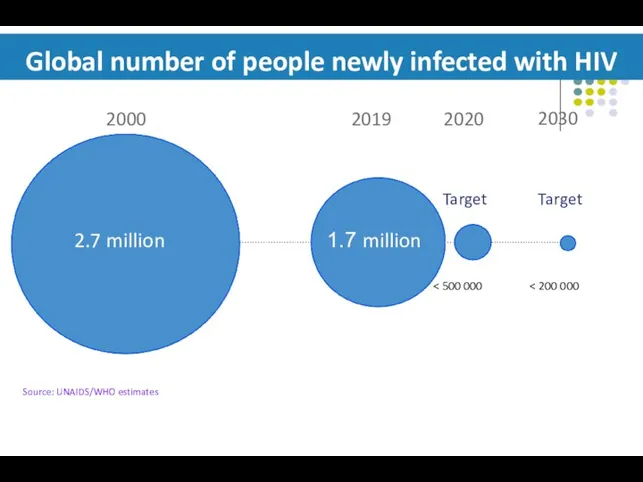
- 7. Global number of people newly infected with HIV Source: UNAIDS/WHO estimates 2.7 million 2019 2020 2030
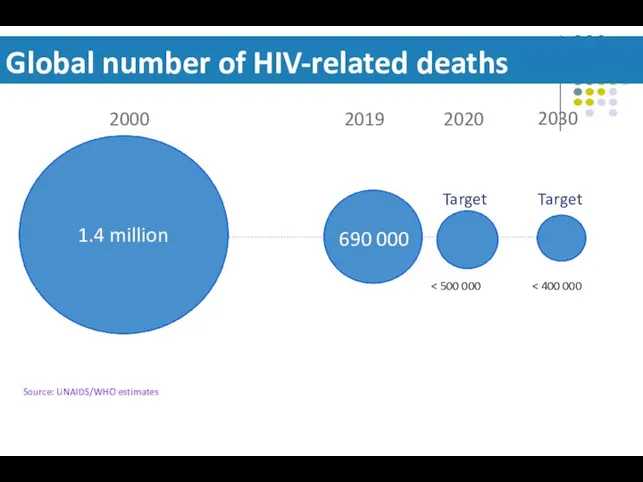
- 8. Global number of HIV-related deaths Source: UNAIDS/WHO estimates 2019 2020 2030 690 000 Target Target 2000
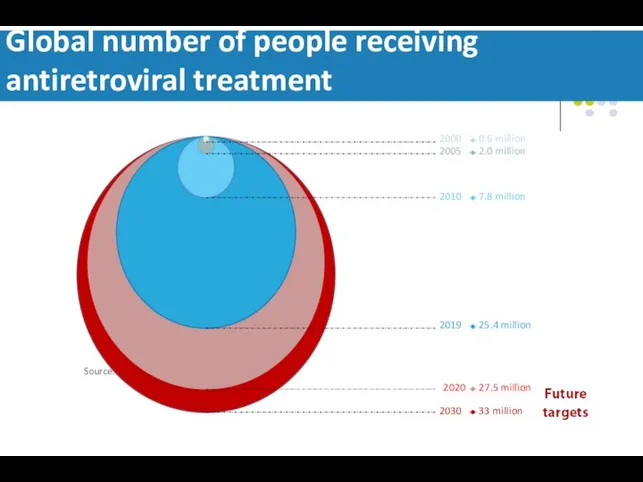
- 9. 40% Global number of people receiving antiretroviral treatment Source: UNAIDS/WHO estimates
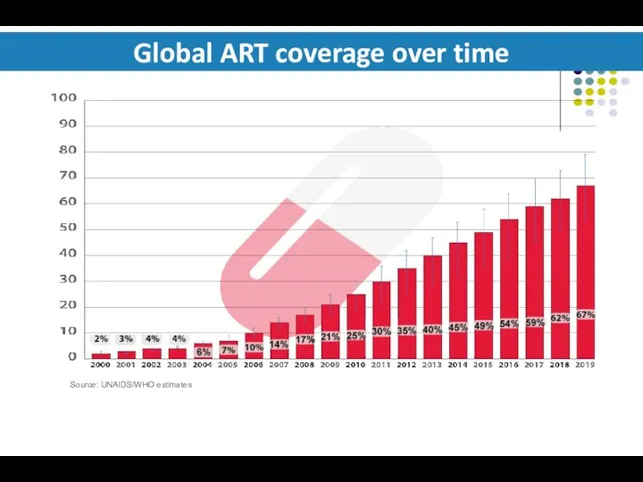
- 10. Global ART coverage over time Source: UNAIDS/WHO estimates
- 12. Epidemia infecției cu HIV în RM (La 1 ianuarie 2020) Numărul estimativ al persoanelor HIV infectate
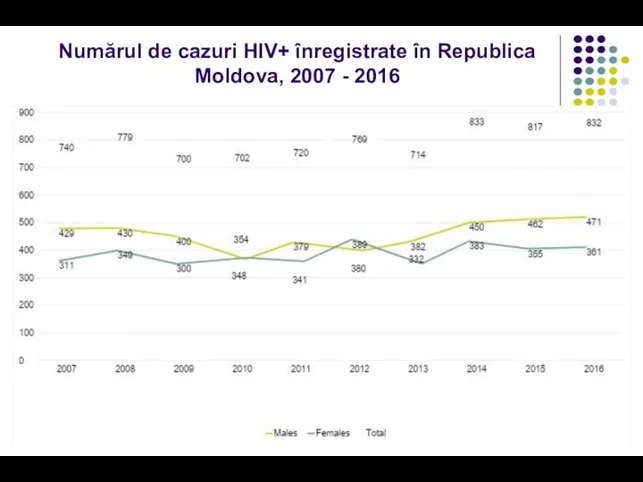
- 13. Numărul de cazuri HIV+ înregistrate în Republica Moldova, 2007 - 2016
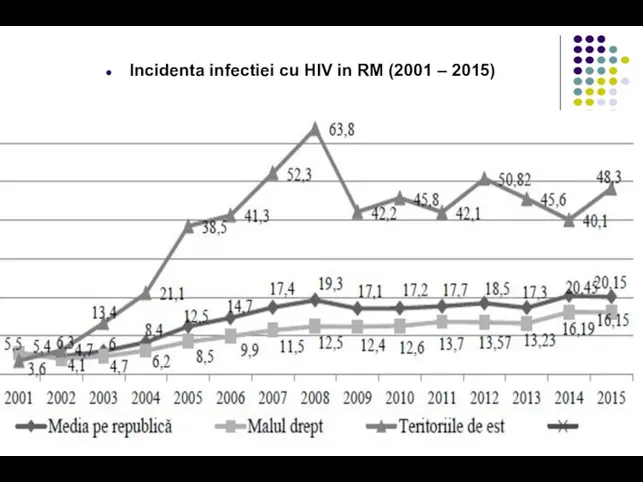
- 14. Incidenta infectiei cu HIV in RM (2001 – 2015)
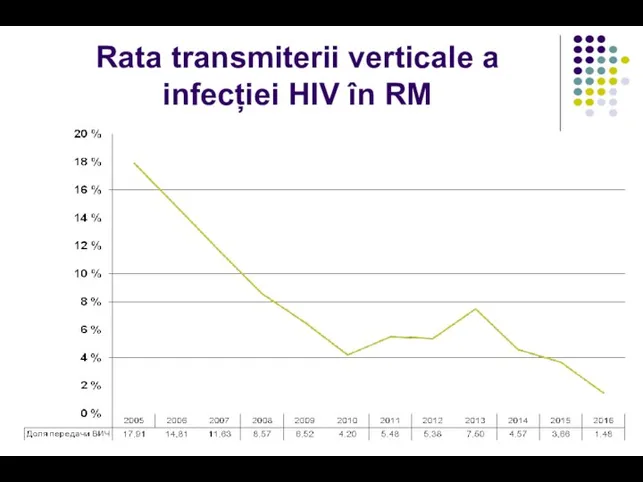
- 15. Rata transmiterii verticale a infecției HIV în RM
- 16. Prin Hotărârea Guvernului Nr. 1164 din 22.10.2016 a fost aprobat Programul naţional de prevenire şi control
- 17. CLASIFICAREA FAM. RETROVIRIDAE Retroviridae – familie numeroasă de virusuri ARN dotate cu o enzimă numită transcriptază
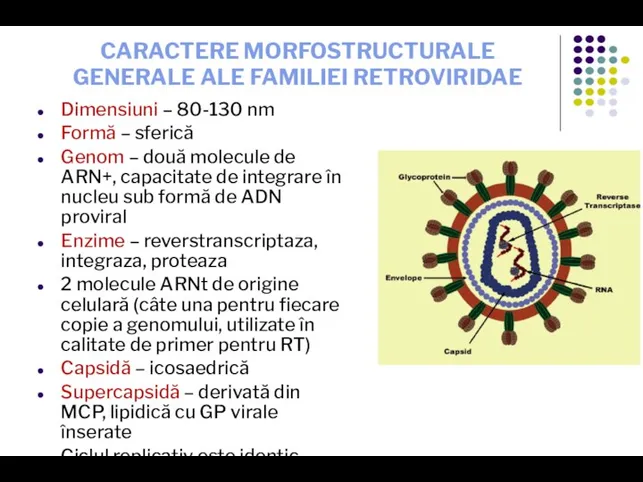
- 18. CARACTERE MORFOSTRUCTURALE GENERALE ALE FAMILIEI RETROVIRIDAE Dimensiuni – 80-130 nm Formă – sferică Genom – două
- 19. VIRUSURILE HIV HIV-1 şi HIV-2 – responsabili de Sindromul Imuno-Deficienţei Achiziţionate (SIDA) HIV-1 – repartiţie mondială
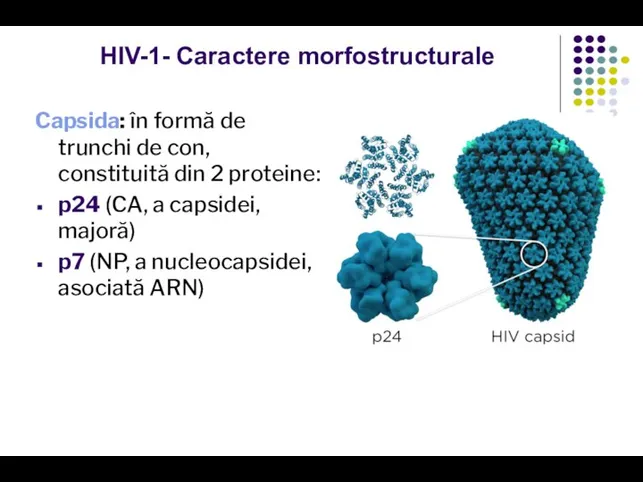
- 20. HIV-1- Caractere morfostructurale Capsida: în formă de trunchi de con, constituită din 2 proteine: p24 (CA,
- 21. Supercapsida: dublu strat fosfolipidic de origine celulară în care sunt înserate 2 GP virale Gp120, de
- 24. Structura genomului (apr. 10 mii nucleotide) Gena gag (group antigens), codifică o poliproteina-precursor, clivata ulterior de
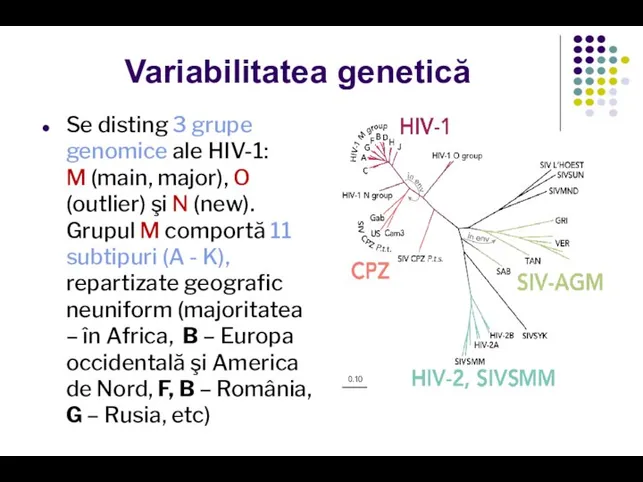
- 27. Variabilitatea genetică Se disting 3 grupe genomice ale HIV-1: M (main, major), O (outlier) şi N
- 29. Omologia dintre HIV-1 şi HIV-2 este de 42%, mai înaltă la nivelul genelor gag şi pol
- 30. Rezistența HIV la agenți fizici și chimici HIV este un virus slab rezistent în mediul extern
- 31. Cultivarea HIV Celule mononucleate de la persoane sănătoase Linii celulare din LT – MT2 Animale sensibile
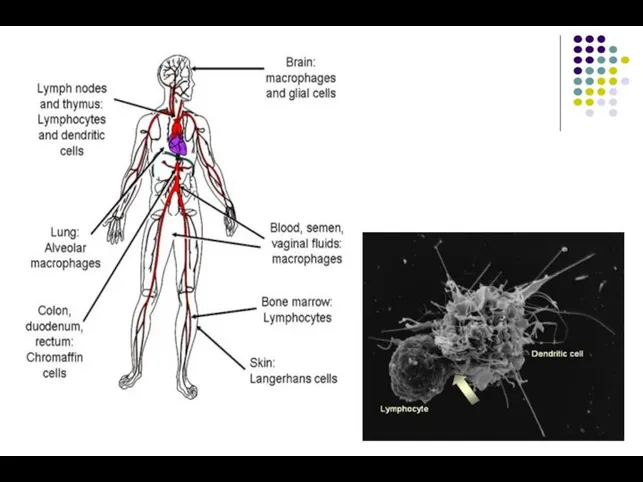
- 32. CELULELE-ŢINTĂ ŞI REZERVORUL CELULAR 1. Limfocite TCD4+ (Th) (99% de replicare, ECP - sinciţii) 2. CPA:
- 34. Se disting: - tulpini ale HIV cu tropism macrofagic (M, sau R5), utilizează coreceptorul CCR5, se
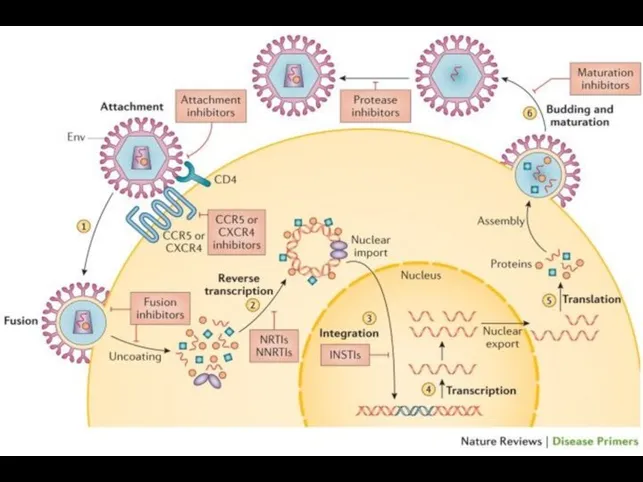
- 37. CICLUL DE REPLICARE https://www.youtube.com/watch?v=GyofqO1TRjU Ataşarea HIV la celula-gazdă prin legarea gp120 de receptorul celular CD4. Rezultă
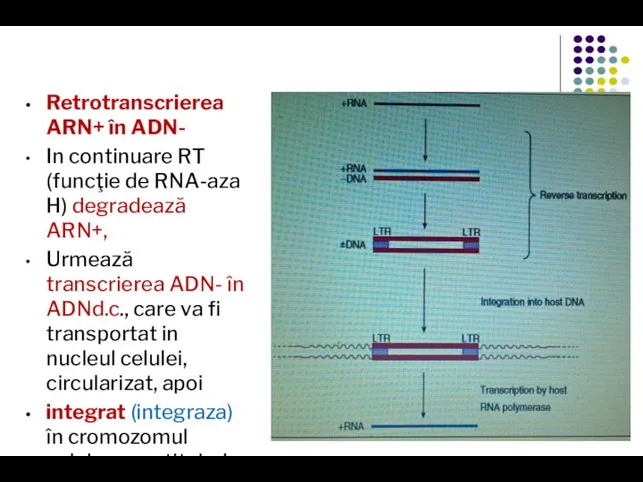
- 39. Retrotranscrierea ARN+ în ADN- In continuare RT (funcţie de RNA-aza H) degradează ARN+, Urmează transcrierea ADN-
- 41. Biosinteza: Transcrierea ADNv în ARNm şi ARN viral prin intermediul ARN-polimerazei II celulare Sinteza proteinelor virale
- 43. Asamblarea si eliberarea virionilor: Poliproteina env (gp160) este transportata din RE in complexul Golgi, unde este
- 45. Maturizarea virionului se produce prin clivarea poliproteinei gag/pol în proteine individuale şi enzime de către proteaza
- 48. 1-10 mlrd de virioni/zi/o persoană infectată Variabilitatea HIV este determinată de erorile comise de RT (o
- 49. Mecanismele de distrugere a limfocitelor T CD4: Liza directă a celulelor infectate (ECP) Limfocitele T CD8
- 53. PATOGENEZA ŞI CLINICA INFECŢIEI CU HIV Transmiterea: Cale sexuală (hetero-, homo). Cale sangvină (utilizatori de droguri
- 54. În ultimii ani, evoluţia epidemiei infecţiei HIV/SIDA în ţara noastră se caracterizează prin următoarele particularităţi: extinderea
- 55. EVOLUŢIA MALADIEI Incubaţia – de la câteva zile până la câteva săptămâni (2 - 4) de
- 56. Factorii care influenţează evoluţia primo-infecţiei: tipul virusului, raspunsul imun al gazdei şi factori genetici (homozigoţii cu
- 58. Faza asimptomatică, de latenţă clinică (durata variabilă: 2 săptămâni – zeci de ani). Virusul se replică
- 59. Faza clinică (SIDA) Numărul LT CD4 - 500-200 celule/µl. Se manifestă clinic prin febră cronică, pierdere
- 68. Răspunsul imun: Celular – LT CD8 recunosc şi elimină celulele infectate (în special LT CD4) prin
- 69. DIAGNOSTICUL DE LABORATOR AL INFECŢIEI HIV/SIDA Teste directe Detectarea Ag p24 (marker direct al infecţiei HIV)
- 70. 2. Detectarea ARN-lui plasmatic sau ADNv prin teste de amplificare genică (7-10 zile dupa infectare). Prezenţa
- 71. Teste indirecte de depistare /screening Teste ELISA de depistare a Ac (după minimum 22 zile de
- 74. Diagnosticul de laborator al infectiei cu HIV in RM Screening-ul infectiei cu HIV La toate nivelurile
- 75. Nivelurile de testare HIV
- 76. Liniile de testare HIV
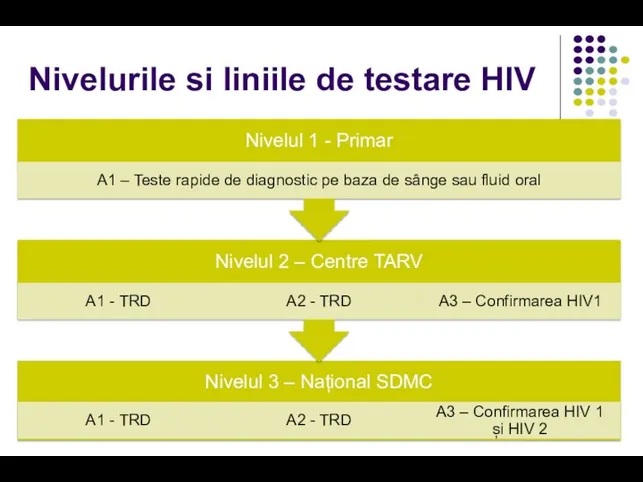
- 77. Nivelurile si liniile de testare HIV
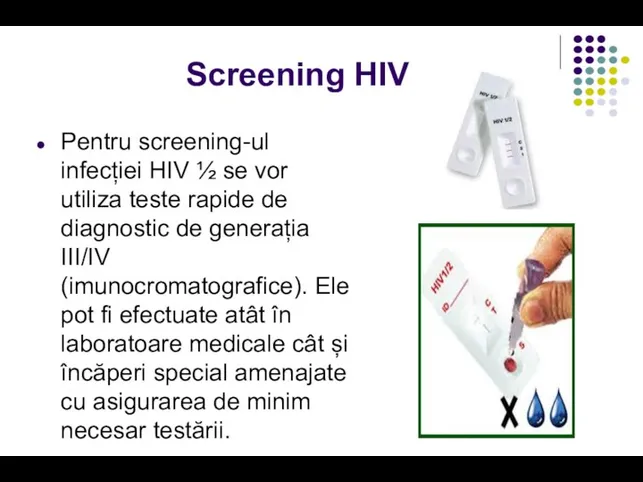
- 78. Screening HIV Pentru screening-ul infecției HIV ½ se vor utiliza teste rapide de diagnostic de generația
- 79. Confirmarea infectiei cu HIV Confirmarea va fi efectuată utilizând platforma GeneXpert care este implementată în RM
- 80. Metoda GeneXpert Metoda GeneXpert este o metodă molecular genetică, complet automatizată, real-time, ce detectează: Xpert HIV-1
- 82. Diagnosticul primo-infecţiei (markerii virali) ARNv plasmatic (apare după 8-10 zile de la contagiu) Ag p24 în
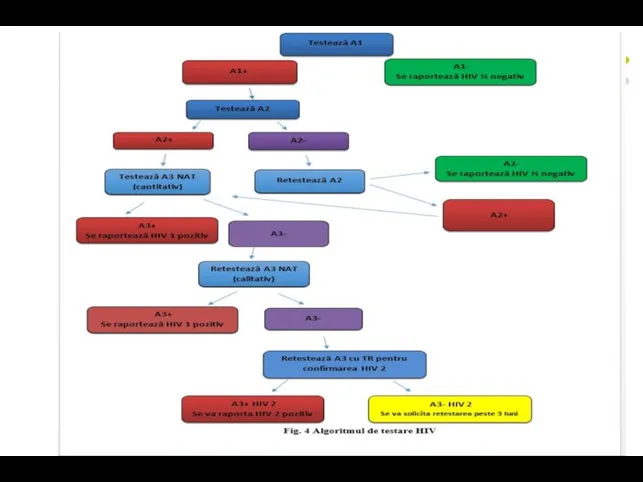
- 83. Algoritmul de testare HIV
- 84. CHIMIOTERAPIA ANTIRETROVIRALĂ După mecanismul de acţiune: Inhibitori nucleozidici ai RT (Abacavir, Didanosin, Lamivudin, Stavudin, Zalcitabin, Zidovudin,
- 87. Este indicată asocierea a 3 chimioterapice: 2 INRT + 1 IP; 2 INRT + 1 INNRT,
- 88. Persoanele infectate cu HIV şi bolnave de SIDA sunt asigurate cu tratament antiretroviral gratuit. Tratamentul antiretroviral
- 89. PROFILAXIA INFECŢIEI HIV/SIDA Măsuri nespecifice: prevenirea transmiterii HIV Profilaxia post-expunere (un curs de tratament antiretroviral imediat
- 90. STRATEGII DE VACCINARE Elaborarea vaccinurilor vii atenuate Elaborarea vaccinurilor inactivate Vaccinuri recombinante subunitare (numai imunitate umorală)
- 92. VIRUSURILE HTLV (Human T-cell Lymphotropic Virus) Genul Deltaretrovirus Specii HTLV-1 şi HTLV-2 Structura – comună retrovirusurilor
- 93. ONCOGENEZA VIRALĂ Cancerul este consecinţa dereglării procesului normal de proliferare celulară. Căile de apariţie a cancerului:
- 94. Virusuri cu potenţial oncogen: Virusuri cu genom ADN (Papovaviridae, Adenoviridae, Herpesviridae, Hepadnaviridae) Virusuri cu genom ARN
- 95. Virusurile oncogene conţin gene care pot induce tumori – v-onc Toate celulele conţin gene omoloage: proto-oncogene
- 97. Скачать презентацию












































































 Восприятие фильмов
Восприятие фильмов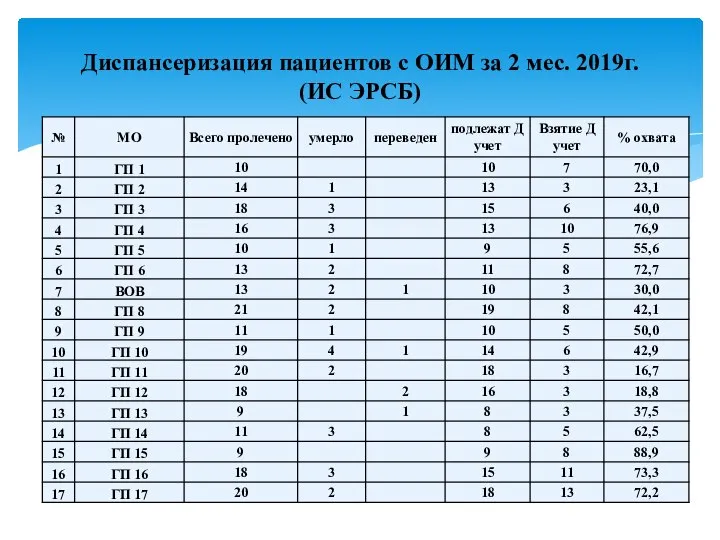 Диспансеризация пациентов с ОИМ за 2 мес. 2019г. (ИС ЭРСБ)
Диспансеризация пациентов с ОИМ за 2 мес. 2019г. (ИС ЭРСБ) Особенности строения и жизнедеятельности бактериальной клетки
Особенности строения и жизнедеятельности бактериальной клетки Работа в личном кабинете специалиста в ЕГИСЗ
Работа в личном кабинете специалиста в ЕГИСЗ Адам организмінің микрофлорасы. Дисбактериоз
Адам организмінің микрофлорасы. Дисбактериоз Lung abscess
Lung abscess Входящие и выходящие тесты по теме: Контрацепция и аборты
Входящие и выходящие тесты по теме: Контрацепция и аборты Помилки в професійній діяльності
Помилки в професійній діяльності Эмоции тревоги и страха: сравнительная характеристика
Эмоции тревоги и страха: сравнительная характеристика ВИЧ/СПИД, об этом должен знать каждый
ВИЧ/СПИД, об этом должен знать каждый Рентгеноанатомия сердца и крупных сосудов
Рентгеноанатомия сердца и крупных сосудов Біріншілік туберкулездің клиникалық формалары, диагностикасы, емдеу принциптері
Біріншілік туберкулездің клиникалық формалары, диагностикасы, емдеу принциптері Система отношений личности. Невротический конфликт. Невроз. Психогения
Система отношений личности. Невротический конфликт. Невроз. Психогения Сердечно-легочная реанимация
Сердечно-легочная реанимация Общие вопросы клинической фармакологии
Общие вопросы клинической фармакологии Несовместимость, взаимодействие и комбинированное применение лекарственных средств
Несовместимость, взаимодействие и комбинированное применение лекарственных средств Бактеріальні хвороби риб
Бактеріальні хвороби риб На службе здоровья
На службе здоровья Становление психологии и педагогики
Становление психологии и педагогики Он елі ішектің ойық жарасы кезіндегі емдік денешынықтыру шаралары
Он елі ішектің ойық жарасы кезіндегі емдік денешынықтыру шаралары Понятие о рациональном питании
Понятие о рациональном питании Преждевременные роды
Преждевременные роды Семейство пикорнавирусов ( Picornaviridae)
Семейство пикорнавирусов ( Picornaviridae) Бедеулікті емдеуге арналған репродуктивті технология
Бедеулікті емдеуге арналған репродуктивті технология Классификация зубочелюстных аномалий и деформаций
Классификация зубочелюстных аномалий и деформаций Болезни слизистой полости рта
Болезни слизистой полости рта Сортировка и концепция АВС
Сортировка и концепция АВС Гигиена, внешний вид, уход за одеждой и обувью
Гигиена, внешний вид, уход за одеждой и обувью