Содержание
- 2. Условия обучения По итогам изучения дисциплины проводится экзамен В течение семестра необходимо выполнить 6 заданий Для
- 3. Темы дисциплины Основные определения термодинамики гетерогенных равновесий Типы фазовых равновесий Методы расчета парожидкостных равновесий бинарных систем
- 4. Список литературы Раева В.М. Фазовые равновесия бинарных систем: Учебное пособие. [Электронный ресурс]– М.: РТУ МИРЭА, 2018.
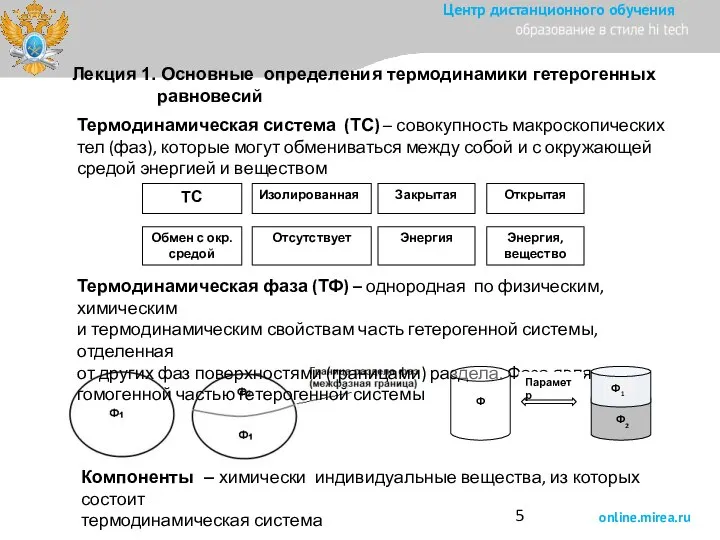
- 5. Термодинамическая система (ТС) – совокупность макроскопических тел (фаз), которые могут обмениваться между собой и с окружающей
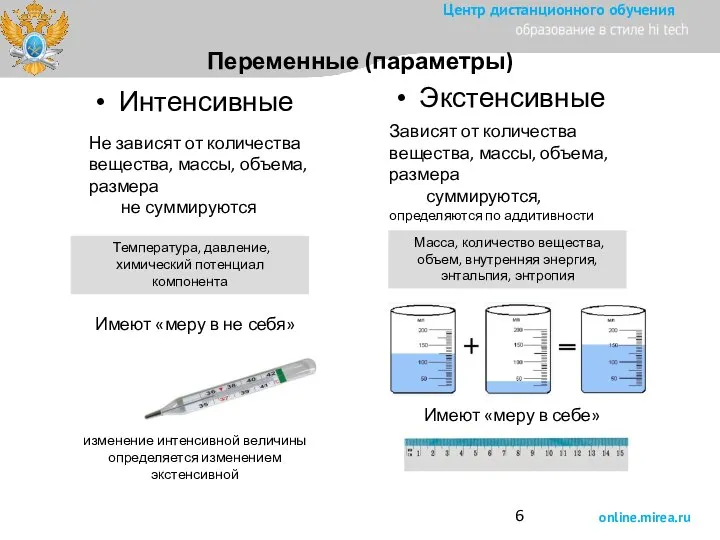
- 6. Переменные (параметры) Интенсивные Экстенсивные Не зависят от количества вещества, массы, объема, размера не суммируются Зависят от
- 7. Геометрическая интерпретация состава (мольные доли) Бинарные системы Трехкомпонентные системы Правило рычага
- 8. Примеры данных «состав – плотность» Вода – моноэтаноламин 700 кПа Вода – метилдиэтаноламин 101.32 кПа Brazilian
- 9. P, V, T - свойства Данные по плотности: Расчетные данные «состав – свойство» Циклогексен (х) –
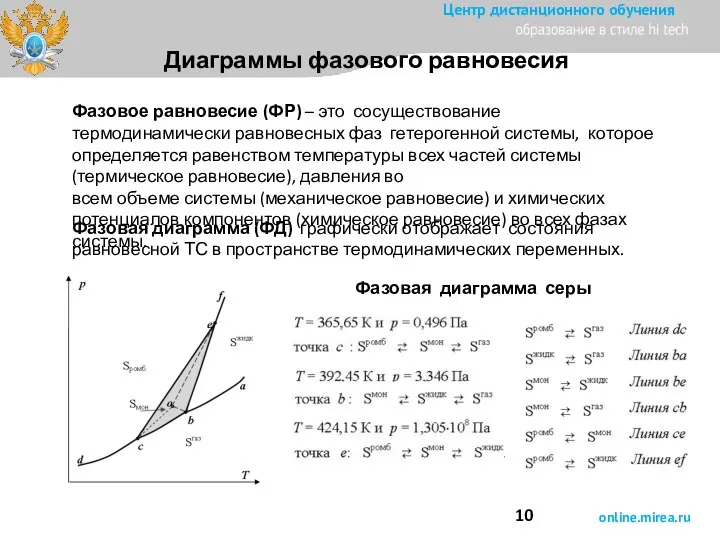
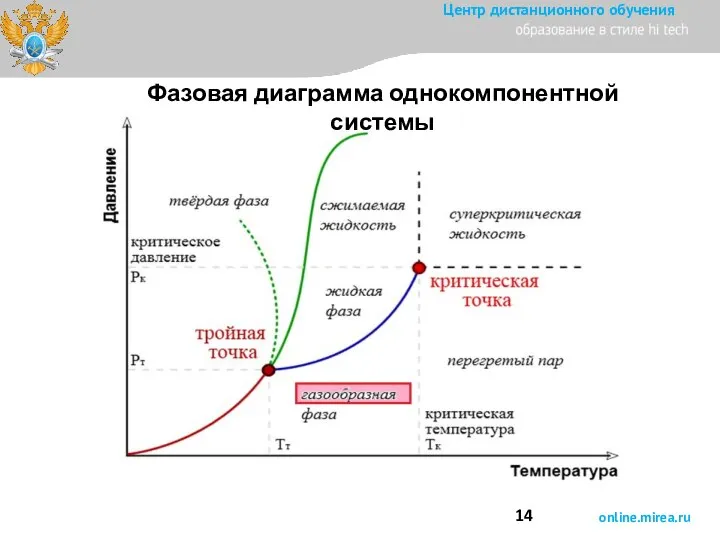
- 10. Диаграммы фазового равновесия Фазовое равновесие (ФР) – это сосуществование термодинамически равновесных фаз гетерогенной системы, которое определяется
- 11. Фазовые диаграммы однокомпонентных систем Полная фазовая диаграмма Проекции полной фазовой диаграммы О – тройная точка; К
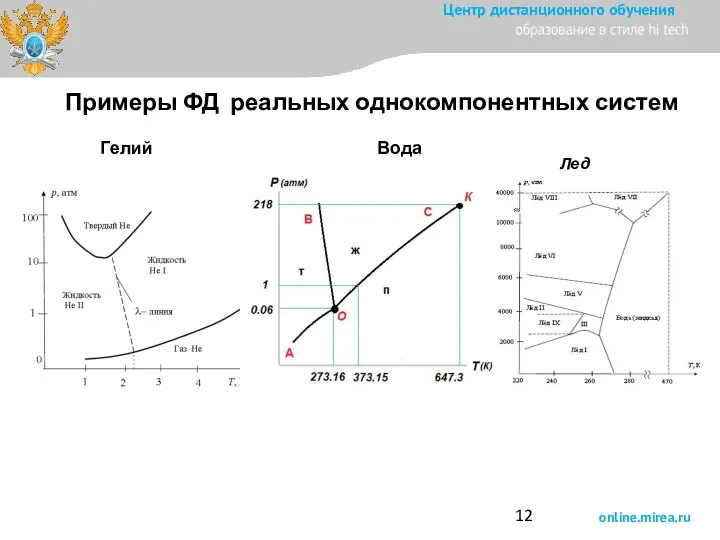
- 12. Примеры ФД реальных однокомпонентных систем Гелий Лед Вода
- 13. Фазовые диаграммы углекислого газа и воды СО2 Н2О
- 14. Фазовая диаграмма однокомпонентной системы
- 15. Состояние равновесия - состояние, к которому при данных внешних условиях стремится термодинамическая система Стабильное состояние -
- 16. Правило фаз Гиббса f – (наименьшее) число интенсивных параметров (независимых переменных) , с помощью которых можно
- 17. Фазовая диаграмма воды f = n − φ + 2 Вариантность системы
- 18. Примеры фазовых диаграмм бинарных систем (проекции полных диаграмм) Жидкость – газ Жидкость – жидкость – тв.
- 19. [1] J. Chem.Eng. Data. 2009. doi:10.1021/je800345j [2] J. Chem.Eng. Data. 2010. doi:10.1021/je900669t [3] J. Chem. Eng.
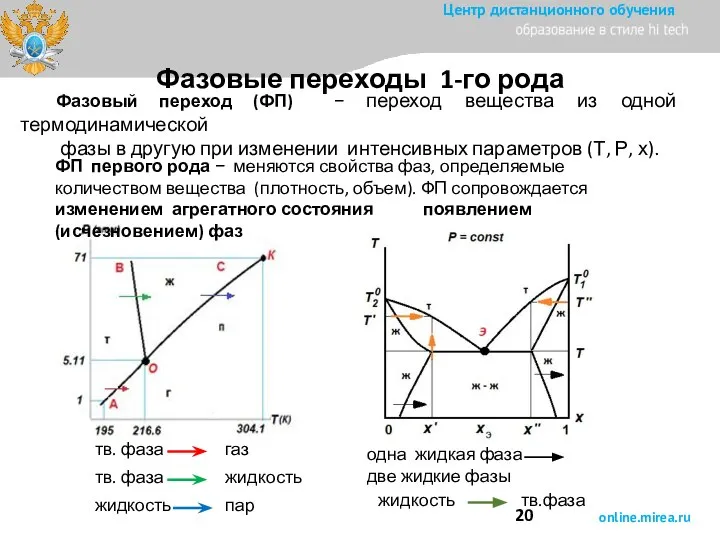
- 20. Фазовый переход (ФП) − переход вещества из одной термодинамической фазы в другую при изменении интенсивных параметров
- 21. ФП второго рода не сопровождаются изменением числа и агрегатного состояния фаз, связаны со структурными перестройками вещества
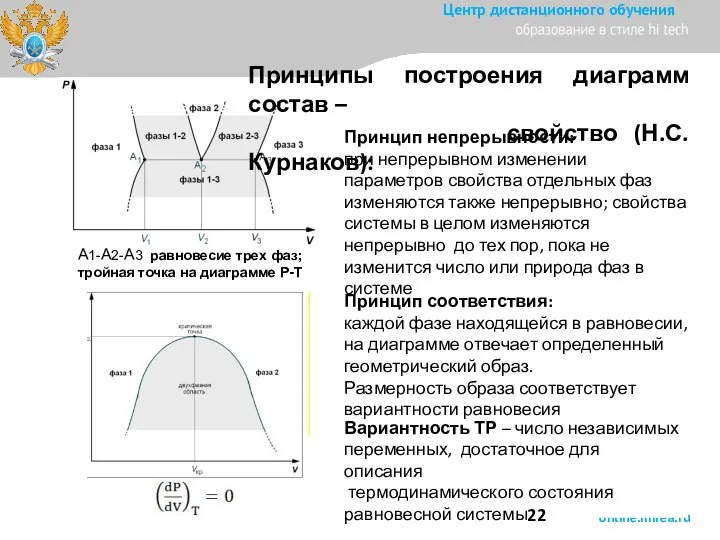
- 22. А1-А2-А3 равновесие трех фаз; тройная точка на диаграмме Р-Т Принцип непрерывности: при непрерывном изменении параметров свойства
- 23. Вопросы для самоконтроля: 1. Дать определения термодинамической системы, термодинамической фазы, фазового перехода. 2. Определить максимальное число
- 25. Скачать презентацию












![[1] J. Chem.Eng. Data. 2009. doi:10.1021/je800345j [2] J. Chem.Eng. Data. 2010.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/740266/slide-18.jpg)


 Государственная итоговая аттестация 11/12 классов в 2016-2017 учебном году
Государственная итоговая аттестация 11/12 классов в 2016-2017 учебном году Мен мамандық әлеміндемін (9, 11 сынып оқушылары)
Мен мамандық әлеміндемін (9, 11 сынып оқушылары) Развитие науки и техники
Развитие науки и техники Федеральный государственный образовательный стандарт обучающихся с ограниченными возможностями здоровья
Федеральный государственный образовательный стандарт обучающихся с ограниченными возможностями здоровья Агрохолдинг Энергомера. Работа и обучение
Агрохолдинг Энергомера. Работа и обучение Проектная деятельность в образовании
Проектная деятельность в образовании Наука в современном обществе
Наука в современном обществе Аттестационная работа. Театр как форма проектной деятельности для развития творческих способностей детей с ОВЗ
Аттестационная работа. Театр как форма проектной деятельности для развития творческих способностей детей с ОВЗ Защита ВКР. Практики
Защита ВКР. Практики Правила составления реферата. Форма
Правила составления реферата. Форма Институт информатики, электроники и робототехники КБГУ. Кафедра компьютерных технологий и информационной безопасности (КТИБ)
Институт информатики, электроники и робототехники КБГУ. Кафедра компьютерных технологий и информационной безопасности (КТИБ) Курс изучения немецкого языка
Курс изучения немецкого языка Научное познание
Научное познание Отчет о прохождении исследовательской практики. Кафедра социально-культурного сервиса и туризма
Отчет о прохождении исследовательской практики. Кафедра социально-культурного сервиса и туризма Представление о себе и проблема выбора профессии
Представление о себе и проблема выбора профессии Развитие критического мышления при обучении. Активные и интерактивные технологии обучения в СПО
Развитие критического мышления при обучении. Активные и интерактивные технологии обучения в СПО Державна освітня політика Німеччини
Державна освітня політика Німеччини Аттестационная работа. Программа формирования исследовательских умений у младших школьников
Аттестационная работа. Программа формирования исследовательских умений у младших школьников Аттестационная работа. Жанр эссе. Проектная и исследовательская деятельность учащихся
Аттестационная работа. Жанр эссе. Проектная и исследовательская деятельность учащихся Аттестационная работа. Проектная деятельность на уроках русского и литературы
Аттестационная работа. Проектная деятельность на уроках русского и литературы Приемная кампания в 1 класс в 2019 году
Приемная кампания в 1 класс в 2019 году Родители Башкортостана за здоровое питание!
Родители Башкортостана за здоровое питание! Международные экзамены по английскому языку
Международные экзамены по английскому языку Национальный чемпионат профессий и предпринимательских идей Карьеры России
Национальный чемпионат профессий и предпринимательских идей Карьеры России Башкирский государственный университет. Личный кабинет. Заходите на сайт
Башкирский государственный университет. Личный кабинет. Заходите на сайт МБОУ Степновская СОШ Родинский район Алтайский край
МБОУ Степновская СОШ Родинский район Алтайский край ЕГЭ. Что обязательно должно быть с собой
ЕГЭ. Что обязательно должно быть с собой Критическое мышление как инструмент исследователя
Критическое мышление как инструмент исследователя