Содержание
- 2. Цель и задачи Цель работы: исследование антиоксидантной способности катехоламинов при окислении ТГФ в водном растворе Задачи
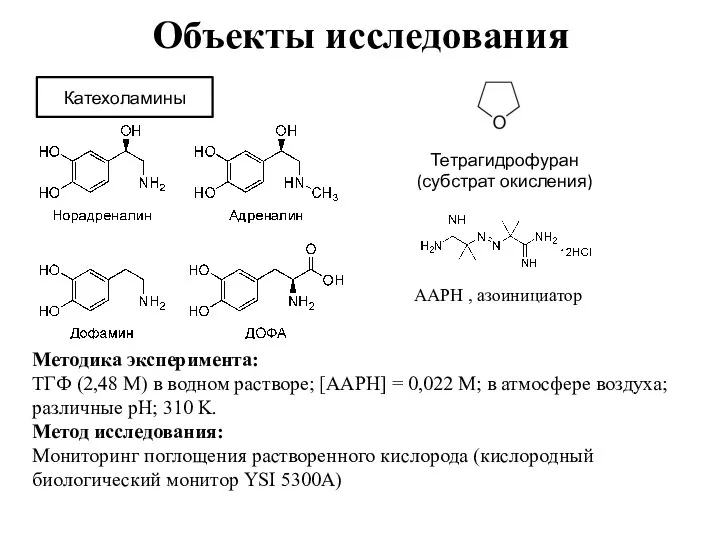
- 3. Объекты исследования Катехоламины AAPH , азоинициатор Тетрагидрофуран (субстрат окисления) Методика эксперимента: ТГФ (2,48 М) в водном
- 4. Механизм радикально-цепного окисления (i) инициирование → L∙ Wi (1) L∙ + O2 → LO2∙ k1 (2)
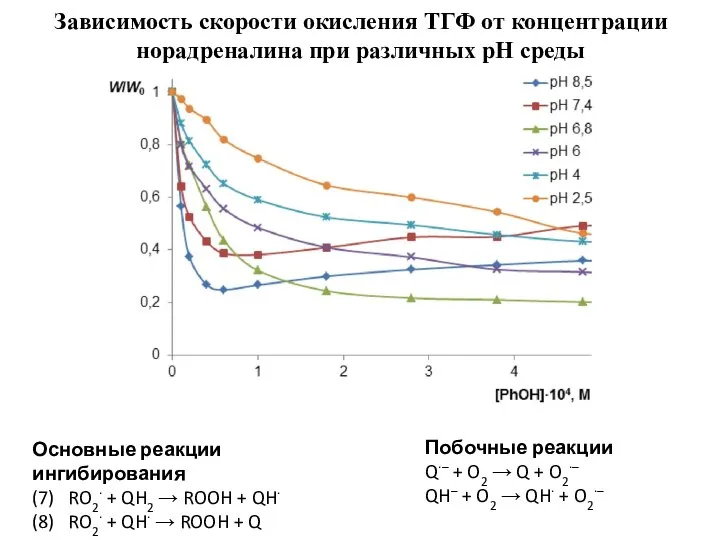
- 5. Зависимость скорости окисления ТГФ от концентрации норадреналина при различных pH среды Основные реакции ингибирования (7) RO2∙
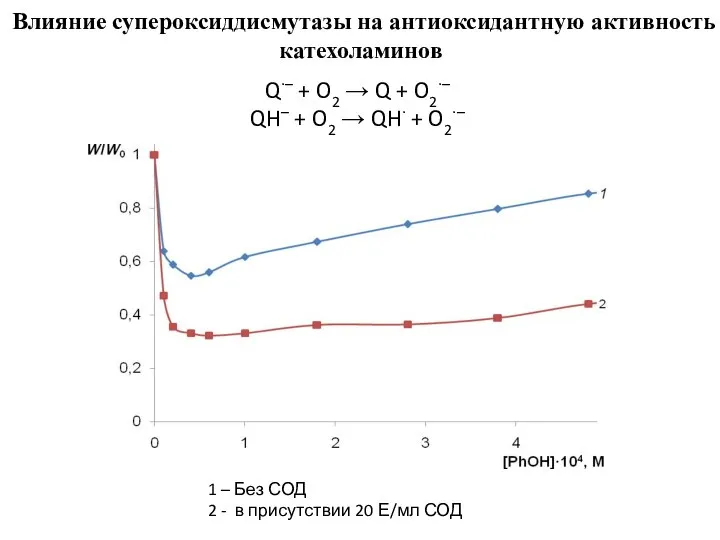
- 6. 1 – Без СОД 2 - в присутствии 20 Е/мл СОД Влияние супероксиддисмутазы на антиоксидантную активность
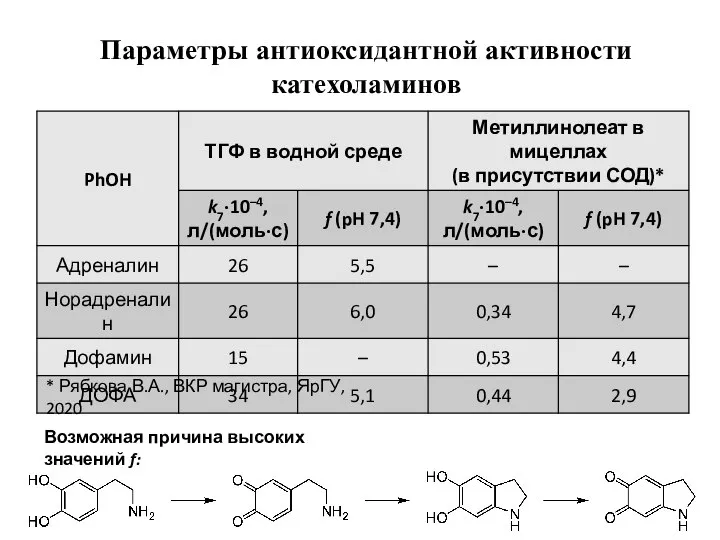
- 7. Параметры антиоксидантной активности катехоламинов Возможная причина высоких значений f: * Рябкова В.А., ВКР магистра, ЯрГУ, 2020
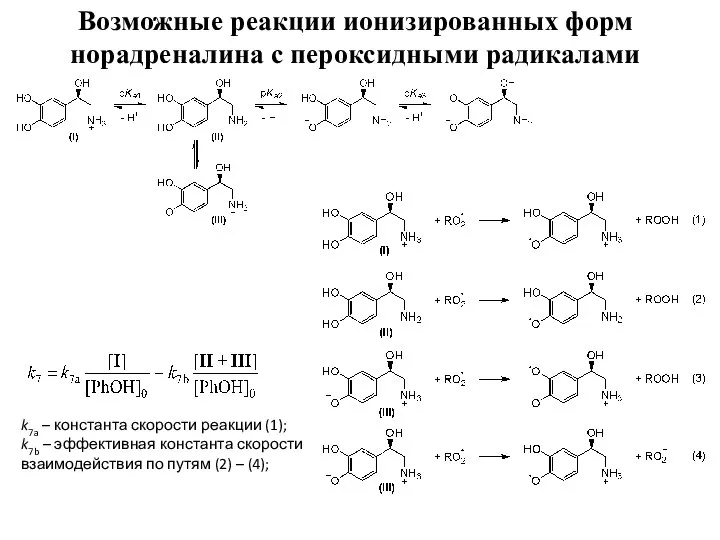
- 8. Возможные реакции ионизированных форм норадреналина с пероксидными радикалами k7a – константа скорости реакции (1); k7b –
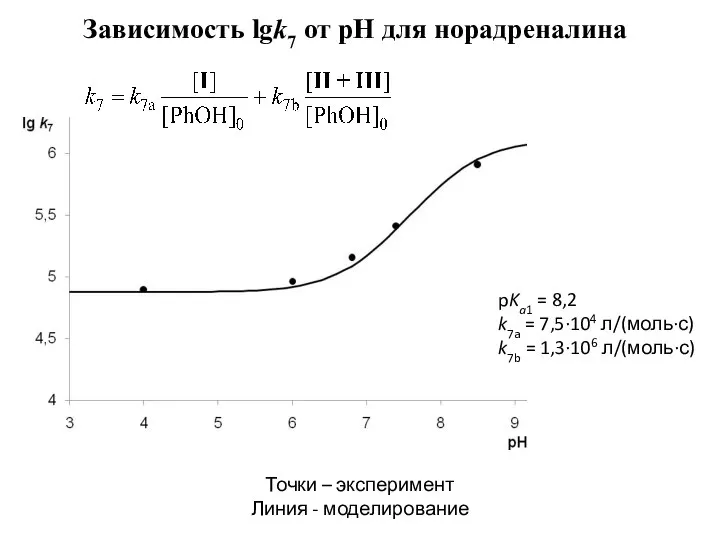
- 9. Зависимость lgk7 от pH для норадреналина Точки – эксперимент Линия - моделирование pKa1 = 8,2 k7a
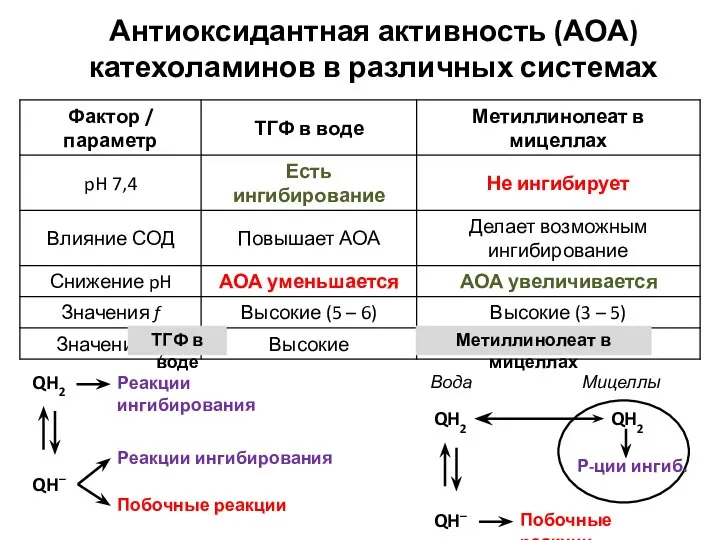
- 10. Антиоксидантная активность (АОА) катехоламинов в различных системах QH2 Р-ции ингиб. Мицеллы Вода QH– QH2 Побочные реакции
- 12. Скачать презентацию


 Автоматическое система регулирования и управления оборудованием
Автоматическое система регулирования и управления оборудованием дети войны
дети войны Составление алгоритма
Составление алгоритма Основная позиция пальцев на клавиатуре
Основная позиция пальцев на клавиатуре Групповое логопедическое занятие на тему: Звук [о], буква О
Групповое логопедическое занятие на тему: Звук [о], буква О Анализ мониторинга простоя локомотивов серии ТЭ10 в/и в СЛД Печора на плановых видах ремонта
Анализ мониторинга простоя локомотивов серии ТЭ10 в/и в СЛД Печора на плановых видах ремонта МИД И NB11 (1)
МИД И NB11 (1) Is a suspension railway in Wuppertal, Germany
Is a suspension railway in Wuppertal, Germany Динамические временные, векторные и спектральные модели сигналов в инфотелекоммуникации (лекция № 2)
Динамические временные, векторные и спектральные модели сигналов в инфотелекоммуникации (лекция № 2) Итоговое
Итоговое LSP: Liskov Substitution Principle
LSP: Liskov Substitution Principle Оборудование штанговых насосных скважин. (Лекция 7)
Оборудование штанговых насосных скважин. (Лекция 7) SKA X¦ш¦¦_PAUK
SKA X¦ш¦¦_PAUK Христианство. Ислам
Христианство. Ислам les_6
les_6 Кооперация и альтруизм
Кооперация и альтруизм Чудеса Иисуса Христа
Чудеса Иисуса Христа Презентация1ЕК
Презентация1ЕК Городское поселение Ржавки Солнечногорского муниципального района Московской области
Городское поселение Ржавки Солнечногорского муниципального района Московской области Интеграция содержания общеобразовательных учебных предметов с дисциплинами общепрофессионального цикла
Интеграция содержания общеобразовательных учебных предметов с дисциплинами общепрофессионального цикла Николай Сиротинин
Николай Сиротинин Организация и планирование проектной деятельности
Организация и планирование проектной деятельности Разработка модели женского летнего платья в системе автоматизированного проектирования швейных изделий
Разработка модели женского летнего платья в системе автоматизированного проектирования швейных изделий 20121217_deti_i_roditeli
20121217_deti_i_roditeli англ азб в стихах
англ азб в стихах Методики расчёта инсоляции
Методики расчёта инсоляции історія хімічних знань
історія хімічних знань Реконструкция макета Нейтральная вставка
Реконструкция макета Нейтральная вставка