Содержание
- 2. Люминесценция – свечение атомов, молекул, ионов и других более сложных комплексов, возникающее в результате электронного перехода
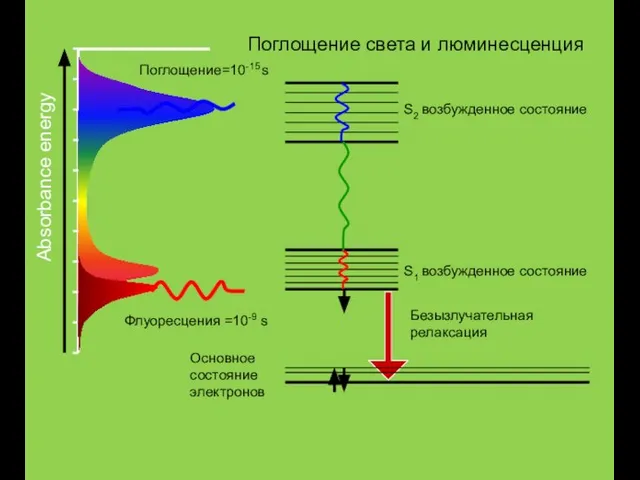
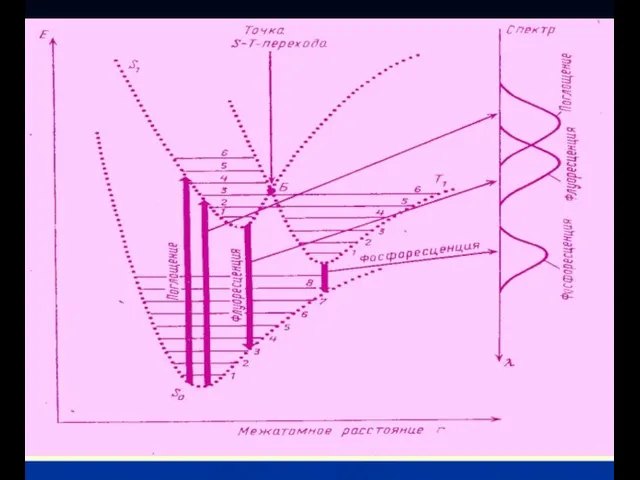
- 3. Основное состояние электронов S1 возбужденное состояние S2 возбужденное состояние Absorbance energy Флуоресцения =10-9 s Поглощение=10-15 s
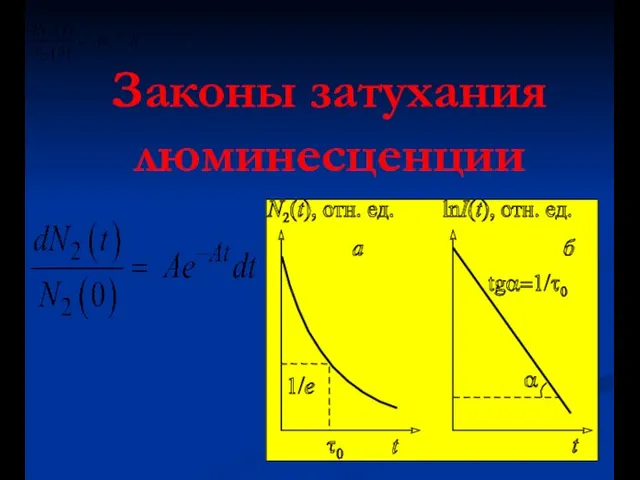
- 4. Законы затухания люминесценции
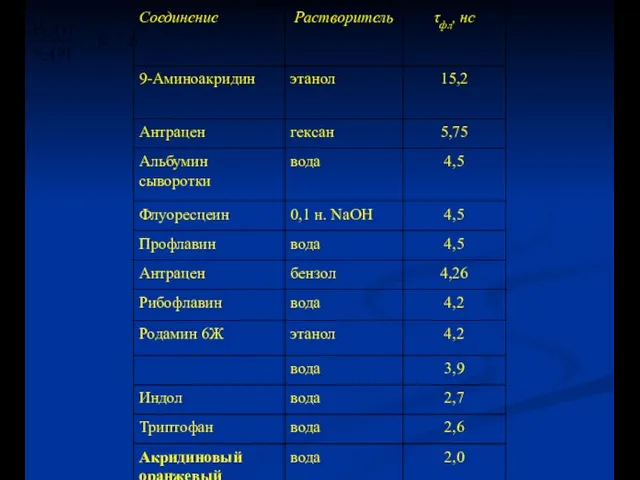
- 5. Законы затухания люминесценции
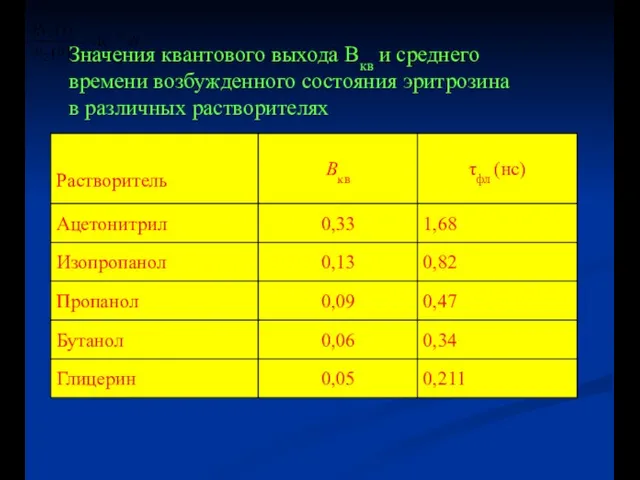
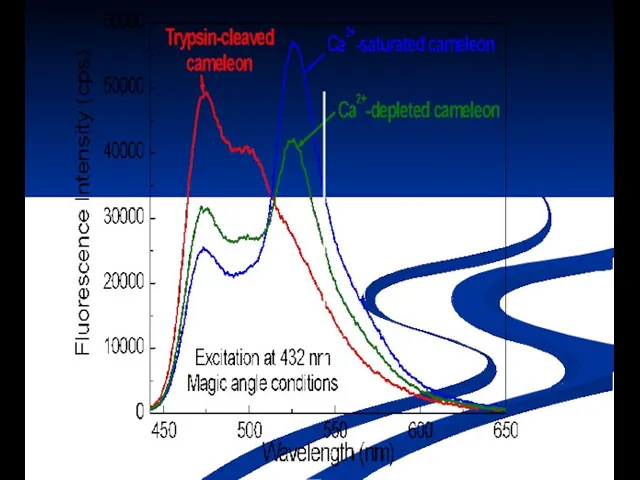
- 7. Значения квантового выхода Вкв и среднего времени возбужденного состояния эритрозина в различных растворителях
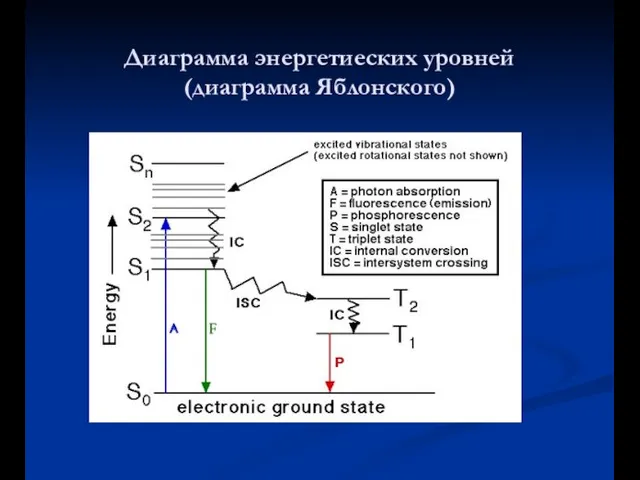
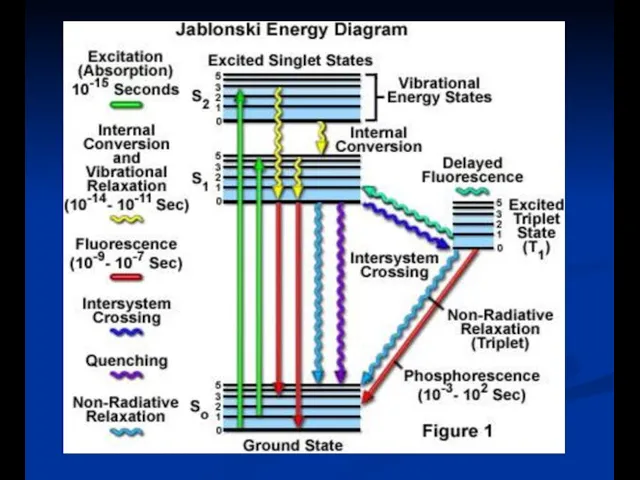
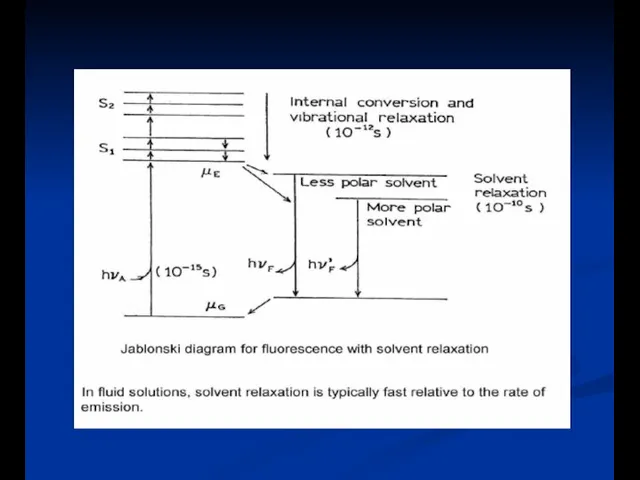
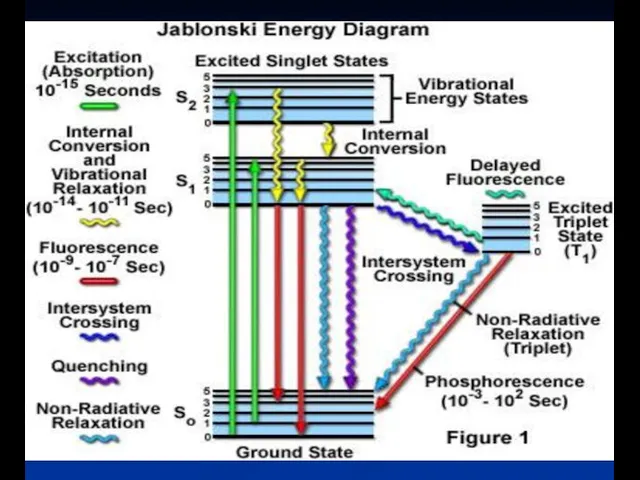
- 8. Диаграмма энергетиеских уровней (диаграмма Яблонского)
- 9. Фосфоресценция .Внутренняя и интекомбинационная конверсия Длительные процессы свечения
- 10. Фосфоресценция
- 13. kF = излучение(S1 → S0) kic = внутренняя конверсия (S1 → S0) kisc = интеркомбинационная конверсия
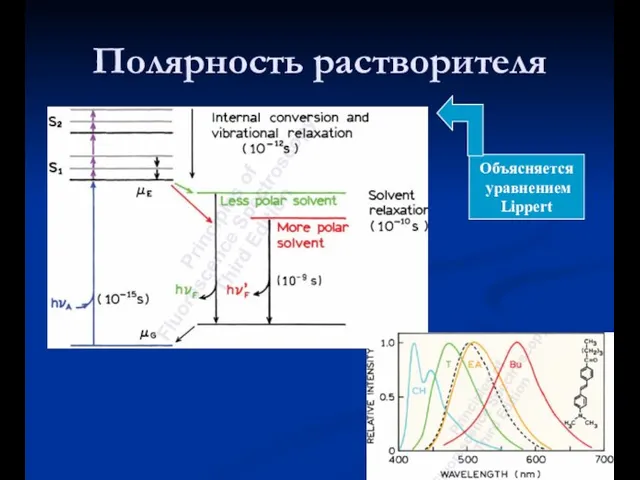
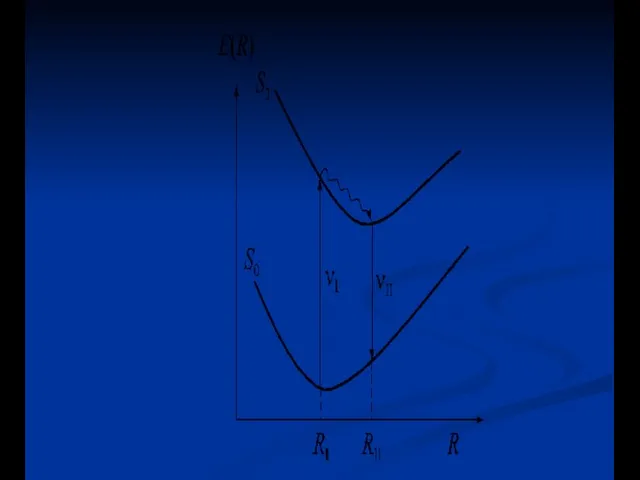
- 14. a) Колебательная релаксация: столкновение растворителя - λ излучения > λ возбуждения (Стоксов сдвиг) - колебательная релаксация
- 15. d) Интеркомбинационные переходы: -Спин электрона «переворачивается» - Изменение мультиплетности в молекуле (синглет на триплет) - увеличиваются,
- 16. Влияние внутри и межмолекулярных взаимодействий на люминесценцию
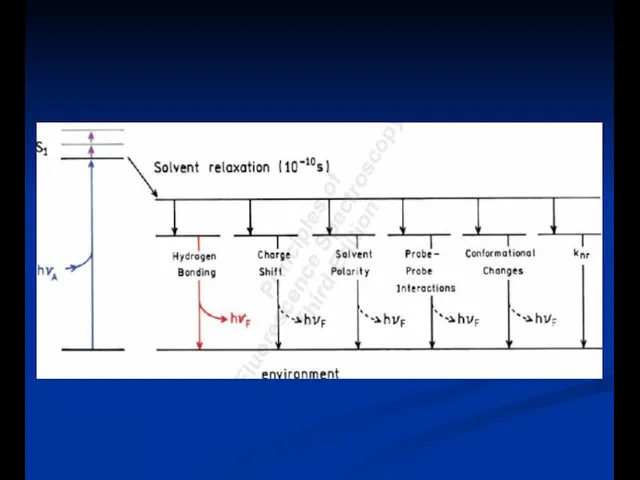
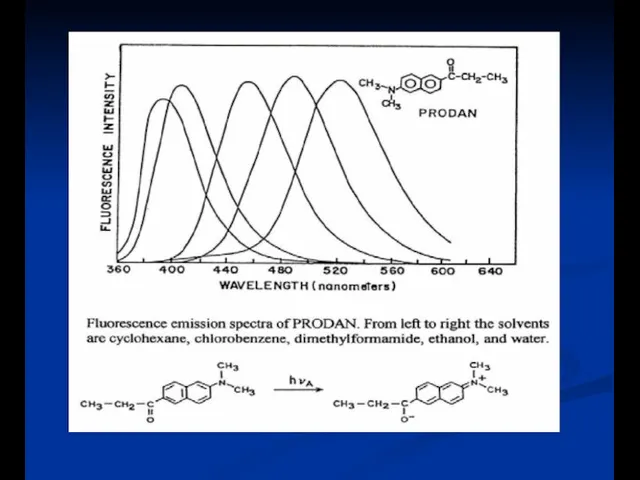
- 17. Эффекты растворителя и окружающей среды на спектры флуоресценции Скорость релаксации растворителя Полярность и вязкость растворителя Конформационные
- 19. Молекулярные процессы в конденсированной фазе Диффузия Релаксация Сольватация Перенос заряда (электрон и протон) Растворитель: активный участник
- 22. Полярность растворителя
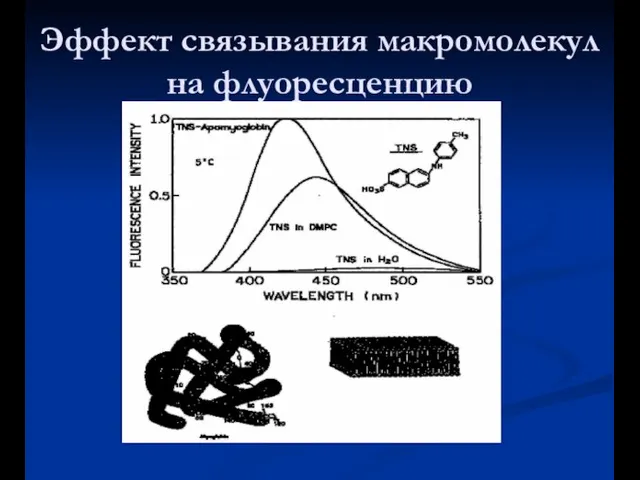
- 23. Эффект связывания макромолекул на флуоресценцию
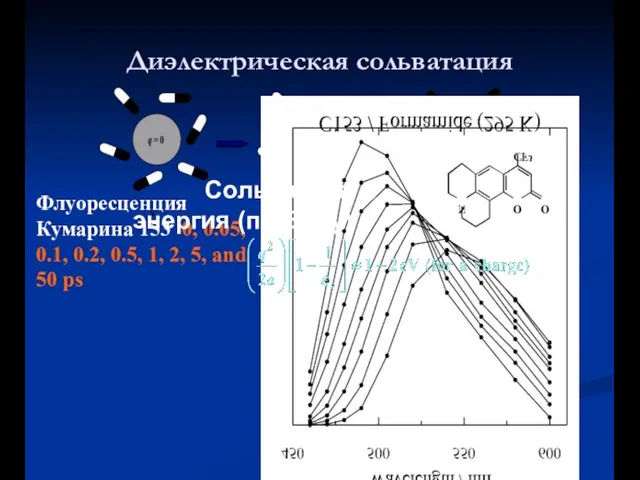
- 25. Диэлектрическая сольватация Флуоресценция Кумарина 153 0, 0.05, 0.1, 0.2, 0.5, 1, 2, 5, and 50 ps
- 26. Ориентационные Индукционные Дисперсионные где r – расстояние между молекулами активатора и растворителя, α − поляризуемость молекул
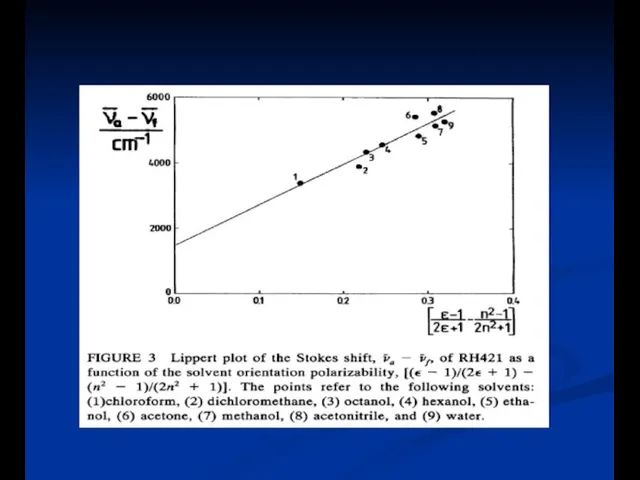
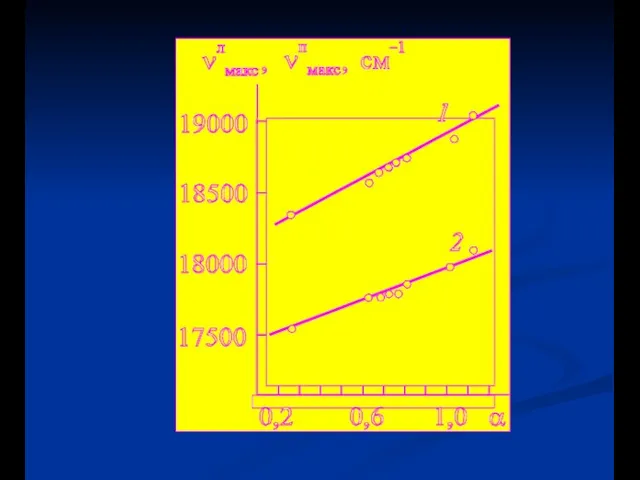
- 27. Полярность растворителя Объясняется уравнением Lippert
- 28. Уравнение Lipperta Ориентационная поляризуемость Энергия диполя в электрическом поле R- электрическое поле (реактивное) индуцированное диполем f-
- 29. Поляризуемость растворителя: подвижность электронов растворителя и дипольного моменте молекул растворителя Высокочастотная поляризуемость - перераспределения электронов растворителя
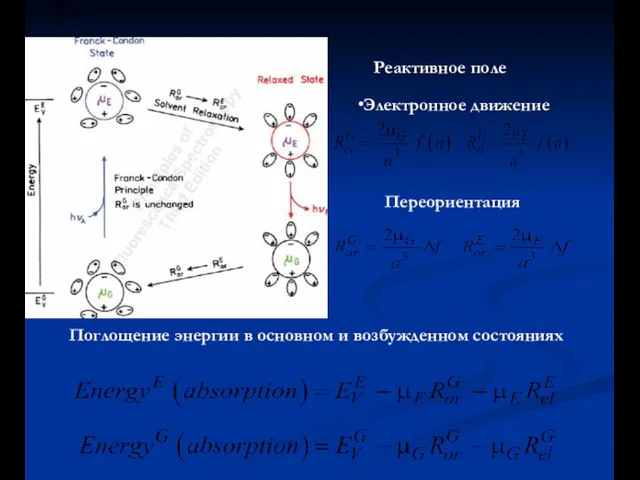
- 30. Реактивное поле Электронное движение Переориентация Поглощение энергии в основном и возбужденном состояниях
- 31. Энергия поглощения Энергии двух уровней для излучения Энергия излучения
- 32. Уравнение Липперта
- 34. Специфические взаимодействия
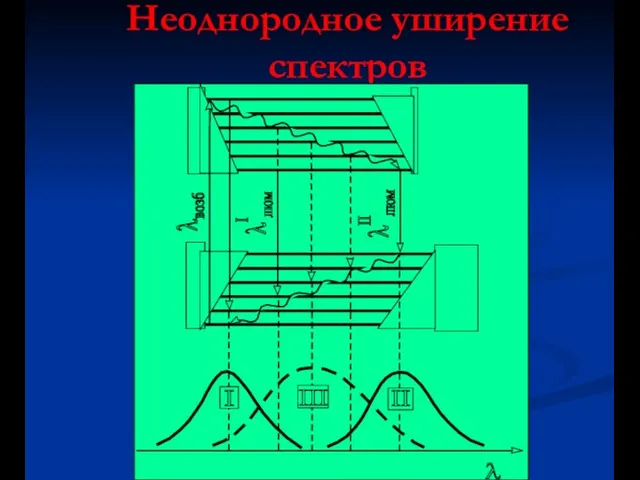
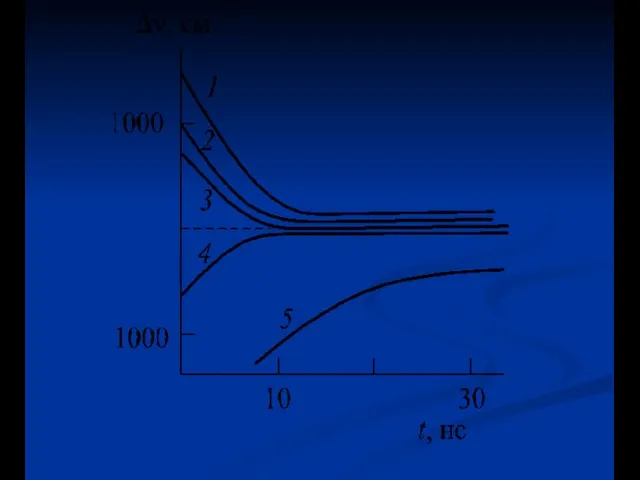
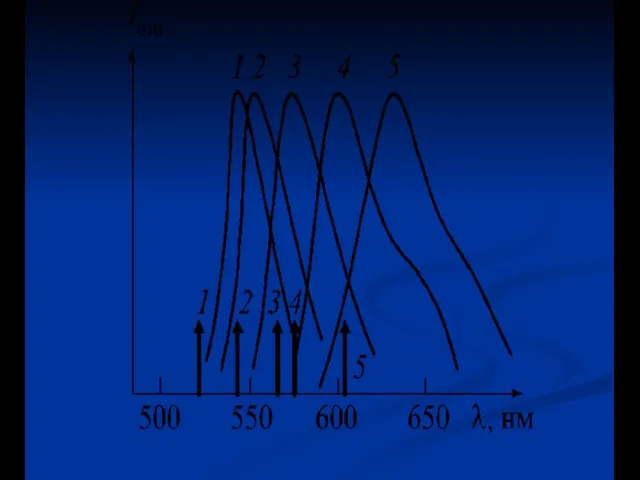
- 36. Неоднородное уширение спектров
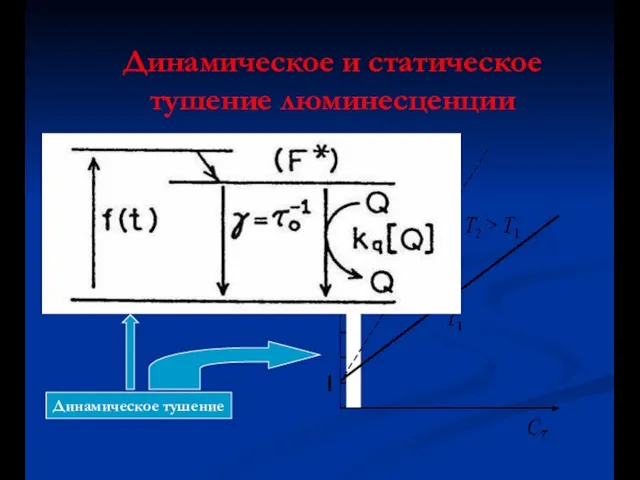
- 40. Динамическое и статическое тушение люминесценции Динамическое тушение
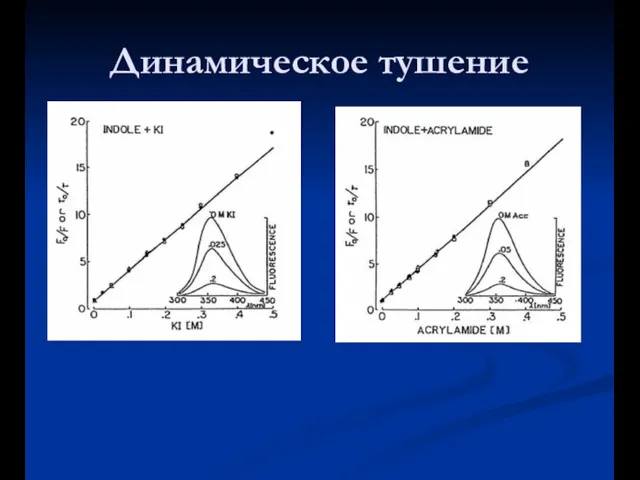
- 41. Динамическое тушение
- 42. Динамическое и статическое тушение люминесценции Статическое тушение
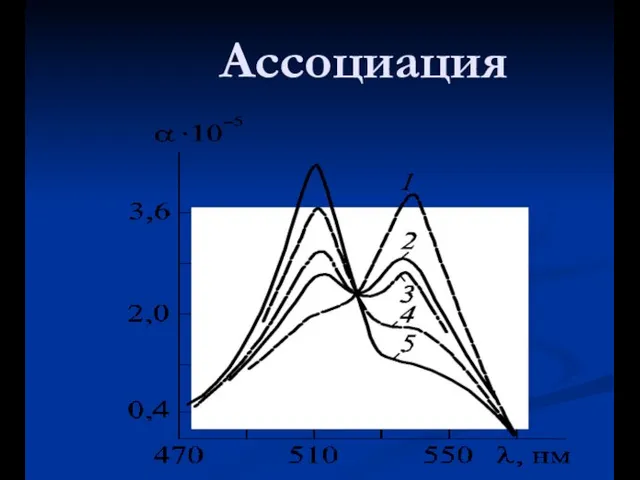
- 43. Ассоциация
- 44. Сравнение динамического и статического тушения Для динамического и статического тушения флуоресценции наблюдается одинаковая зависимость от концентрации
- 45. Флуоресценция Молекулы могут излучать свет большей длны волны, чем длина волны возбуждающего света D + hv
- 46. Квантовый выход Q Отношение числа фотонов излучающих к числу фотонов поглощенных Время жизни Среднее время между
- 47. ПРОЦЕССЫ ПЕРЕНОСА ЭНЕРГИИ ЭЛЕКТРОННОГО ВОЗБУЖДЕНИЯ
- 49. Флуоресценция Молекулы могут излучать свет большей длны волны, чем длина волны возбуждающего света D + hv
- 50. Квантовый выход Q Отношение числа фотонов излучающих к числу фотонов поглощенных Время жизни Среднее время между
- 51. Донор Акцептор(ы)
- 52. ПЭЭВ
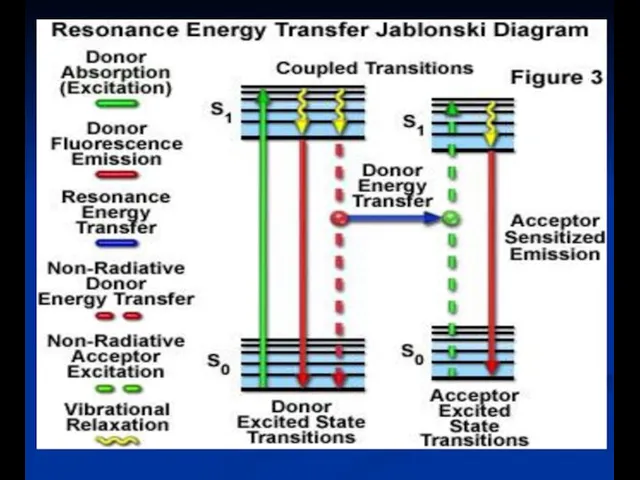
- 53. НАЗВАНИЕ? Флуоресцентный резонансный перенос энергии или Ферстеровский резонансный перенос энергии E (FRET -ПЭЭВ) ?? is it
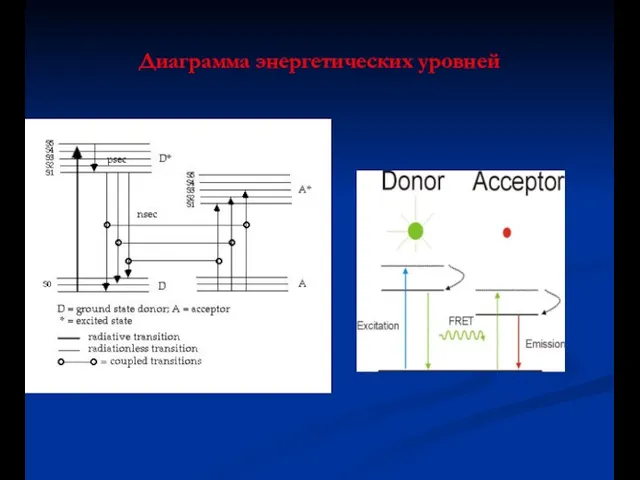
- 54. Диаграмма энергетических уровней
- 55. Реакционная схема D- донор A- акцептор hv e,d,f – энергия фотона для процессов K di,ai –
- 56. Квантовый выход донора в присутствии акцептора Q Квантовый выход донора Q в присуствии (Qda) и отсутствии
- 57. Эффективность ПЭЭВ E где Измерение интенсивности флуоресценции донора с акцептором (Qda) и без него (Qd). Используя
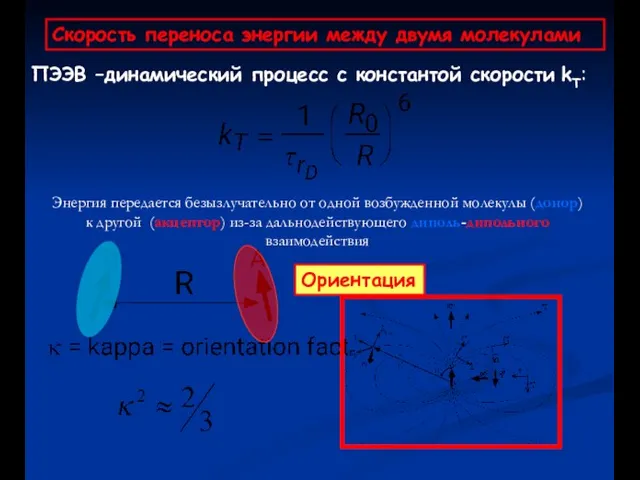
- 58. ПЭЭВ –динамический процесс с константой скорости kT: Энергия передается безызлучательно от одной возбужденной молекулы (донор) к
- 59. Fritz London Van der Waals interaction Quantum Theory: London, 1930; London, 1937 2nd order perturbation theory
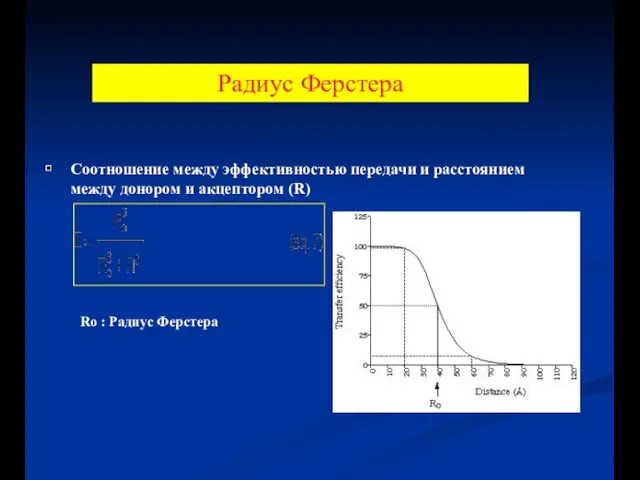
- 60. Радиус Ферстера Соотношение между эффективностью передачи и расстоянием между донором и акцептором (R) Ro : Радиус
- 61. Ro может быть вычислен Qd : квантовый выход донора, n : коэффициент преломления среды Nav :
- 63. Eффективность переноса между двумя молекулами
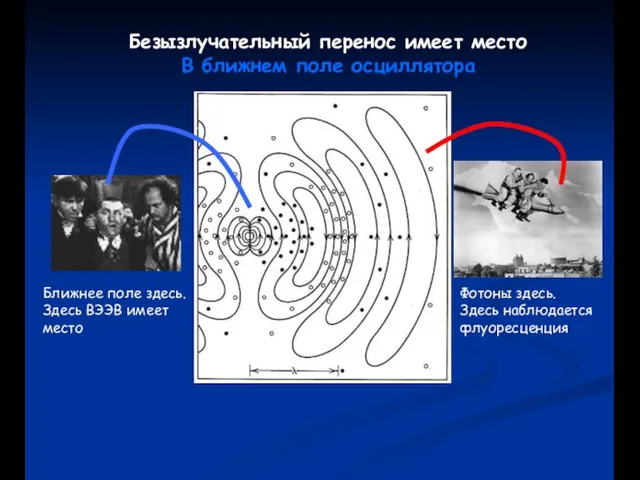
- 64. Безызлучательный перенос имеет место В ближнем поле осциллятора Ближнее поле здесь. Здесь ВЭЭВ имеет место Фотоны
- 65. • Энергия взаимодейстия, , между двумя идентичными диполями is (|ближнее поле осциллирующего диполя| = поле неподвижного
- 66. Ориентационный фактор:
- 68. Скачать презентацию



































 Логические элементы
Логические элементы Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Механические колебания и волны. Звук
Механические колебания и волны. Звук 20160728_chehov
20160728_chehov Новая презентация.pptx
Новая презентация.pptx Графен: анализ свойств и перспективы применения
Графен: анализ свойств и перспективы применения Стилизация
Стилизация Виды и степени негабаритности
Виды и степени негабаритности Привычка пить чай тоже может быть опасной
Привычка пить чай тоже может быть опасной Николай II 2 часть
Николай II 2 часть Муравьиная и уксусная кислоты – важнейшие представители предельных одноосновных карбоновых кислот
Муравьиная и уксусная кислоты – важнейшие представители предельных одноосновных карбоновых кислот Возможность применения реактора микросмешивания для интенсификации биологической очистки сточных вод
Возможность применения реактора микросмешивания для интенсификации биологической очистки сточных вод 20120321_formir_nav_chteniya_molodyh_o._v
20120321_formir_nav_chteniya_molodyh_o._v Анализ материальных ресурсов организации ООО МЕТРО Кэш энд Керри
Анализ материальных ресурсов организации ООО МЕТРО Кэш энд Керри 20130723_prezentaciya_mir_v_nachale_xx_veka
20130723_prezentaciya_mir_v_nachale_xx_veka Звук Э
Звук Э 20130805_1812
20130805_1812 Мое любимое животное
Мое любимое животное Синхронные триггеры
Синхронные триггеры Путешествие к родной земле
Путешествие к родной земле Вегера Віта
Вегера Віта Электронный ограничитель скорости Pedal Interface II
Электронный ограничитель скорости Pedal Interface II Пришивание крючков и петель
Пришивание крючков и петель 20180305_svoya_igra_drevniy_mir
20180305_svoya_igra_drevniy_mir Получение и передача переменного электрического тока. Трансформатор
Получение и передача переменного электрического тока. Трансформатор Точное земледелие. Гидравлический автопилот. Схема монтажа
Точное земледелие. Гидравлический автопилот. Схема монтажа Ускоренные испытания РЭА
Ускоренные испытания РЭА Плавление и перенос электродного материала
Плавление и перенос электродного материала