Содержание
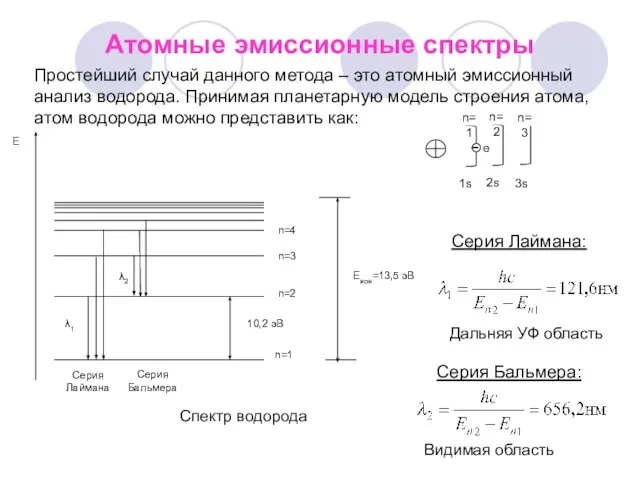
- 2. Атомные эмиссионные спектры Дальняя УФ область Видимая область Серия Лаймана: Серия Бальмера: Простейший случай данного метода
- 3. Длины волн имеют дискретный характер и подчиняются распределению Бальмера-Ридберга : nj , ni – уровень, с
- 4. Модель Бора о совместном движении атомного ядра и электронной оболочки относительно неподвижного общего центра тяжести всей
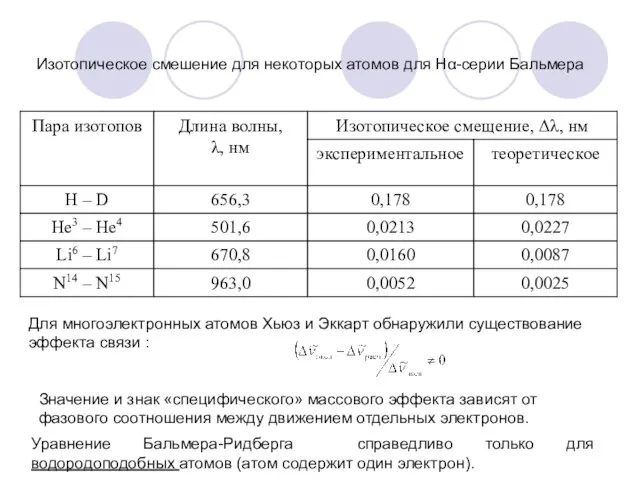
- 5. Относительное изотопическое смещение линий водорода : Изотопическое смещение для пары протий-дейтерий равно: для Нα-линии серии Бальмера
- 6. Изотопическое смешение для некоторых атомов для Нα-серии Бальмера Для многоэлектронных атомов Хьюз и Эккарт обнаружили существование
- 7. Необходимая разрешающая способность в спектральных методах рассчитывается по формуле: Разрешающая способность приборов с дифракционной решеткой: где
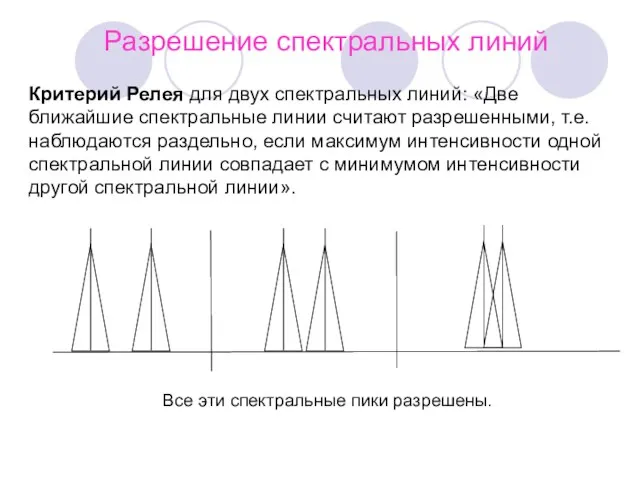
- 8. Разрешение спектральных линий Критерий Релея для двух спектральных линий: «Две ближайшие спектральные линии считают разрешенными, т.е.
- 9. Применение атомной спектроскопии для анализа ОЧВ С помощью атомной эмиссионной спектроскопии можно определять до 70 элементов.
- 10. Атомный абсорбционный анализ В этом методе свет от дискретного источника излучения, проходя через атомный пар вещества,
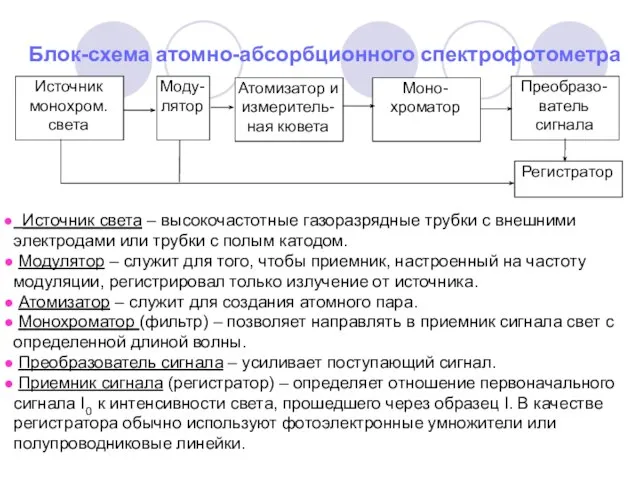
- 11. Блок-схема атомно-абсорбционного спектрофотометра Источник света – высокочастотные газоразрядные трубки с внешними электродами или трубки с полым
- 12. Преимущество атомно-абсорбционного метода для изотопного анализа состоит в том, что не нужен спектральный прибор с высокой
- 13. Молекулярная спектроскопия Молекулярные спектры не применяются для анализа веществ ОСЧ. Методы молекулярного спектрального анализа широко используются
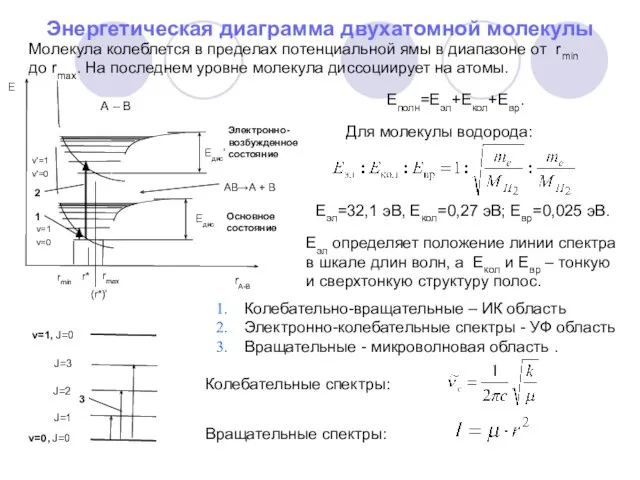
- 14. Еполн=Еэл+Екол+Евр. Для молекулы водорода: Еэл=32,1 эВ, Екол=0,27 эВ; Евр=0,025 эВ. Еэл определяет положение линии спектра в
- 15. Вращательные спектры Изотопическое смещение обусловлено тем, что вращательный момент молекулы зависит от ее приведенной массы: Для
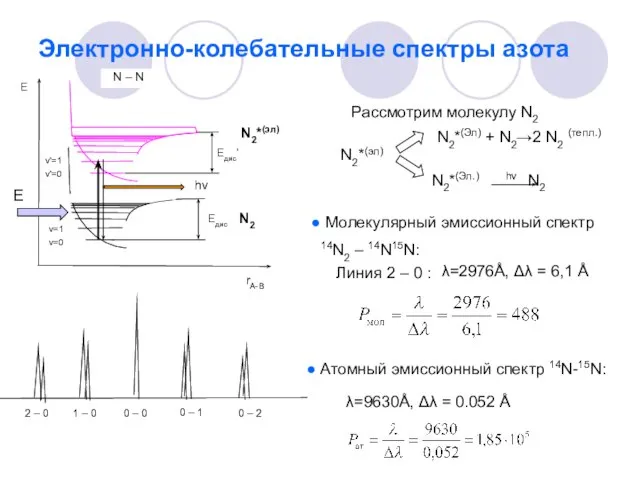
- 16. Электронно-колебательные спектры азота N – N Рассмотрим молекулу N2 N2*(эл) N2*(Эл) + N2→2 N2 (тепл.) Молекулярный
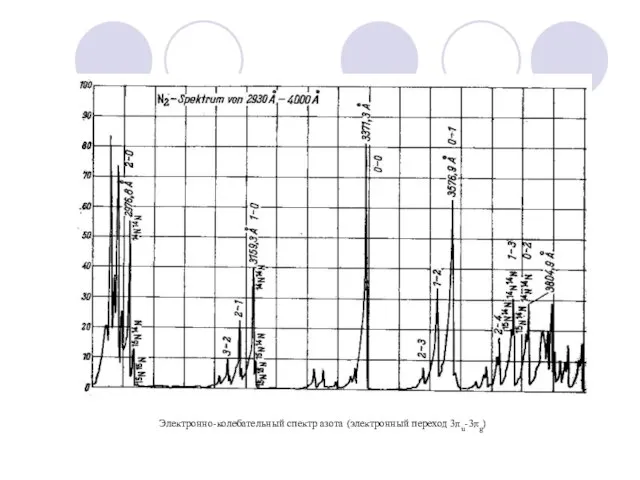
- 17. Электронно-колебательный спектр азота (электронный переход 3πu-3πg)
- 19. Колебательная спектроскопия для определения изотопного состава воды Колебательная спектроскопия ≡ ИК-спектроскопия. ИК-спектроскопия используется обычно в абсорбционном
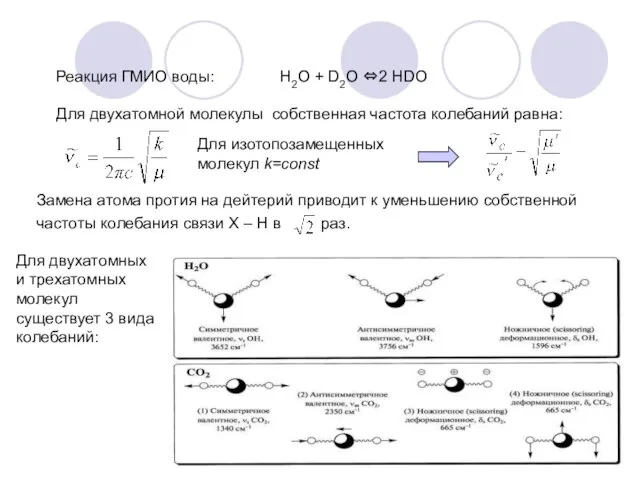
- 20. Реакция ГМИО воды: Н2О + D2O ⇔2 НDO Для двухатомной молекулы собственная частота колебаний равна: Для
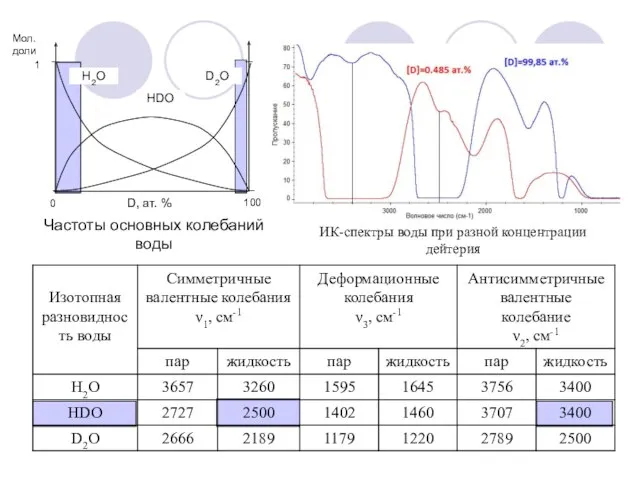
- 21. Частоты основных колебаний воды ИК-спектры воды при разной концентрации дейтерия
- 22. Область малых концентраций дейтерия (до 5 ат.%). [D2O] → 0. Аналитическая форма – HDO. Область высоких
- 23. Область средних концентраций (5 – 15 ат. %) Присутствуют 3 изотопные формы: H2O, HDO, D2O. Снимают
- 24. Определение дейтерия в широкой области концентраций на ИК-Фурье спектрометре Thermo Scientific Nicolet iS10 Разборная кювета Неразборная
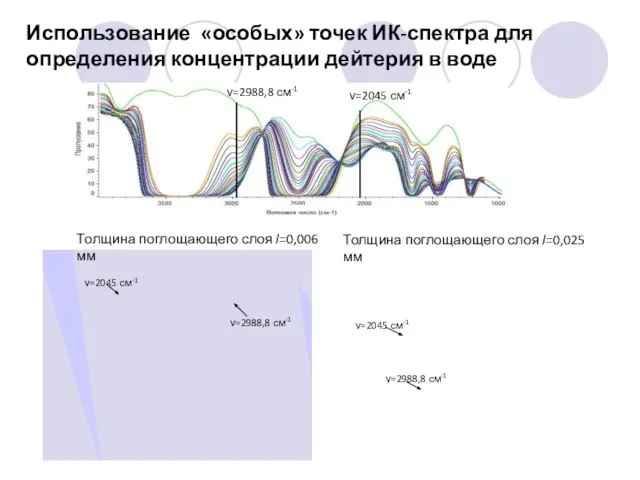
- 25. Использование «особых» точек ИК-спектра для определения концентрации дейтерия в воде
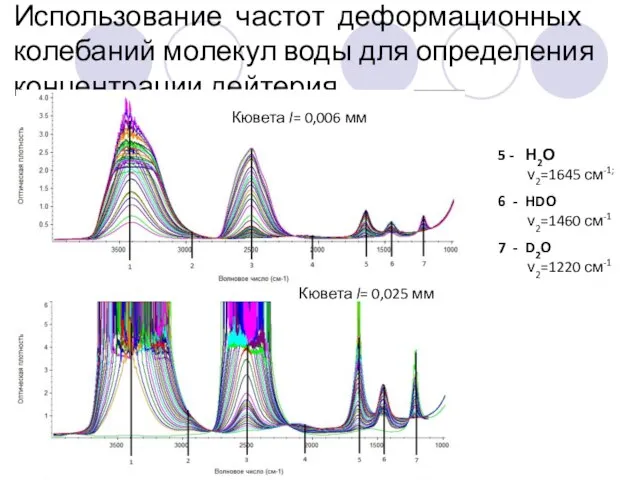
- 27. Зависимость оптической плотности для линий поглощения, соответствующих деформационным колебаниям молекул воды, от концентрации дейтерия
- 29. Скачать презентацию










![Область малых концентраций дейтерия (до 5 ат.%). [D2O] → 0. Аналитическая](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/593773/slide-21.jpg)



 Спряжение глагола
Спряжение глагола Работа выпрямителей на нагрузку различного характера
Работа выпрямителей на нагрузку различного характера Однокаскадные усилители на полевых транзисторах
Однокаскадные усилители на полевых транзисторах 20140514_uchastie_zhiteley_komi_kraya_v_pervoy_mirovoy_voyne
20140514_uchastie_zhiteley_komi_kraya_v_pervoy_mirovoy_voyne Градостроительство и типы планировочной структуры городов
Градостроительство и типы планировочной структуры городов Химические волокна
Химические волокна Станки с ЧПУ. Основные определения
Станки с ЧПУ. Основные определения Мир технических чудес
Мир технических чудес аккуратность
аккуратность Инструменты для обработки отверстий. Часть 1
Инструменты для обработки отверстий. Часть 1 Автоматизация объектов дожимной насосной станции
Автоматизация объектов дожимной насосной станции 17
17 Религиозный туризм на Восточном побережье
Религиозный туризм на Восточном побережье Создание аксессуаров с использованием лоскутных техник
Создание аксессуаров с использованием лоскутных техник Синтез систем автоматического управления
Синтез систем автоматического управления 20130315_lit.napr_._
20130315_lit.napr_._ Зарождение науки, искусства и религиозных верований
Зарождение науки, искусства и религиозных верований влево вправо
влево вправо Подготовка диких животных к зиме
Подготовка диких животных к зиме Vulval and vaginal pathological conditions
Vulval and vaginal pathological conditions Богословие. Сотериология. Учение о спасении
Богословие. Сотериология. Учение о спасении План ботанический экспедиции в Сосновский лесопарк
План ботанический экспедиции в Сосновский лесопарк Неструев Макар 1в_научная работа_роботы
Неструев Макар 1в_научная работа_роботы Инструкция по сигнализации на железнодорожном транспорте
Инструкция по сигнализации на железнодорожном транспорте Роль религии в жизни общества
Роль религии в жизни общества Emo
Emo e50652094ed46e06c6ee04a7c8110c5a
e50652094ed46e06c6ee04a7c8110c5a 제3과 일상생활. Корейский язык
제3과 일상생활. Корейский язык