Содержание
- 2. Федеральный закон 323-ФЗ от 21.11.2011 «Об основах охраны здоровья граждан в Российской Федерации» Определение медицинского изделия
- 3. Классификация медицинских изделий Федеральный закон 323-ФЗ от 21.11.2011 «Об основах охраны здоровья граждан в Российской Федерации»
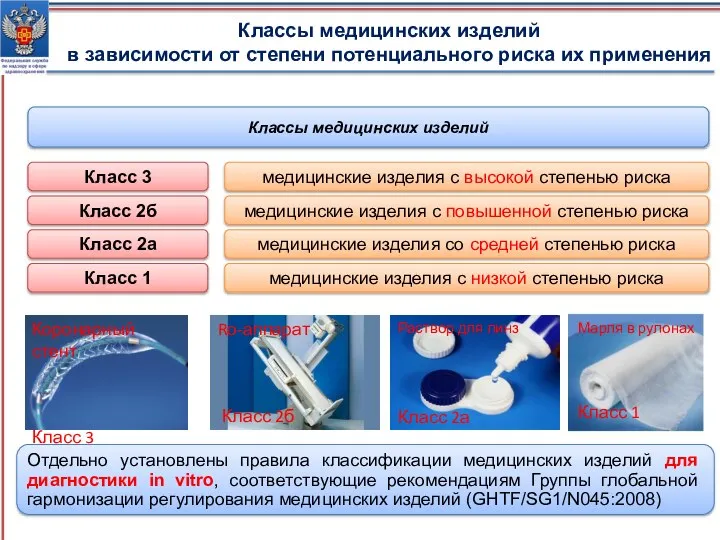
- 4. Классы медицинских изделий в зависимости от степени потенциального риска их применения Отдельно установлены правила классификации медицинских
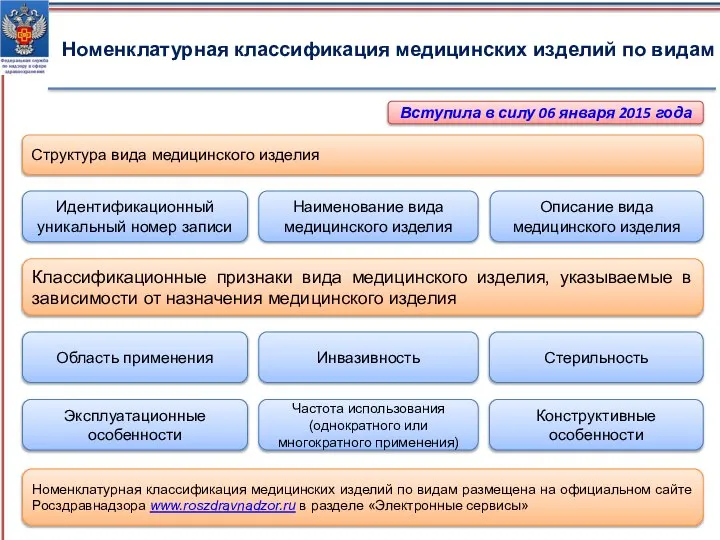
- 5. Номенклатурная классификация медицинских изделий по видам Классификационные признаки вида медицинского изделия, указываемые в зависимости от назначения
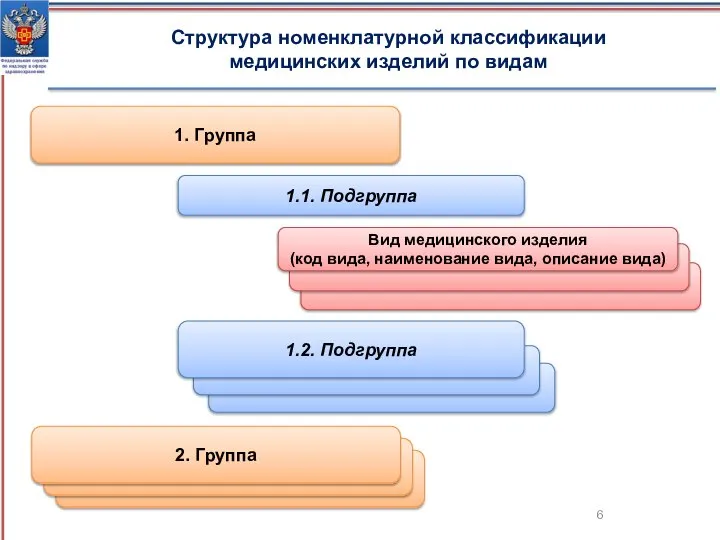
- 6. 2. Группа 2. Группа Структура номенклатурной классификации медицинских изделий по видам 1. Группа 1.1. Подгруппа 1.2.
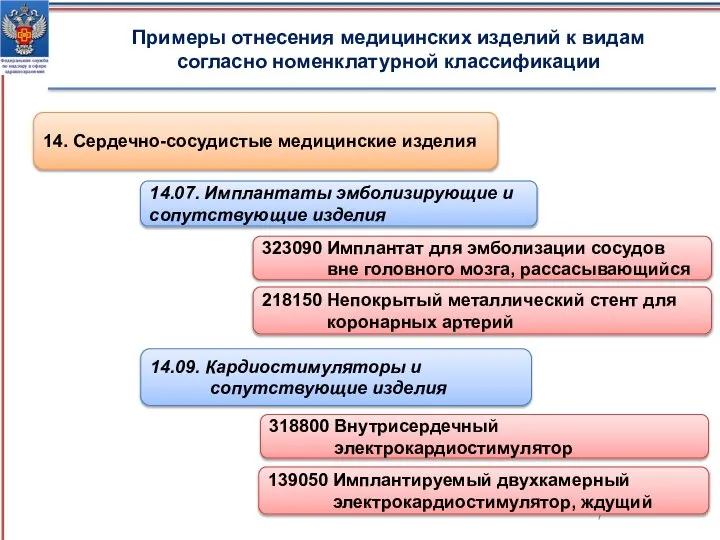
- 7. Примеры отнесения медицинских изделий к видам согласно номенклатурной классификации 14. Сердечно-сосудистые медицинские изделия 14.07. Имплантаты эмболизирующие
- 8. Обращение медицинских изделий Федеральный закон 323-ФЗ от 21.11.2011 «Об основах охраны здоровья граждан в Российской Федерации»
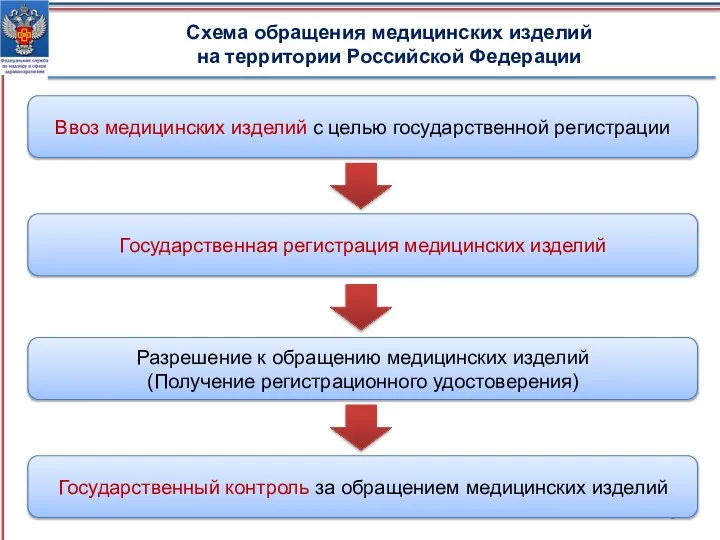
- 9. Схема обращения медицинских изделий на территории Российской Федерации Ввоз медицинских изделий с целью государственной регистрации Государственная
- 10. Постановление Правительства Российской Федерации от 27.12.2012 № 1416 «Об утверждении Правил государственной регистрации медицинских изделий» Законодательные
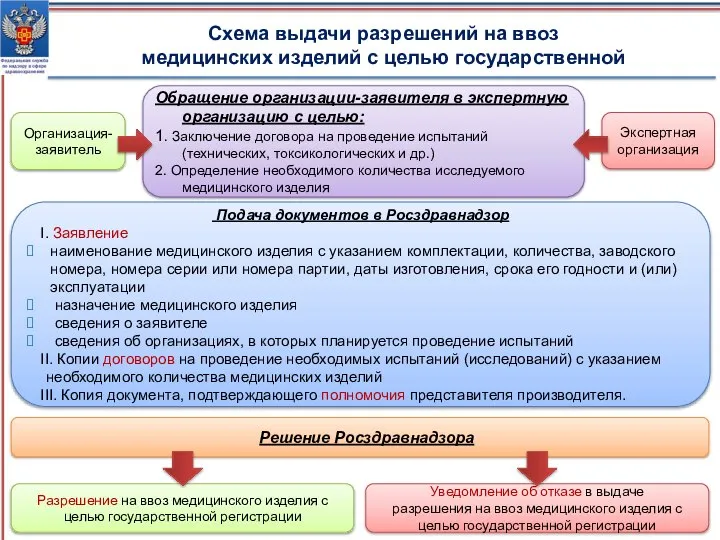
- 11. Организация-заявитель Обращение организации-заявителя в экспертную организацию с целью: 1. Заключение договора на проведение испытаний (технических, токсикологических
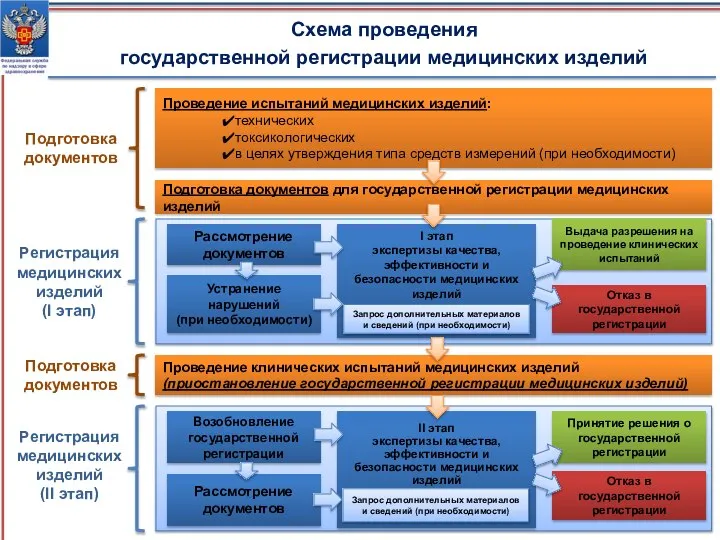
- 12. Схема проведения государственной регистрации медицинских изделий Проведение испытаний медицинских изделий: технических токсикологических в целях утверждения типа
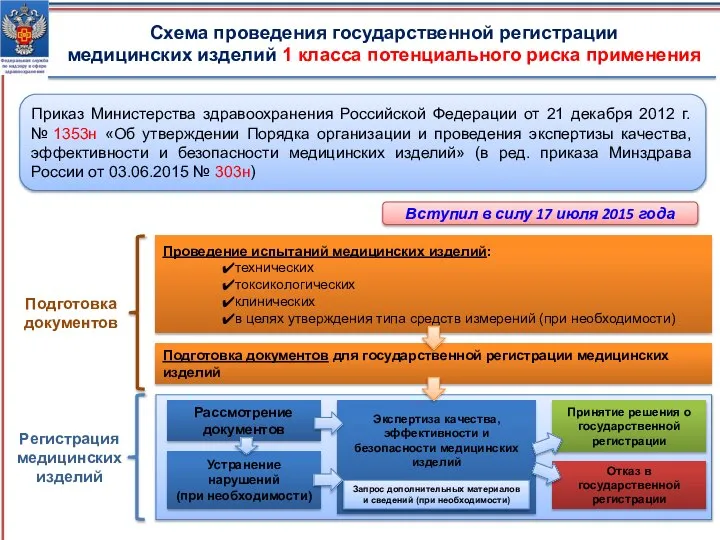
- 13. Схема проведения государственной регистрации медицинских изделий 1 класса потенциального риска применения Проведение испытаний медицинских изделий: технических
- 14. Перечень документов, представляемых для государственной регистрации медицинских изделий Заявление о государственной регистрации медицинского изделия Копия документа,
- 15. Техническая документация на медицинское изделие Постановление Правительства Российской Федерации от 27.12.2012 № 1416 «Об утверждении Правил
- 16. Эксплуатационная документация на медицинское изделие Постановление Правительства Российской Федерации от 27.12.2012 № 1416 «Об утверждении Правил
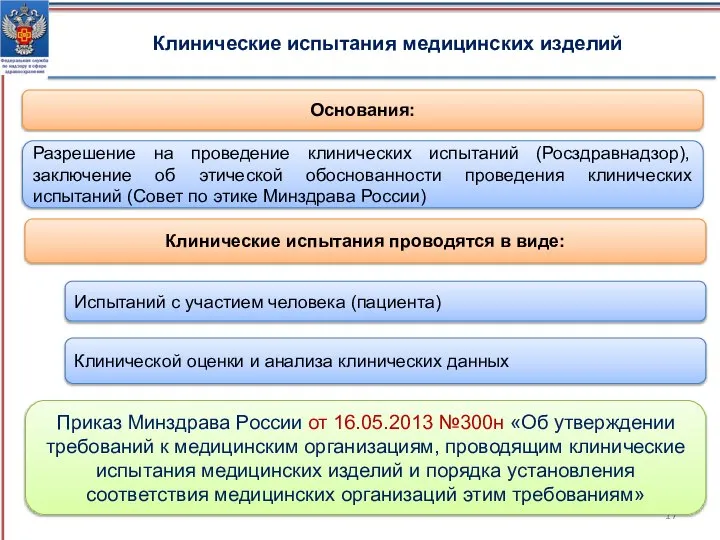
- 17. Приказ Минздрава России от 16.05.2013 №300н «Об утверждении требований к медицинским организациям, проводящим клинические испытания медицинских
- 18. Нормативные правовые акты, регулирующие проведение клинических испытаний в форме исследований Приказ Минздрава России от 9.01.2014 №2н
- 19. Документы, предоставляемые в Росздравнадзор после проведения оценки соответствия медицинского изделия в форме клинических испытаний Акт оценки
- 20. Виды регистрационных удостоверений на медицинское изделие
- 21. Виды регистрационных удостоверений на медицинское изделие
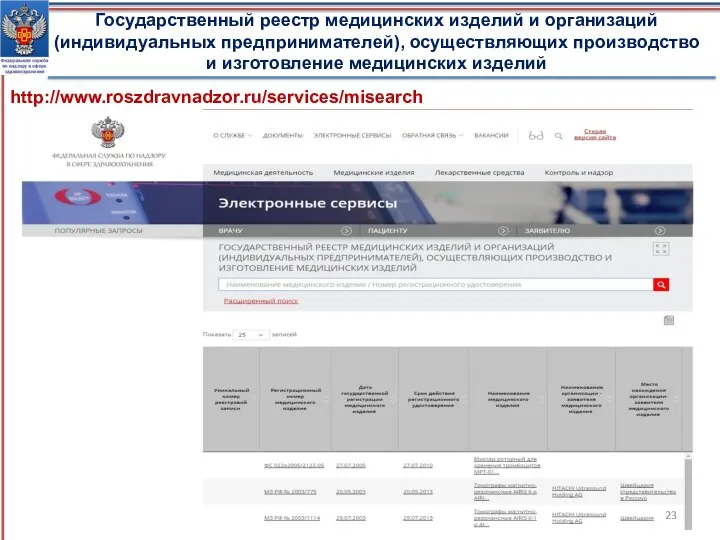
- 22. Государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий (Постановление Правительства
- 23. http://www.roszdravnadzor.ru/services/misearch Государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий
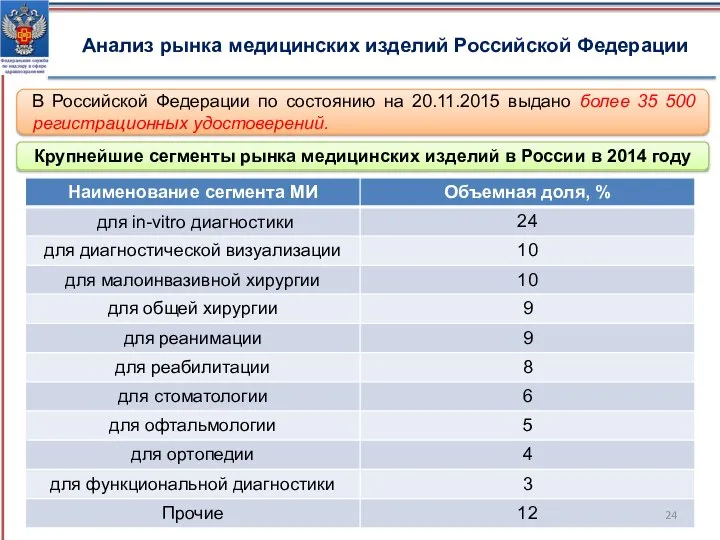
- 24. Анализ рынка медицинских изделий Российской Федерации В Российской Федерации по состоянию на 20.11.2015 выдано более 35
- 25. Внесение изменений в регистрационное удостоверение (пп. 37-39 Постановления Правительства Российской Федерации от 27.12.2012 № 1416 «Об
- 26. Внесение изменений в регистрационную документацию (п. 55 Постановления Правительства Российской Федерации от 27.12.2012 № 1416 «Об
- 27. Дубликат регистрационного удостоверения (п. 52 Постановления Правительства Российской Федерации от 27.12.2012 № 1416 «Об утверждении Правил
- 28. Примеры внесения изменений в регистрационное удостоверение на медицинское изделие
- 29. Примеры внесения изменений в регистрационное удостоверение на медицинское изделие (изменение наименования медицинского изделия)
- 30. Примеры внесения изменений в регистрационное удостоверение на медицинское изделие
- 31. Примеры внесения изменений в регистрационное удостоверение на медицинское изделие (1. изменение сведений о юридическом лице, на
- 32. Примеры внесения изменений в регистрационное удостоверение на медицинское изделие
- 33. Примеры внесения изменений в регистрационное удостоверение на медицинское изделие (1. изменение места производства медицинского изделия; 2.
- 34. Примеры внесения изменений в регистрационное удостоверение на медицинское изделие
- 35. Примеры внесения изменений в регистрационное удостоверение на медицинское изделие (1. изменение сведений о заявителе; 2. изменение
- 37. Скачать презентацию























 Практические вопросы заключения коллективного договора и уведомительной регистрации
Практические вопросы заключения коллективного договора и уведомительной регистрации Доказательства в гражданском процессе (ч.1)
Доказательства в гражданском процессе (ч.1) Новое поколение
Новое поколение О государственной судебно-экспертной деятельности в Российской Федерации
О государственной судебно-экспертной деятельности в Российской Федерации Зміни виборчого законодавства після кампанії 2012 року
Зміни виборчого законодавства після кампанії 2012 року Обеспечение безопасности транспортно процесса
Обеспечение безопасности транспортно процесса Основы классификации и методики правовой квалификации административных правонарушений в таможенной сфере
Основы классификации и методики правовой квалификации административных правонарушений в таможенной сфере Брак, условия его заключения
Брак, условия его заключения Лицензионное программное обеспечение. Открытые лицензий
Лицензионное программное обеспечение. Открытые лицензий Моделирование условий и процесса функционирования противопожарной службы
Моделирование условий и процесса функционирования противопожарной службы Контрольные вопросы по административному праву
Контрольные вопросы по административному праву Общее понятие римского права. Понятие римского права
Общее понятие римского права. Понятие римского права Законодательство в сфере охраны труда. Последние изменения
Законодательство в сфере охраны труда. Последние изменения Об изменении параметров осуществления охоты на территории Кировской области
Об изменении параметров осуществления охоты на территории Кировской области Понятие и сущность судебной власти. Модели правосудия в современном мире
Понятие и сущность судебной власти. Модели правосудия в современном мире Периодизация и система римского права
Периодизация и система римского права Презентация День Государственного флага Российской Федерации
Презентация День Государственного флага Российской Федерации Антикризисные закупки по 223-ФЗ: что изменилось из-за санкций
Антикризисные закупки по 223-ФЗ: что изменилось из-за санкций Глава муниципального образования. Местная администрация и иные органы муниципального образования
Глава муниципального образования. Местная администрация и иные органы муниципального образования Основы административного права. Урок 22
Основы административного права. Урок 22 Развитие ТОС в свете последних изменений законодательства
Развитие ТОС в свете последних изменений законодательства Понятие и социально-правовая сущность коррупции. Лекция 1
Понятие и социально-правовая сущность коррупции. Лекция 1 Окончание предварительного следствия с обвинительным заключением и дознания с обвинительным актом
Окончание предварительного следствия с обвинительным заключением и дознания с обвинительным актом Способы обеспечения законности в сфере исполнительной власти
Способы обеспечения законности в сфере исполнительной власти Алиментные обязательства детей, родителей и супругов
Алиментные обязательства детей, родителей и супругов Гид по взаимодействию с государственными органами при проведении проверок
Гид по взаимодействию с государственными органами при проведении проверок Осуществление выездной проверки при проведении сертификации оператора аэродрома
Осуществление выездной проверки при проведении сертификации оператора аэродрома Коммерческое предложение по аренде помещений под СТО
Коммерческое предложение по аренде помещений под СТО