Содержание
- 2. Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Ярославской области Федеральный закон от 31.07.2020
- 3. Статья 21. Информирование контролируемых лиц о совершаемых КНМ и принимаемых решениях осуществляется посредством - размещения сведений
- 4. - сведения о котором представлены при осуществлении государственного контроля (надзора), муниципального контроля или оказании государственных и
- 5. Статья 56. Виды контрольных (надзорных) мероприятий Взаимодействие с контролируемым лицом осуществляется при проведении следующих КНМ: 1)
- 6. Выездное обследование проводится без информирования контролируемого лица и собственника производственного объекта Срок проведения выездного обследования в
- 7. Профилактические мероприятия 7) профилактический визит. 1) информирование; 2) обобщение правоприменительной практики; 3) меры стимулирования добросовестности 4)
- 8. Профилактический визит проводится в форме профилактической беседы по месту осуществления деятельности контролируемого лица либо путем использования
- 9. Статья 50. Консультирование Проводится по обращениям контролируемых лиц и их представителей Консультирование может осуществляться по телефону,
- 10. Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Ярославской области Федеральный закон от 31
- 11. установленных НПА разной юридической силы подлежат применению обязательные требования, установленные НПА большей юридической силы. При отмене
- 12. ФОИВ в отношении принятых ими НПА дают официальные разъяснения обязательных требований исключительно в целях пояснения их
- 13. МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ПИСЬМО от 27 апреля 2022 г. N 25-4/3812 «….считаем возможным не указывать
- 14. Приказ Минздравсоцразвития России от 12.02.2007 N 110 (ред. от 24.11.2021) "О порядке назначения и выписывания лекарственных
- 15. Правительством РФ до 1 января 2021 года обеспечиваются признание утратившими силу, не действующими на территории РФ
- 16. Правительство Российской Федерации вправе определить перечень нормативных правовых актов либо групп нормативных правовых актов, в отношении
- 17. Лицензионный контроль в сфере фармацевтической деятельности (п.п. 605) Федеральный государственный надзор в сфере обращения лекарственных средств
- 18. Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Ярославской области Федеральный закон от 04.05.2011
- 19. ЛИЦЕНЗИЯ - специальное разрешение на право осуществления юридическим лицом или индивидуальным предпринимателем конкретного вида деятельности (выполнения
- 20. Лицензиат может иметь только одну лицензию. Регистрационный номер присваивается лицензии с использованием единого реестра учета лицензий
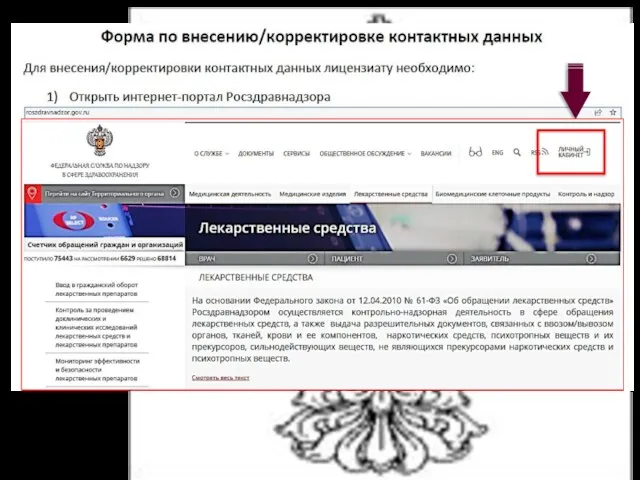
- 21. В случае изменения места нахождения лицензиата - ЮЛ, места жительства лицензиата - ИП, места осуществления лицензируемого
- 22. "Статья 18. Внесение изменений в реестр лицензий"; Сведения об изменении номера телефона, адреса электронной почты вносятся
- 23. Сведения об изменении номера телефона, адреса электронной почты подлежат внесению лицензиатом в реестр лицензий в течение
- 28. при заявлении соискателем лицензии работ и услуг по розничной торговле лекарственными препаратами; при заявлении лицензиатом нового
- 29. Приказ Росздравнадзора от 19.02.2022 №1185 "Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые
- 30. Постановление Правительства РФ от 31.03.2022 №547 "Об утверждении Положения о лицензировании фармацевтической деятельности" Заявление о предоставлении
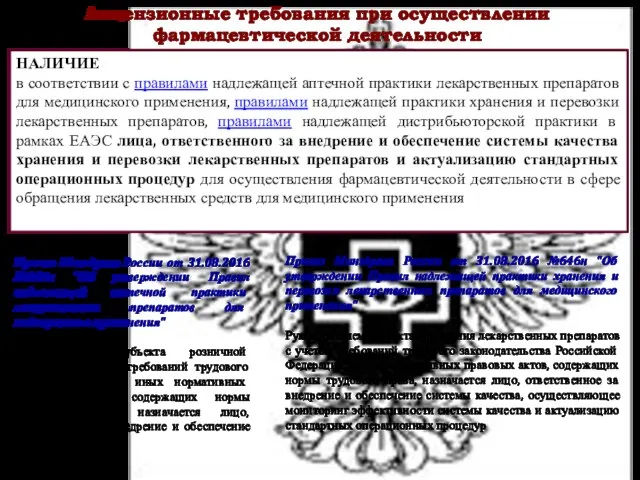
- 31. Лицензионные требования при осуществлении фармацевтической деятельности НАЛИЧИЕ в соответствии с правилами надлежащей аптечной практики лекарственных препаратов
- 32. Приказ Минтруда России от 22.05.2017 №428н "Об утверждении профессионального стандарта "Специалист в области управления фармацевтической деятельностью"
- 33. ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ ПОСТАНОВЛЕНИЕ от 15 сентября 2020 г. №1447 ОБ УТВЕРЖДЕНИИ ПРАВИЛ УНИЧТОЖЕНИЯ ИЗЪЯТЫХ ФАЛЬСИФИЦИРОВАННЫХ
- 34. ФЕДЕРАЛЬНЫЙ ЗАКОН от 28 ноября 2018 года №449-ФЗ «О ВНЕСЕНИИ ИЗМЕНЕНИЙ В ОТДЕЛЬНЫЕ ЗАКОНОДАТЕЛЬНЫЕ АКТЫ РОССИЙСКОЙ
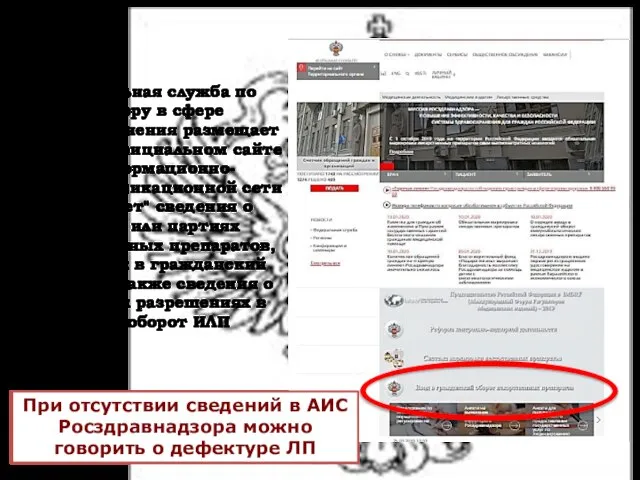
- 35. Федеральная служба по надзору в сфере здравоохранения размещает на своем официальном сайте в информационно-телекоммуникационной сети "Интернет"
- 36. Дефектура или риск возникновения дефектуры лекарственных препаратов с указанием наименований (международных непатентованных, или химических, или группировочных),
- 37. Разрешение на временное обращение по 31 декабря 2023 г. серии (партии) выдается Министерством здравоохранения Российской Федерации
- 38. Ввоз в Российскую Федерацию осуществляется по 31 декабря 2022 г. без специального разрешения и допускается при
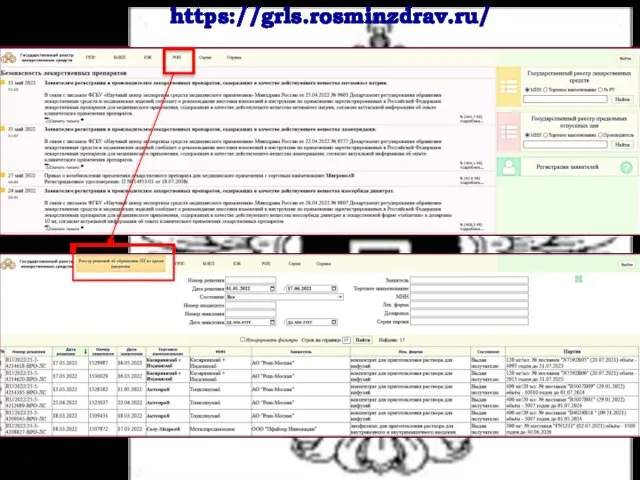
- 39. https://grls.rosminzdrav.ru/
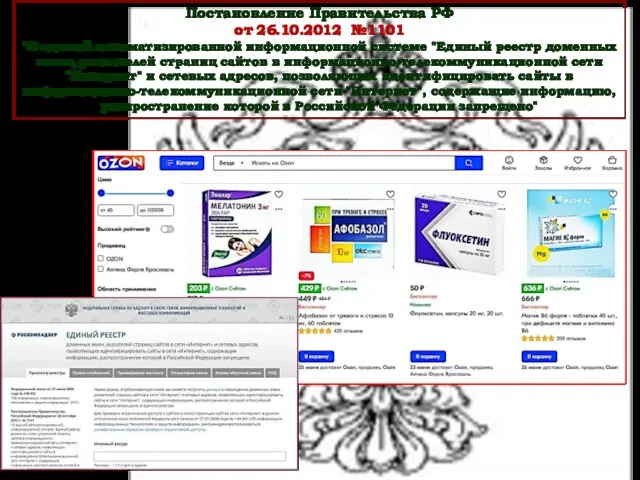
- 40. Постановление Правительства РФ от 26.10.2012 №1101 "О единой автоматизированной информационной системе "Единый реестр доменных имен, указателей
- 41. Постановление Первого арбитражного апелляционного суда от 31.03.2022 №01АП-1389/2022 по делу №А43-42515/2021 Требование: О привлечении к административной
- 42. Приказ Минздрава России от 24.11.2021 №1093н "Об утверждении Правил отпуска лекарственных препаратов для медицинского применения аптечными
- 43. Пункта 12 Правил отпуска лекарственных препаратов вступает в силу с 1 марта 2022 г. и действует
- 44. Пациент К.А.С., 2005 г.р., препараты Атенолол, Верапамил Пациентка О.Д.Д., 2007 г.р. препарат Димедрол СК СУ находятся
- 46. Скачать презентацию






































 Понятие права. Право в системе социальных норм. Тема 8. Лекция 1
Понятие права. Право в системе социальных норм. Тема 8. Лекция 1 Квотирование рабочих мест для инвалидов
Квотирование рабочих мест для инвалидов Субъекты АП
Субъекты АП Лицензирование и передача технологий
Лицензирование и передача технологий Податкове право
Податкове право Гражданская правосубъектность кредитного потребительского кооператива
Гражданская правосубъектность кредитного потребительского кооператива Интеллектуальная собственность
Интеллектуальная собственность Особо охраняемые природные территории Волгоградской области
Особо охраняемые природные территории Волгоградской области Государство: его признаки и функции
Государство: его признаки и функции Программа ассессмента для многофункционального центра Рузского муниципального района
Программа ассессмента для многофункционального центра Рузского муниципального района Земельное право
Земельное право Правовые отношения и их структура
Правовые отношения и их структура Новые технологии и стандарты в области подтверждения соответствия и предотвращения контрафакта, подделок
Новые технологии и стандарты в области подтверждения соответствия и предотвращения контрафакта, подделок Социально- правовые основы создания приемных семей
Социально- правовые основы создания приемных семей Актуальные изменения законодательства Российской Федерации в сфере финансов и налогообложения
Актуальные изменения законодательства Российской Федерации в сфере финансов и налогообложения Права и обязанности. Система общеобязательных правил
Права и обязанности. Система общеобязательных правил Общие сведения о метрологии. Технология измерений
Общие сведения о метрологии. Технология измерений Формирование межевого плана при образовании участка в рамках осуществления кадастровых отношений
Формирование межевого плана при образовании участка в рамках осуществления кадастровых отношений Центр сертификации ЕАС Портал. Услуги портала
Центр сертификации ЕАС Портал. Услуги портала Понятие, содержание, назначение и нормативно-правовое обеспечение конституционного судебного процесса в России
Понятие, содержание, назначение и нормативно-правовое обеспечение конституционного судебного процесса в России Представительство в суде (Гл.5 ГПК)
Представительство в суде (Гл.5 ГПК) Организация и ведение архивного дела в ФГБУ ЦЖКУ Минобороны России
Организация и ведение архивного дела в ФГБУ ЦЖКУ Минобороны России Учебная практика. Занятие 13. Практическая работа № 13
Учебная практика. Занятие 13. Практическая работа № 13 Школа грамотного потребителя жилищно-коммунальных услуг
Школа грамотного потребителя жилищно-коммунальных услуг Право в системе социальных норм
Право в системе социальных норм Обстоятельства, исключающие преступность деяния
Обстоятельства, исключающие преступность деяния Государственная гражданская служба Российской Федерации
Государственная гражданская служба Российской Федерации Судебная фотография и видеозапись. Судебная экспертиза. Фотоматериаловедение. (Тема 2)
Судебная фотография и видеозапись. Судебная экспертиза. Фотоматериаловедение. (Тема 2)