Содержание
- 2. ОБЩИЕ СВОЙСТВА: ТРАНСПОРТ СОПРЯЖЕН С ГИДРОЛИЗОМ АТФ ПЕРЕНОС ИОНОВ ОСУЩЕСТВЛЯЮТ ТРАНСПОРТНЫЕ АТФАЗЫ ТРАНСПОРТ ОСУЩЕСТВЛЯЕТСЯ ПРОТИВ ГРАДИЕНТА
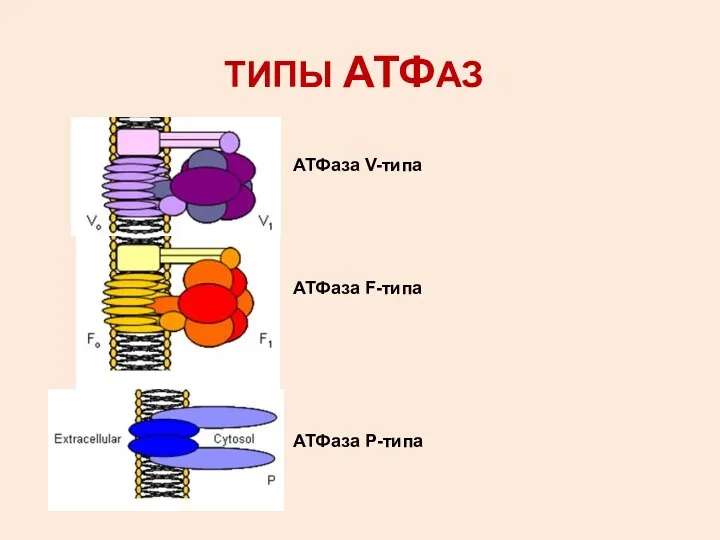
- 3. ТИПЫ АТФАЗ АТФаза V-типа АТФаза F-типа АТФаза Р-типа
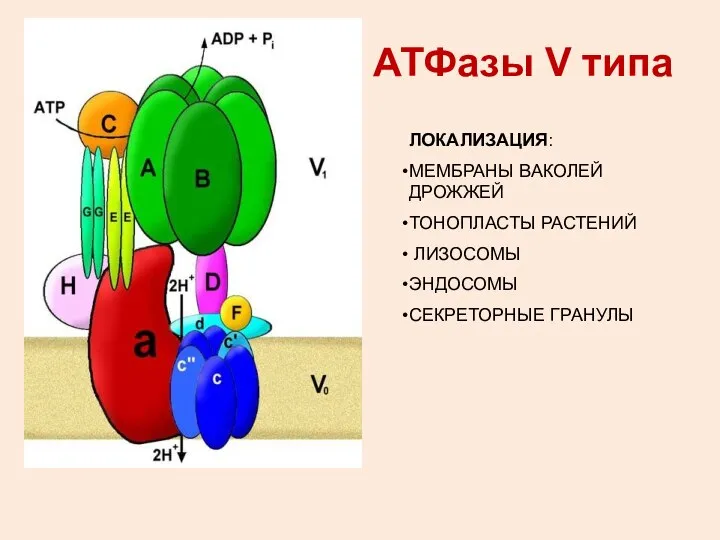
- 4. АТФазы V типа ЛОКАЛИЗАЦИЯ: МЕМБРАНЫ ВАКОЛЕЙ ДРОЖЖЕЙ ТОНОПЛАСТЫ РАСТЕНИЙ ЛИЗОСОМЫ ЭНДОСОМЫ СЕКРЕТОРНЫЕ ГРАНУЛЫ
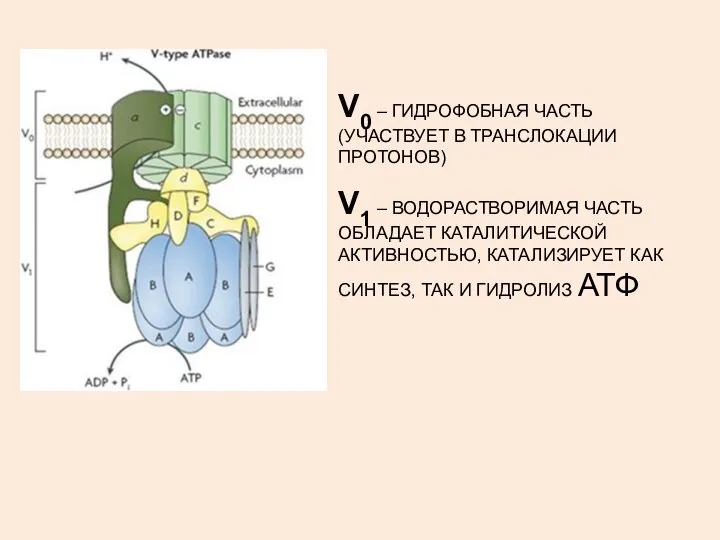
- 5. V0 – ГИДРОФОБНАЯ ЧАСТЬ (УЧАСТВУЕТ В ТРАНСЛОКАЦИИ ПРОТОНОВ) V1 – ВОДОРАСТВОРИМАЯ ЧАСТЬ ОБЛАДАЕТ КАТАЛИТИЧЕСКОЙ АКТИВНОСТЬЮ, КАТАЛИЗИРУЕТ
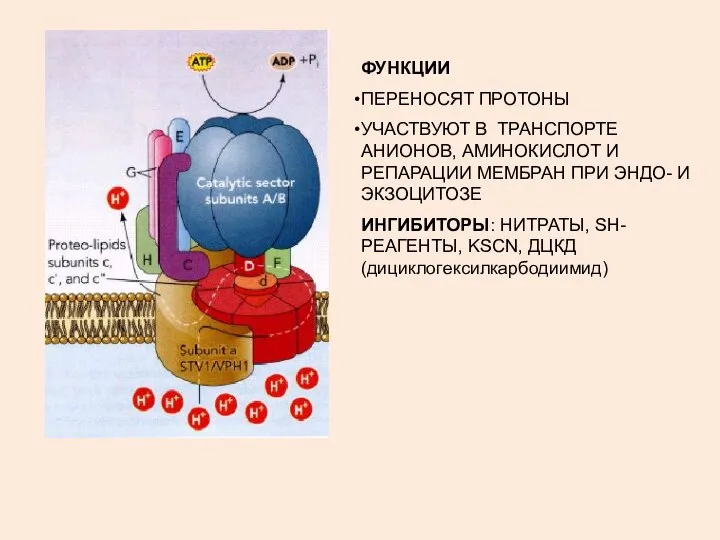
- 6. ФУНКЦИИ ПЕРЕНОСЯТ ПРОТОНЫ УЧАСТВУЮТ В ТРАНСПОРТЕ АНИОНОВ, АМИНОКИСЛОТ И РЕПАРАЦИИ МЕМБРАН ПРИ ЭНДО- И ЭКЗОЦИТОЗЕ ИНГИБИТОРЫ:
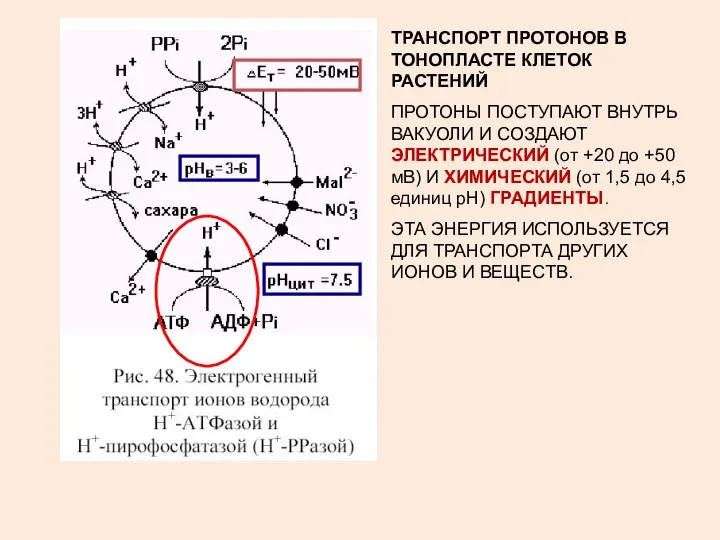
- 7. ТРАНСПОРТ ПРОТОНОВ В ТОНОПЛАСТЕ КЛЕТОК РАСТЕНИЙ ПРОТОНЫ ПОСТУПАЮТ ВНУТРЬ ВАКУОЛИ И СОЗДАЮТ ЭЛЕКТРИЧЕСКИЙ (от +20 до
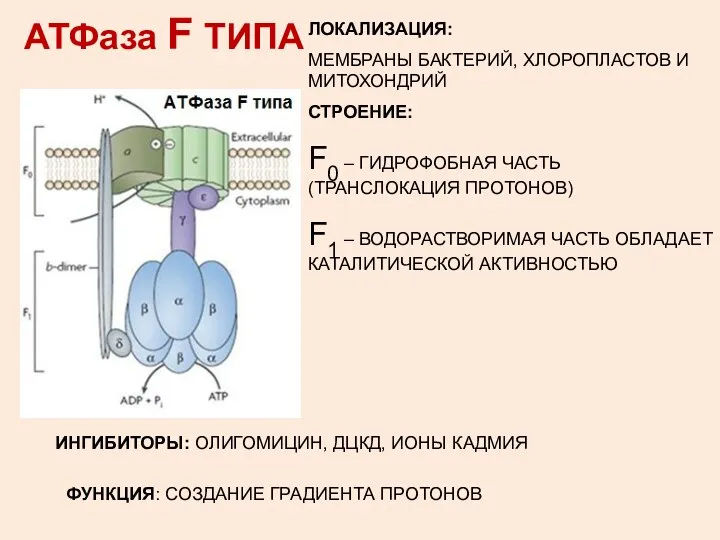
- 8. АТФаза F ТИПА ЛОКАЛИЗАЦИЯ: МЕМБРАНЫ БАКТЕРИЙ, ХЛОРОПЛАСТОВ И МИТОХОНДРИЙ СТРОЕНИЕ: F0 – ГИДРОФОБНАЯ ЧАСТЬ (ТРАНСЛОКАЦИЯ ПРОТОНОВ)
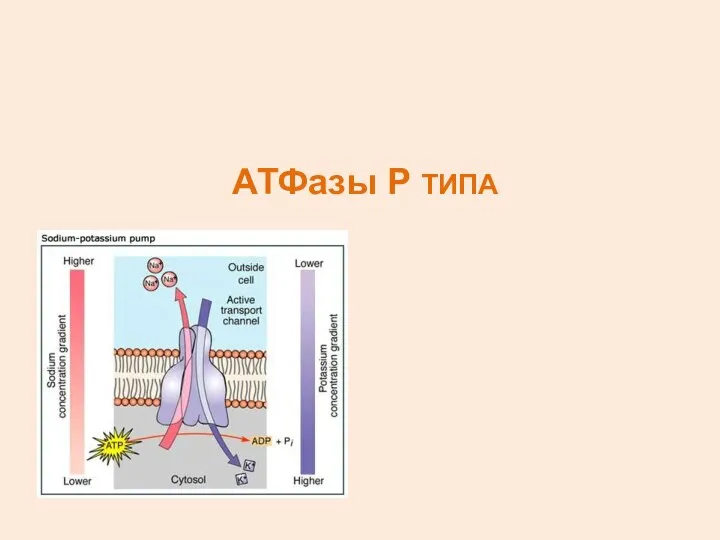
- 9. АТФазы Р ТИПА
- 10. АТФазы Р ТИПА ОБЩЕЕ СВОЙСТВО: ОБРАЗОВАНИЕ ФОСФОРИЛИРОВАННОГО ПРОДУКТА, КОТОРЫЙ УЧАСТВУЕТ В РЕАКЦИОННОЙ ЦИКЛЕ ПРИМЕРЫ: Na/K-АТФаза, Ca-АТФаза,
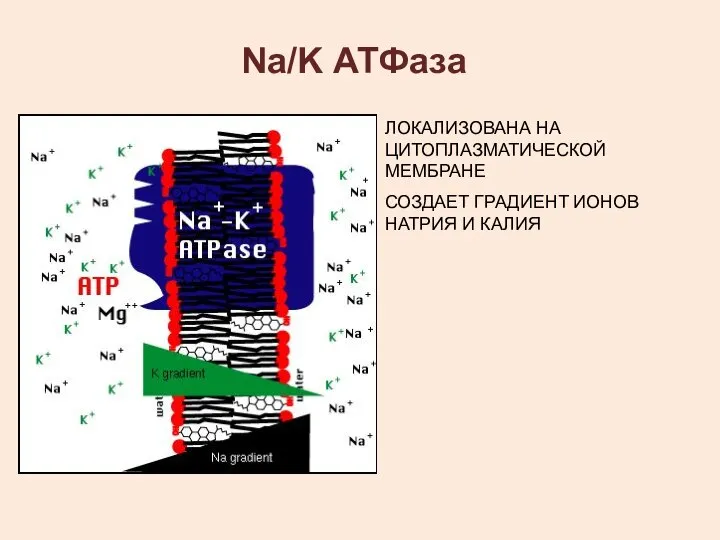
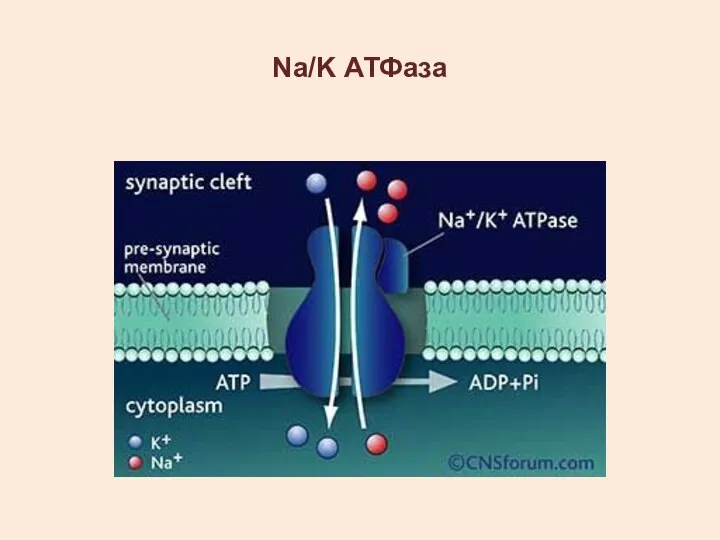
- 11. Na/K АТФаза ЛОКАЛИЗОВАНА НА ЦИТОПЛАЗМАТИЧЕСКОЙ МЕМБРАНЕ СОЗДАЕТ ГРАДИЕНТ ИОНОВ НАТРИЯ И КАЛИЯ
- 12. Na/K АТФаза
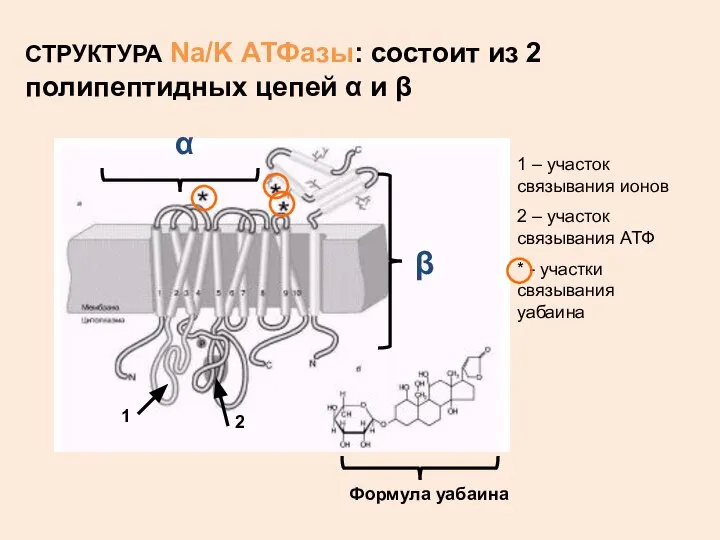
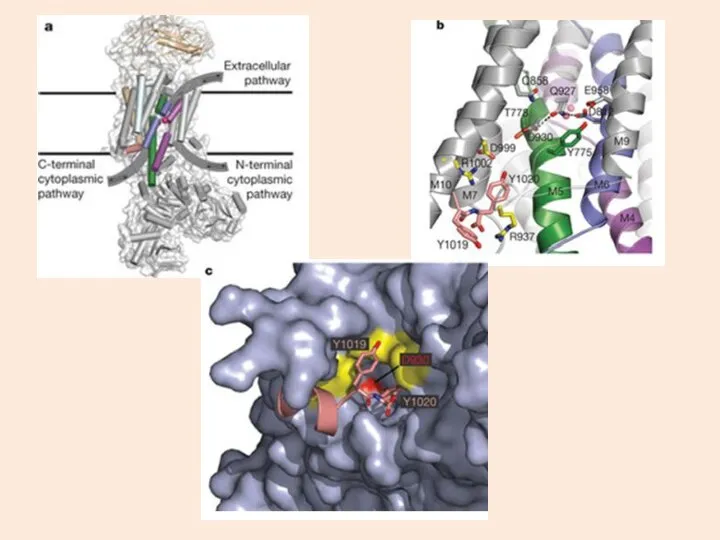
- 13. СТРУКТУРА Na/K АТФазы: состоит из 2 полипептидных цепей α и β 1 – участок связывания ионов
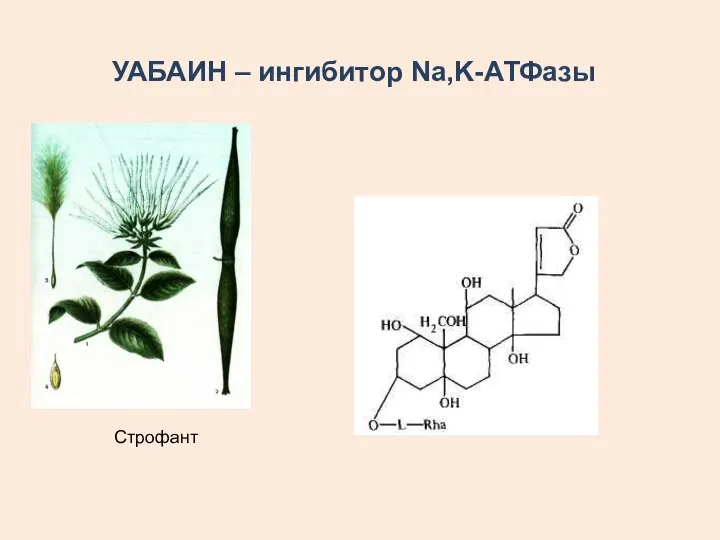
- 14. УАБАИН – ингибитор Na,K-АТФазы Строфант
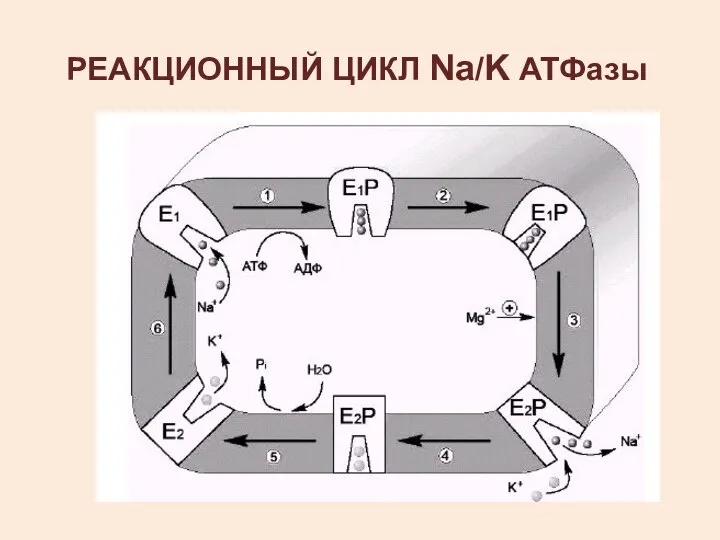
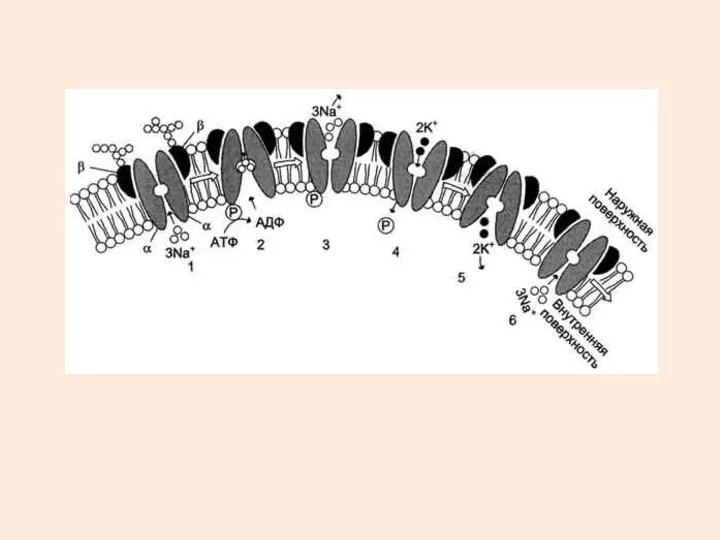
- 15. РЕАКЦИОННЫЙ ЦИКЛ Na/K АТФазы
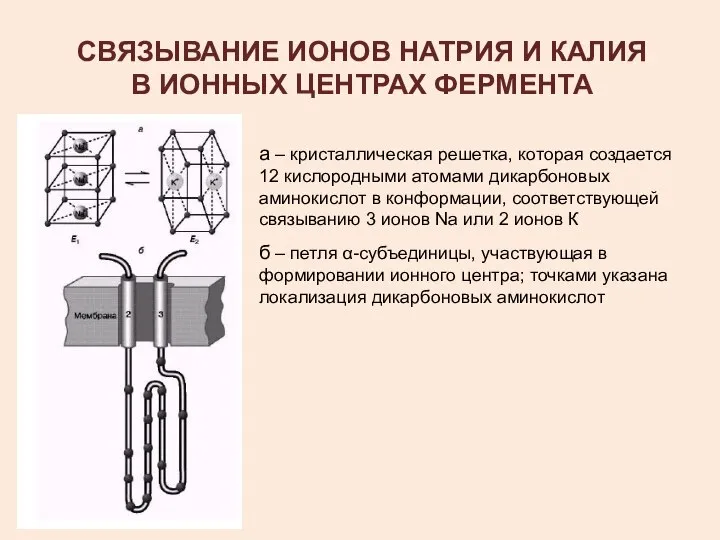
- 16. СВЯЗЫВАНИЕ ИОНОВ НАТРИЯ И КАЛИЯ В ИОННЫХ ЦЕНТРАХ ФЕРМЕНТА а – кристаллическая решетка, которая создается 12
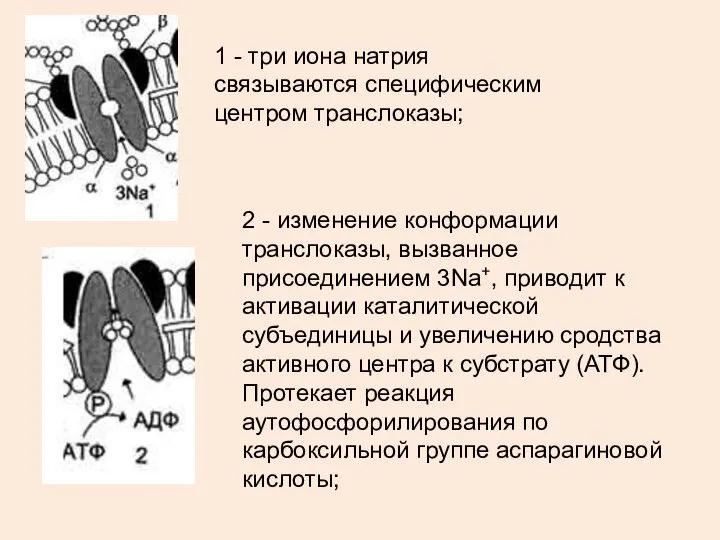
- 19. 2 - изменение конформации транслоказы, вызванное присоединением 3Na+, приводит к активации каталитической субъединицы и увеличению сродства
- 20. 3 - аутофосфорилирование изменяет заряд и конформацию транслоказы, она закрывается с внутренней стороны мембраны и открывается
- 21. 5 - дефосфорилирование изменяет заряд и конформацию транслоказы, она закрывается с наружной стороны мембраны и открывается
- 22. РЕГУЛЯЦИЯ АКТИВНОСТИ Na/K АТФазы СООТНОШЕНИЕ Na/K И СОДЕРЖАНИЕ АТФ (факторы краткосрочной регуляции) ФОСФОРИЛИРОВАНИЕ ПРОТЕИНКИНАЗАМИ, ЧТО ПРИВОДИТ
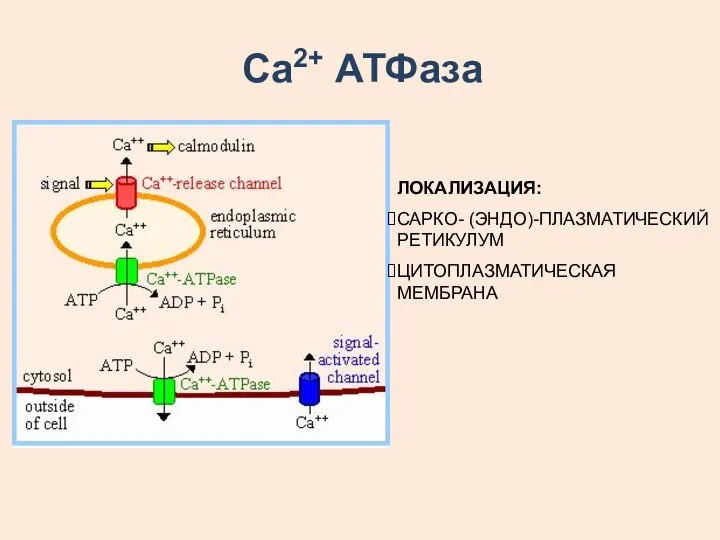
- 23. Са2+ АТФаза ЛОКАЛИЗАЦИЯ: САРКО- (ЭНДО)-ПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ ЦИТОПЛАЗМАТИЧЕСКАЯ МЕМБРАНА
- 24. ВСЕ Са2+ АТФазы – МОНОМЕРНЫЕ БЕЛКИ, Т.Е. СОСТОЯТ ИЗ ОДНОЙ ПОЛИПЕПТИДНОЙ ЦЕПИ Са2+ АТФаза СПР И
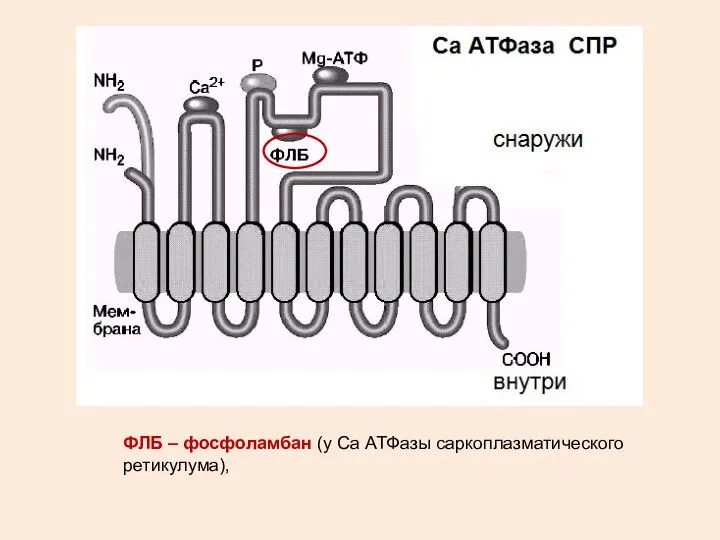
- 25. ФЛБ – фосфоламбан (у Са АТФазы саркоплазматического ретикулума),
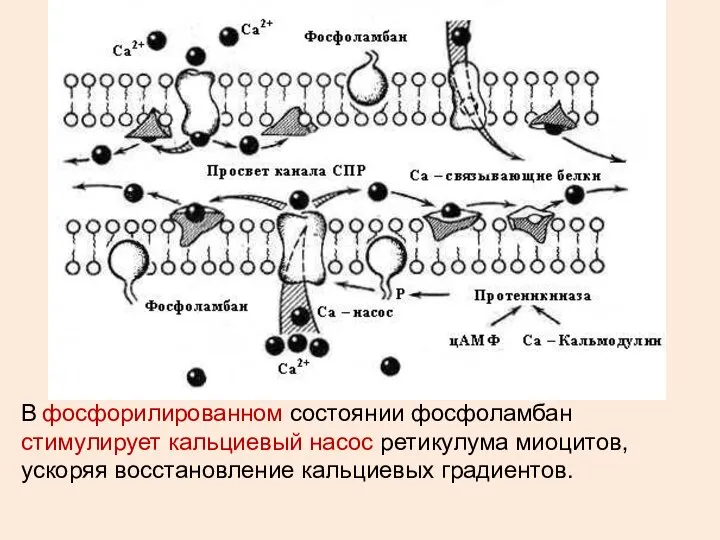
- 26. В фосфорилированном состоянии фосфоламбан стимулирует кальциевый насос ретикулума миоцитов, ускоряя восстановление кальциевых градиентов.
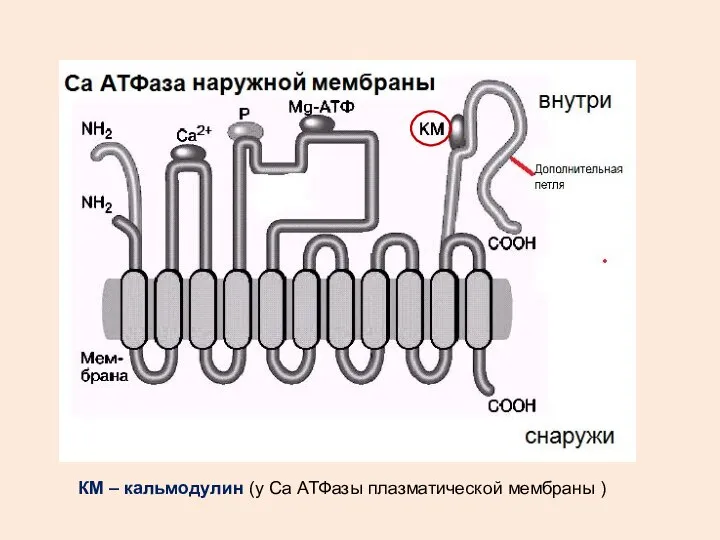
- 27. КМ – кальмодулин (у Са АТФазы плазматической мембраны )
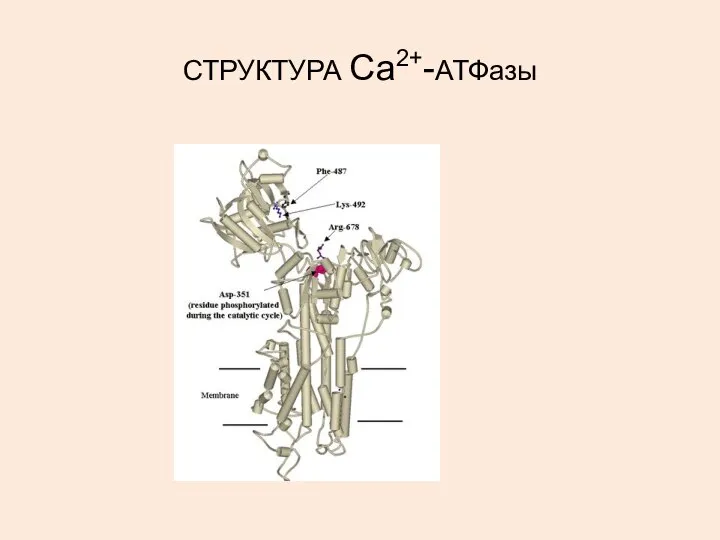
- 28. СТРУКТУРА Са2+-АТФазы
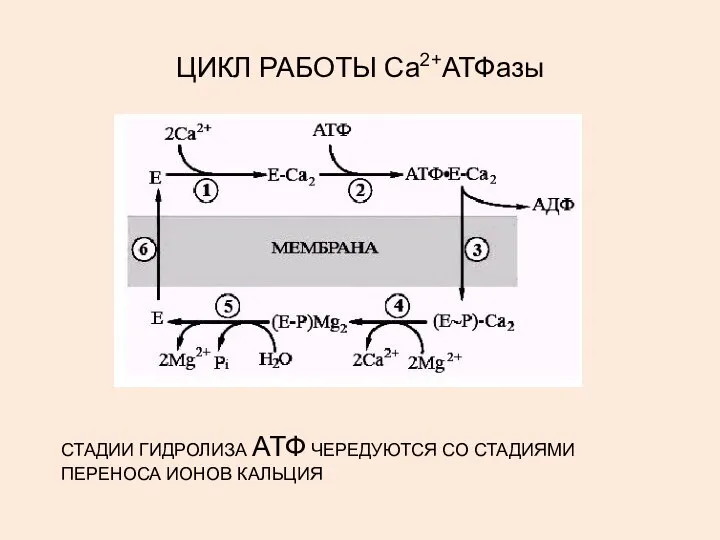
- 29. ЦИКЛ РАБОТЫ Са2+АТФазы СТАДИИ ГИДРОЛИЗА АТФ ЧЕРЕДУЮТСЯ СО СТАДИЯМИ ПЕРЕНОСА ИОНОВ КАЛЬЦИЯ
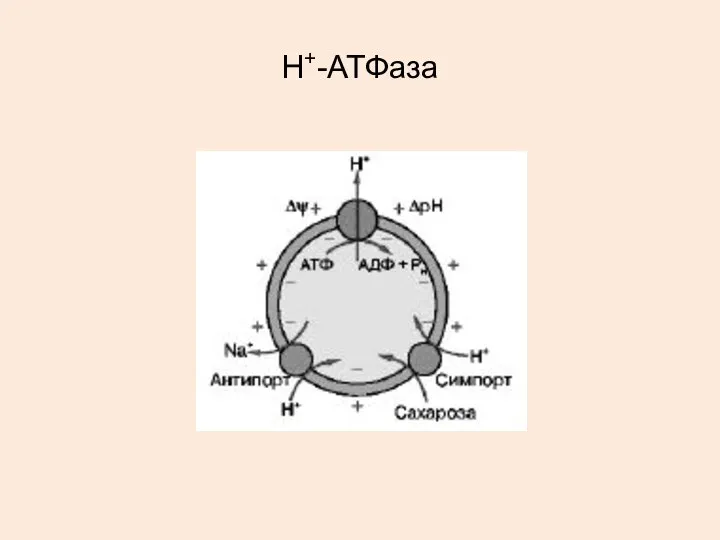
- 30. Н+-АТФаза
- 32. Скачать презентацию






 Применение производной к исследованию функций. Локальные экстремумы. Точка перегиба
Применение производной к исследованию функций. Локальные экстремумы. Точка перегиба Основы вибродиагностики
Основы вибродиагностики Жетекші: Аяпова Ж.О Жетекші: Аяпова Ж.О Орындаған: Айт-Базар Райхан Факультет: ЖМ Курс: ІІ Топ: 001-1 Алматы 2014 жыл
Жетекші: Аяпова Ж.О Жетекші: Аяпова Ж.О Орындаған: Айт-Базар Райхан Факультет: ЖМ Курс: ІІ Топ: 001-1 Алматы 2014 жыл Быт и нравы Древней Руси. Жилище
Быт и нравы Древней Руси. Жилище ОАО «Горно-металлургическая компания «Норильский никель» _
ОАО «Горно-металлургическая компания «Норильский никель» _ Управляющие структуры в Visual Basic
Управляющие структуры в Visual Basic Учёные и путешественники
Учёные и путешественники Нарушения кислотно-основного состояния
Нарушения кислотно-основного состояния  Профильные комитеты по бюджету, налогам, банкам и финансам Государственной Думы и Совета Федерации
Профильные комитеты по бюджету, налогам, банкам и финансам Государственной Думы и Совета Федерации Абсурд разделений. Младенчество коринфян
Абсурд разделений. Младенчество коринфян лек соц группы
лек соц группы Презентация "Дело в шляпе" - скачать презентации по МХК
Презентация "Дело в шляпе" - скачать презентации по МХК Синдром Мендельсона. Этиопатогенез. Клиника. Савельева О.О. 603 гр. Пед.фак.
Синдром Мендельсона. Этиопатогенез. Клиника. Савельева О.О. 603 гр. Пед.фак. Презентация "Мещанин во дворянстве" - скачать презентации по МХК
Презентация "Мещанин во дворянстве" - скачать презентации по МХК Презентация "Фотоколлаж" - скачать презентации по МХК
Презентация "Фотоколлаж" - скачать презентации по МХК Цифровая модель рельефа: создание и анализ
Цифровая модель рельефа: создание и анализ Юнеско
Юнеско  Тема: «Образование крахмала в листьях на свету. Роль света в процессе фотосинтеза.» Выполнила: ученица 3 «В» класса Потапкина Вале
Тема: «Образование крахмала в листьях на свету. Роль света в процессе фотосинтеза.» Выполнила: ученица 3 «В» класса Потапкина Вале Отчетная конференция Череповецкого местного городского отделения ВПП «Единая Россия»
Отчетная конференция Череповецкого местного городского отделения ВПП «Единая Россия» Многочлены. Решение олимпиадных задач по теме «Многочлены»
Многочлены. Решение олимпиадных задач по теме «Многочлены»  Беременность и роды после 35 лет
Беременность и роды после 35 лет  Национальная одежда и костюмы Германии
Национальная одежда и костюмы Германии Программы развития внутреннего водного транспорта Республики Беларусь
Программы развития внутреннего водного транспорта Республики Беларусь  Генетика Сцепленное наследование признаков § 3.8
Генетика Сцепленное наследование признаков § 3.8  Генераторы несинусоидальных напряжений
Генераторы несинусоидальных напряжений Математик 4б анги Багш Б. Болортуяа
Математик 4б анги Багш Б. Болортуяа Анализ несоответствий, выявляемых «Союзсерт» при проведении сертификации и инспекционного контроля систем менеджмента качества
Анализ несоответствий, выявляемых «Союзсерт» при проведении сертификации и инспекционного контроля систем менеджмента качества Архитектурная графика
Архитектурная графика