Содержание
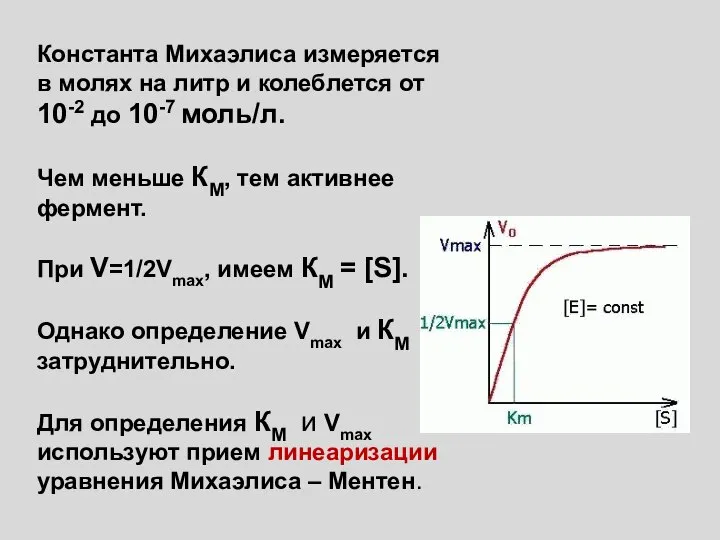
- 2. Константа Михаэлиса измеряется в молях на литр и колеблется от 10-2 до 10-7 моль/л. Чем меньше
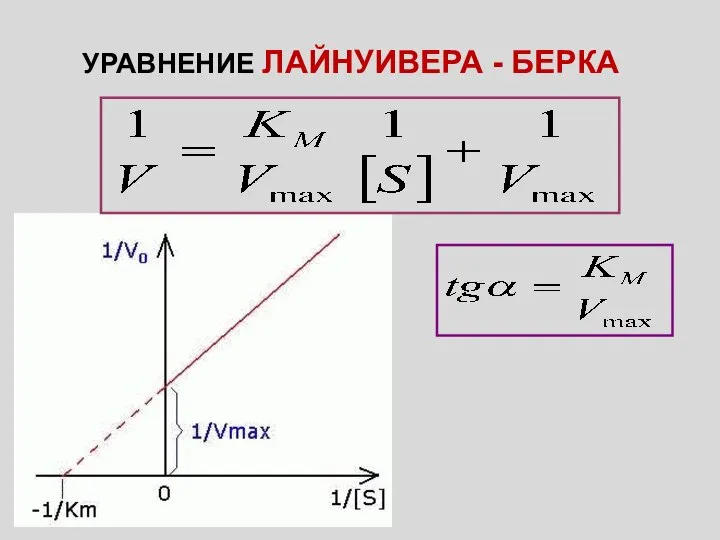
- 3. УРАВНЕНИЕ ЛАЙНУИВЕРА - БЕРКА
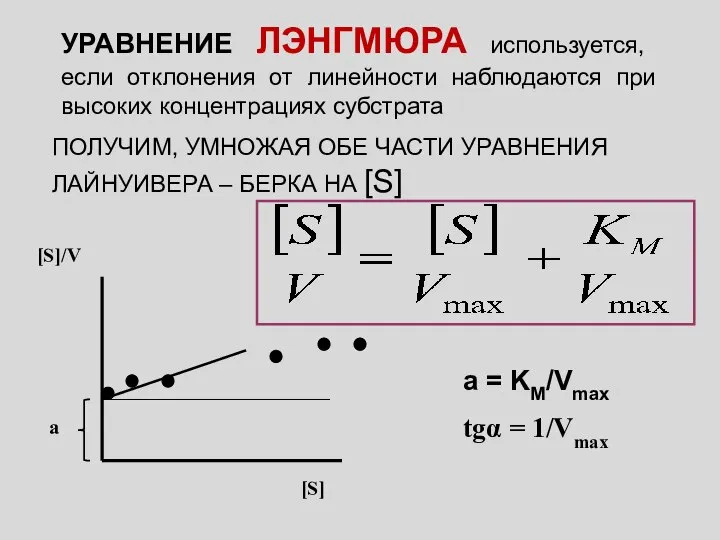
- 4. УРАВНЕНИЕ ЛЭНГМЮРА используется, если отклонения от линейности наблюдаются при высоких концентрациях субстрата ПОЛУЧИМ, УМНОЖАЯ ОБЕ ЧАСТИ
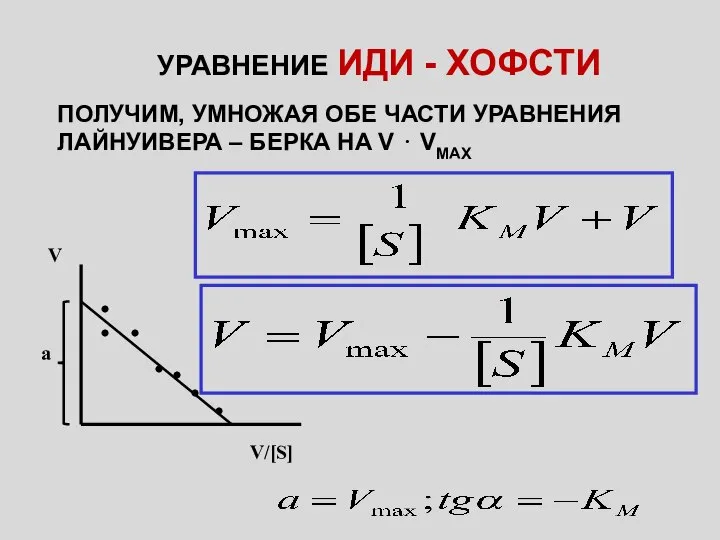
- 5. УРАВНЕНИЕ ИДИ - ХОФСТИ ПОЛУЧИМ, УМНОЖАЯ ОБЕ ЧАСТИ УРАВНЕНИЯ ЛАЙНУИВЕРА – БЕРКА НА V ⋅ VMAX
- 6. АЛЛОСТЕРИЧЕСКИЕ ФЕРМЕНТЫ
- 7. ДЛЯ МНОГИХ ФЕРМЕНТОВ, КАТАЛИЗИРУЮЩИХ КЛЮЧЕВЫЕ СТАДИИ МЕТАБОЛИЗМА, ХАРАКТЕРНА ЧУВСТВИТЕЛЬНОСТЬ К МЕТАБОЛИТАМ, КОТОРЫЕ ОТЛИЧАЮТСЯ ПО ХИМИЧЕСКОЙ СТРУКТУРЕ
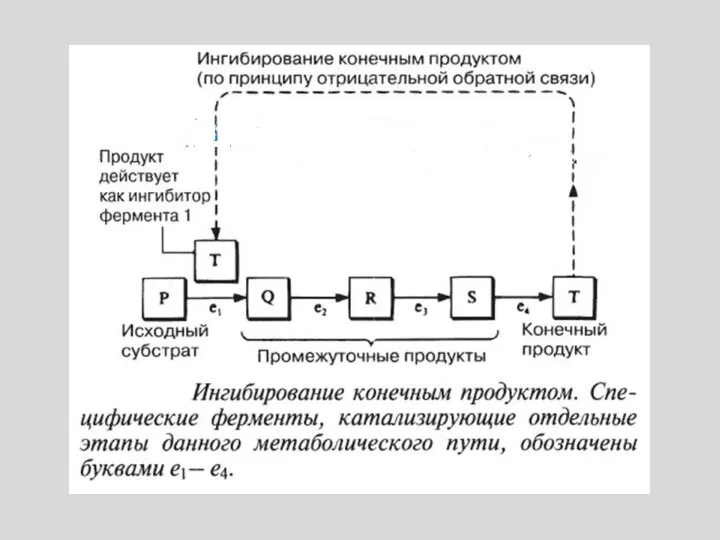
- 9. ОПИСАННЫЙ МЕХАНИЗМ РЕГУЛЯЦИИ ОСУЩЕСТВЛЯЕТСЯ ПО ТИПУ ОБРАТНОЙ СВЯЗИ. ЧТОБЫ ОТРАЗИТЬ РАЗЛИЧИЯ В ХИМИЧЕСКОЙ СТРУКТУРЕ СУБСТРАТА И
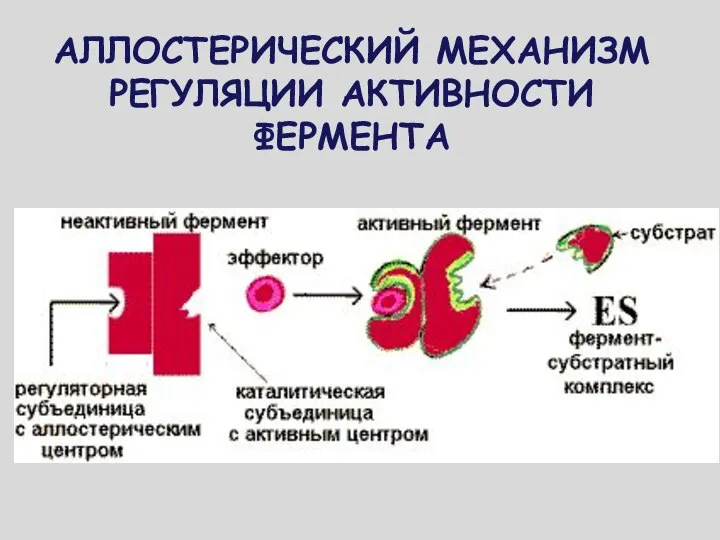
- 10. АЛЛОСТЕРИЧЕСКИЙ МЕХАНИЗМ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТА
- 11. РЕГУЛИРУЮТ АКТИВНОСТЬ ФЕРМЕНТОВ, НЕ ЗАТРАГИВАЯ АКТИВНОГО ЦЕНТРА. ПРИСОЕДИНЯЮТСЯ К МОЛЕКУЛЕ ФЕРМЕНТА ВНЕ АКТИВНОГО ЦЕНТРА. ПРИСОЕДИНЕНИЕ СУБСТРАТА
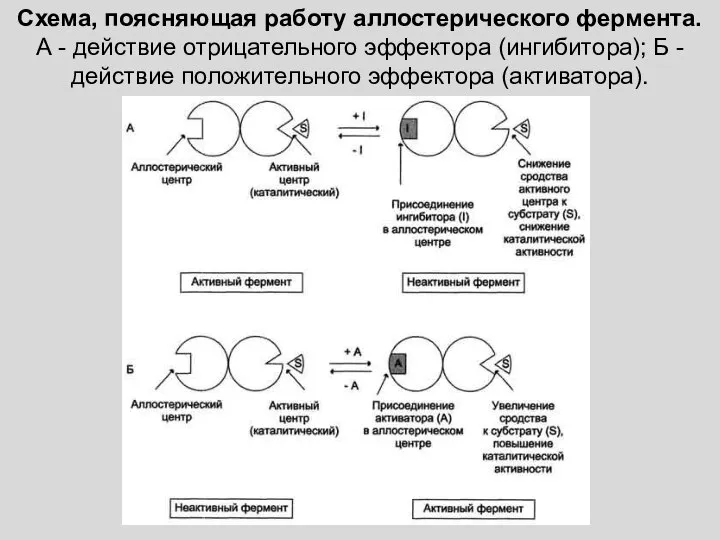
- 12. Схема, поясняющая работу аллостерического фермента. А - действие отрицательного эффектора (ингибитора); Б - действие положительного эффектора
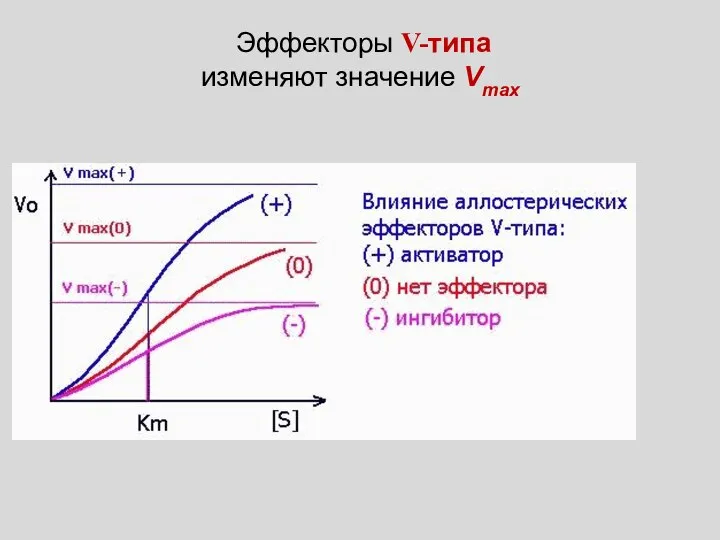
- 13. Эффекторы V-типа изменяют значение Vmax
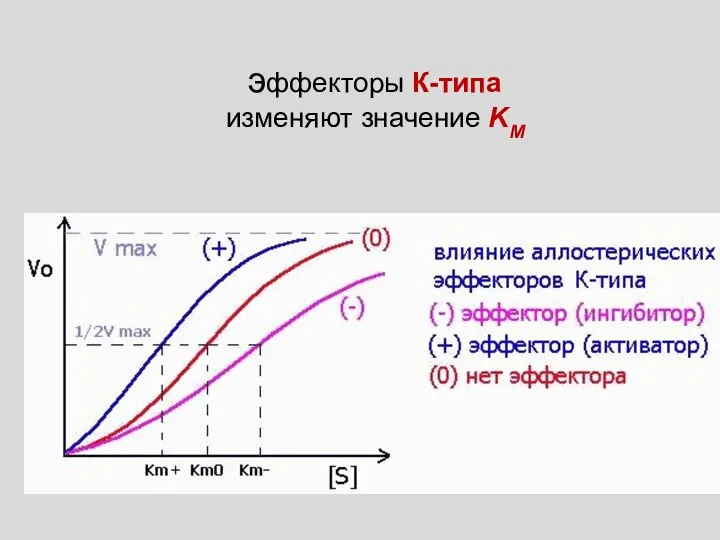
- 14. эффекторы К-типа изменяют значение KМ
- 15. ОСОБЕННОСТИ АЛЛОСТЕРИЧЕСКИХ ФЕРМЕНТОВ НАЛИЧИЕ СПЕЦИФИЧЕСКИХ ЦЕНТРОВ СВЯЗЫВАНИЯ, ПРОСТРАНСТВЕННО УДАЛЕННЫХ ОТ КАТАЛИТИЧЕСКОГО (АКТИВНОГО) ЦЕНТРА СОСТОЯТ ИЗ НЕСКОЛЬКИХ
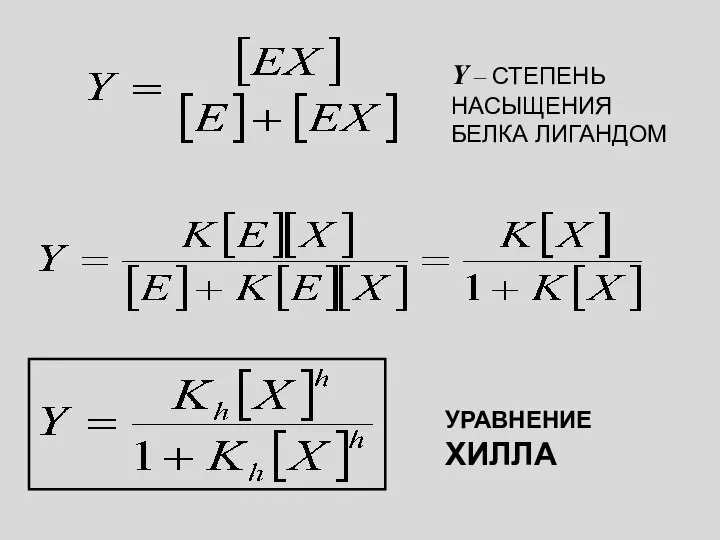
- 16. УРАВНЕНИЕ ХИЛЛА
- 17. В 1909 ГОДУ А. ХИЛЛ ПРЕДЛОЖИЛ МОДЕЛЬ СВЯЗЫВАНИЯ КИСЛОРОДА С ГЕМОГЛОБИНОМ, КОТОРАЯ СООТВЕТСТВОВАЛА ЭКСПЕРИМЕНТАЛЬНЫМ ДАННЫМ. Арчибальд
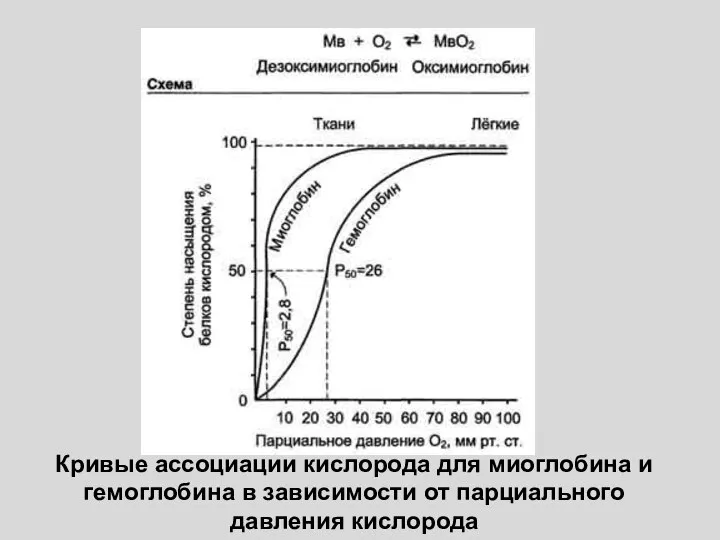
- 18. Кривые ассоциации кислорода для миоглобина и гемоглобина в зависимости от парциального давления кислорода
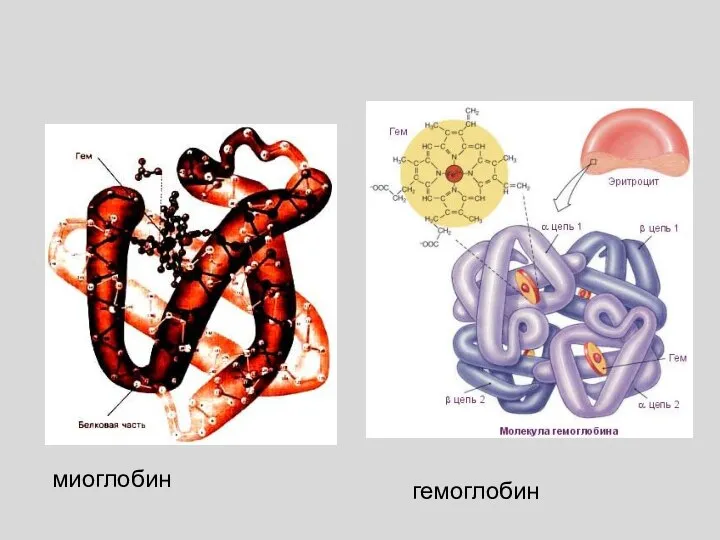
- 19. миоглобин гемоглобин
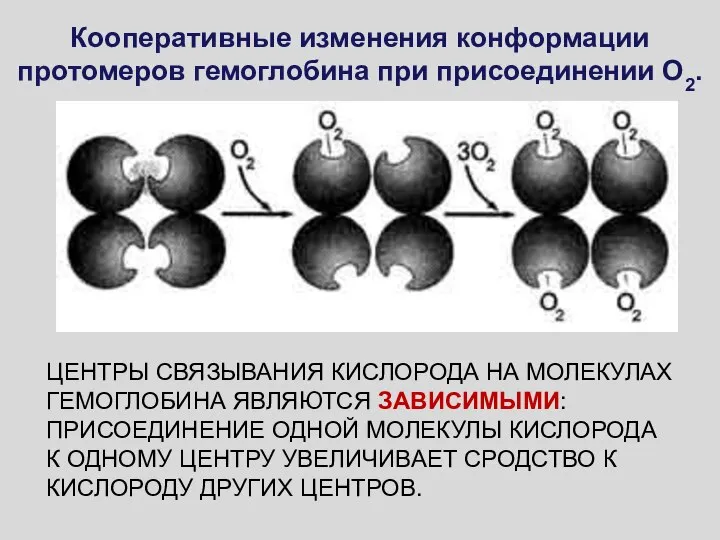
- 20. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2. ЦЕНТРЫ СВЯЗЫВАНИЯ КИСЛОРОДА НА МОЛЕКУЛАХ ГЕМОГЛОБИНА ЯВЛЯЮТСЯ ЗАВИСИМЫМИ:
- 21. КОНСТАНТЫ СВЯЗЫВАНИЯ ИДЕНТИЧНЫХ ЦЕНТРОВ ИЗМЕНЯЮТСЯ ПО МЕРЕ ИХ ЗАПОЛНЕНИЯ, КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ
- 22. А. ХИЛЛ РАССМОТРЕЛ МОДЕЛЬ МАКСИМАЛЬНОЙ КООПЕРАТИВНОСТИ В РАВНОВЕСНОМ РАСТВОРЕ ЛИГАНДА Х И МАКРОМОЛЕКУЛ ПРИСУТСТВУЮТ ЛИБО МАКРОМОЛЕКУЛЫ
- 23. ОБРАЗОВАНИЕ КОМПЛЕКСА ЕХ МОЖНО РАССМАТРИВАТЬ КАК КИНЕТИЧЕСКУЮ РЕАКЦИЮ, КОНСТАНТА КОТОРОЙ РАВНА К E + X ⮀EX
- 24. УРАВНЕНИЕ ХИЛЛА K – КОНСТАНТА СВЯЗЫВАНИЯ E + X ⮀EX K ОТСЮДА
- 25. Y – СТЕПЕНЬ НАСЫЩЕНИЯ БЕЛКА ЛИГАНДОМ УРАВНЕНИЕ ХИЛЛА
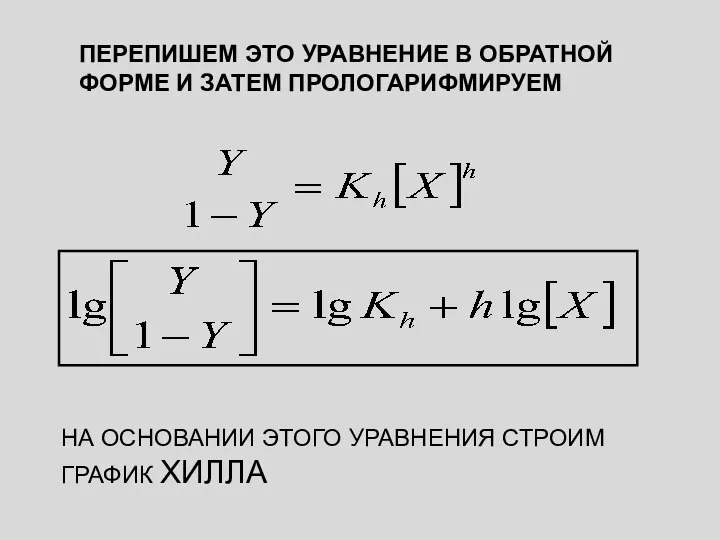
- 26. ПРЕОБРАЗУЕМ ЭТО УРАВНЕНИЕ (ЗАПИШЕМ В ОБРАТНОЙ ФОРМЕ)
- 27. ПЕРЕПИШЕМ ЭТО УРАВНЕНИЕ В ОБРАТНОЙ ФОРМЕ И ЗАТЕМ ПРОЛОГАРИФМИРУЕМ НА ОСНОВАНИИ ЭТОГО УРАВНЕНИЯ СТРОИМ ГРАФИК ХИЛЛА
- 28. lg[Y/1-Y] lg[X] График Хилла для насыщенного кислородом гемоглобина
- 29. Уравнение Хилла удовлетворительно описывает связывание лигандов аллостерическими белками в интервале от 10 до 90% насыщения. За
- 30. НА ЭТОМ ГРАФИКЕ МОЖНО НАЙТИ КОНСТАНТУ СВЯЗЫВАНИЯ Кh и КОЭФФИЦИЕНТ ХИЛЛА h (tgα), КОТОРЫЙ ХАРАКТЕРИЗУЕТ СТЕПЕНЬ
- 31. ЕСЛИ h>1, ТО ИМЕЕТ МЕСТО ПОЛОЖИТЕЛЬНАЯ КООПЕРАТИВНОСТЬ. Присоединение одной молекулы лиганда к активному центру фермента увеличивает
- 32. Физиологическое значение кооперативного связывания: положительная кооперативность обеспечивает резкое изменение степени сродства в очень узком диапазоне концентраций
- 33. МОДЕЛИ АЛЛОСТЕРИЧЕСКИХ ФЕРМЕНТОВ
- 34. СУБЪЕДИНИЦЫ ФЕРМЕНТА МОГУТ НАХОДИТЬСЯ В ДВУХ КОНФОРМАЦИЯХ: R (relaxed – расслабленное состояние) T (tense – напряженное
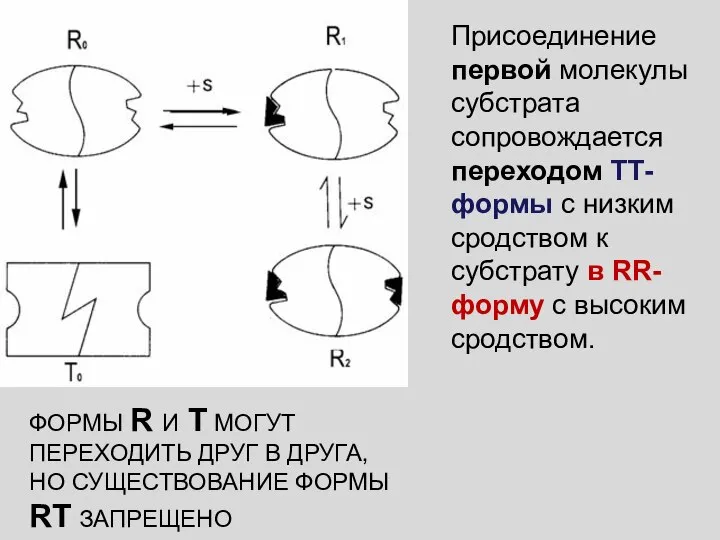
- 35. 1965 г., Жак Моно, Джефри Уайман и Жан-Пьер Шанже Модель согласованного механизма (симметричная модель) Жак Моно
- 36. Присоединение первой молекулы субстрата сопровождается переходом ТТ-формы с низким сродством к субстрату в RR-форму с высоким
- 37. Фермент представлен только двумя конформационными состояниями, находящимися в динамическом равновесии. При этом все субъединицы данной молекулы
- 38. Зависимость степени насыщения Y активных центров фермента от концентрации субстрата [S] в соответствии с моделью согласованного
- 39. Модель последовательного механизма Автор: Даниэль Кошланд Дэниел Кошланд (1920–2007)
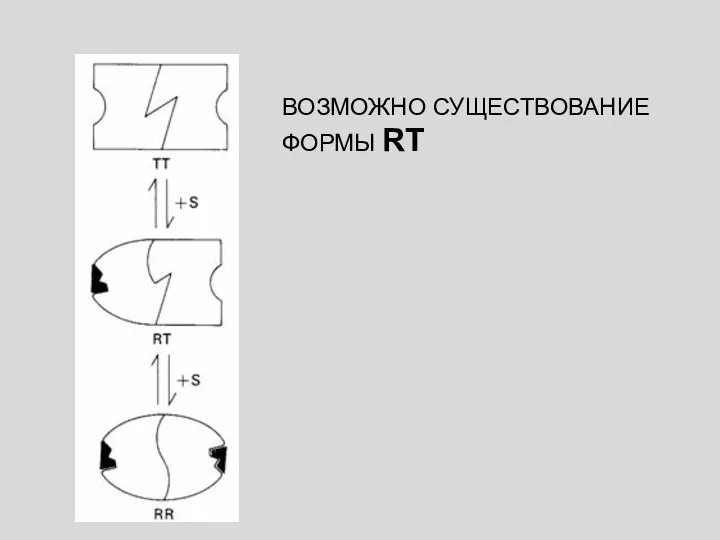
- 40. ВОЗМОЖНО СУЩЕСТВОВАНИЕ ФОРМЫ RT
- 41. Каждая субъединица может существовать в одном из двух возможных конформационных состояний (R или Т). 2. Связывание
- 42. Фермент приобретает каталитически активную конформацию только в результате взаимодействия с субстратом. Если фермент состоит из нескольких
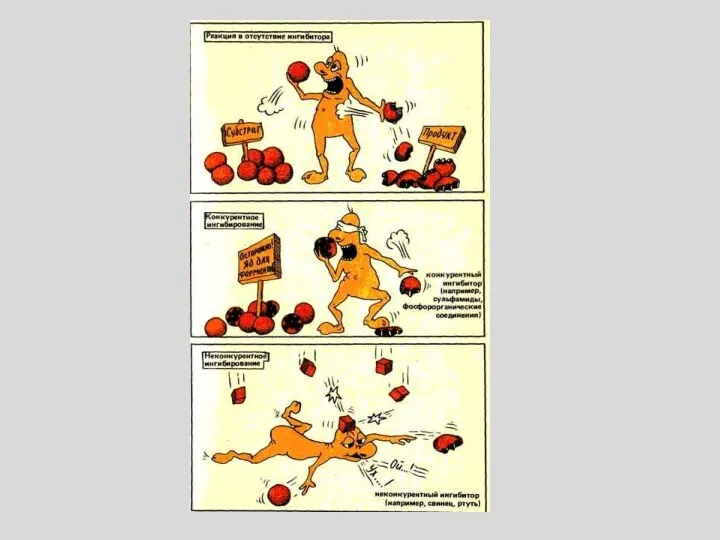
- 43. ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
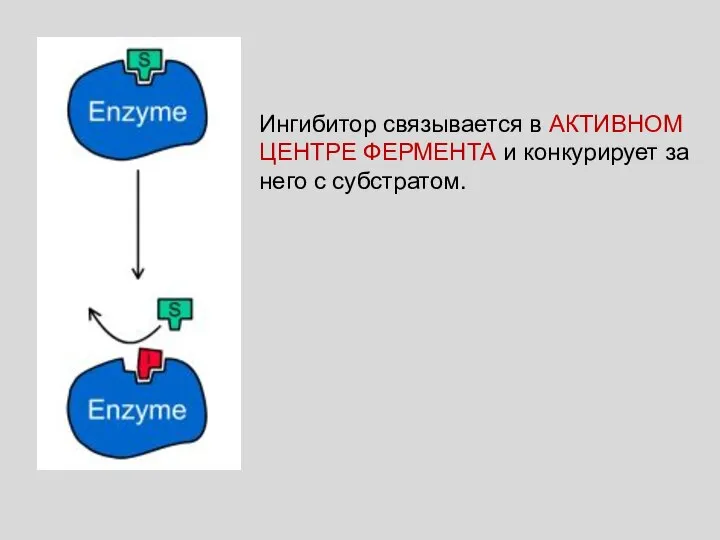
- 45. КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ За активный центр фермента вместе с субстратом конкурирует ИНГИБИТОР Так, малоновая (1), щавелевоуксусная (2)
- 46. Ингибитор связывается в АКТИВНОМ ЦЕНТРЕ ФЕРМЕНТА и конкурирует за него с субстратом.
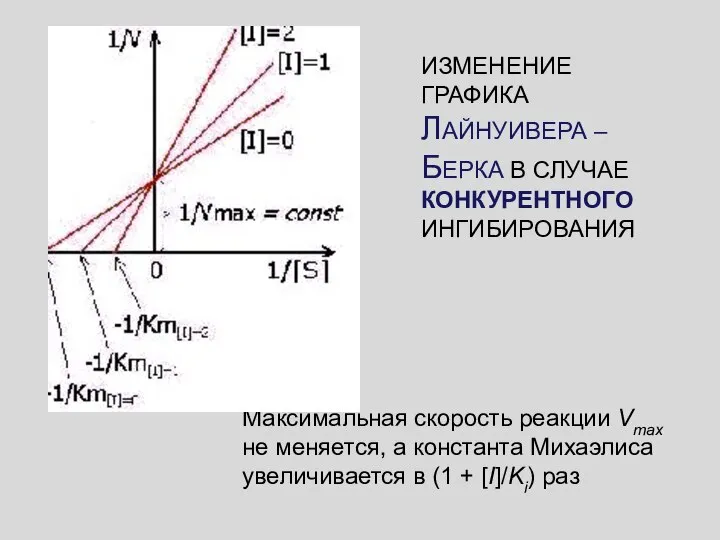
- 47. k1 k-i ki k-1 k2 УРАВНЕНИЕ ЛАЙНУИВЕРА – БЕРКА ДЛЯ КОНКУРЕНТНОГО ИНГИБИРОВАНИЯ - НЕАКТИВНЫЙ КОМПЛЕКС
- 48. ИЗМЕНЕНИЕ ГРАФИКА ЛАЙНУИВЕРА – БЕРКА В СЛУЧАЕ КОНКУРЕНТНОГО ИНГИБИРОВАНИЯ Максимальная скорость реакции Vmax не меняется, а
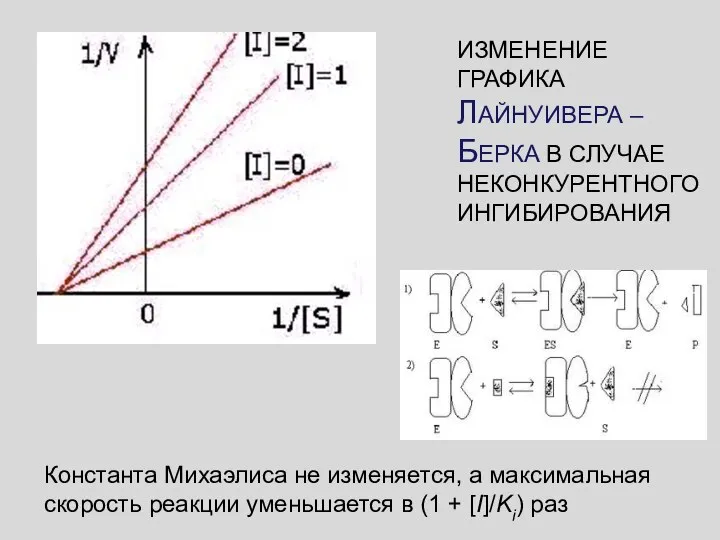
- 49. НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ ИНГИБИТОР связывается с ФЕРМЕНТОМ ВНЕ АКТИВНОГО ЦЕНТРА, но при этом меняется структура активного центра
- 50. ИЗМЕНЕНИЕ ГРАФИКА ЛАЙНУИВЕРА – БЕРКА В СЛУЧАЕ НЕКОНКУРЕНТНОГО ИНГИБИРОВАНИЯ Константа Михаэлиса не изменяется, а максимальная скорость
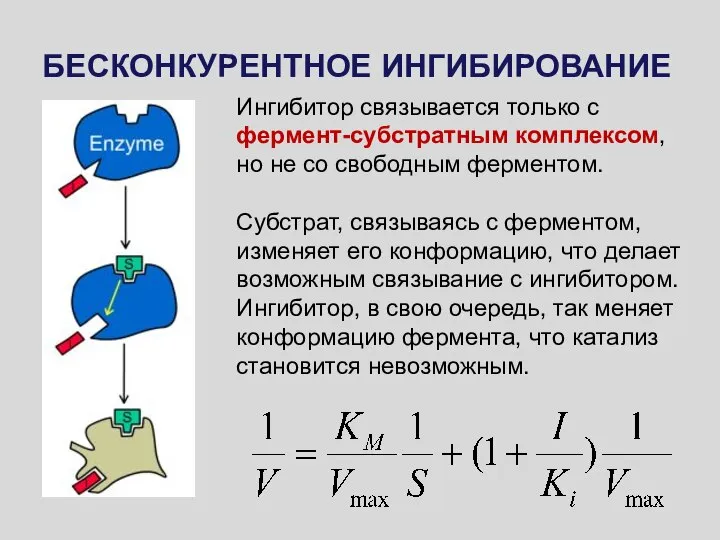
- 51. БЕСКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ Ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с
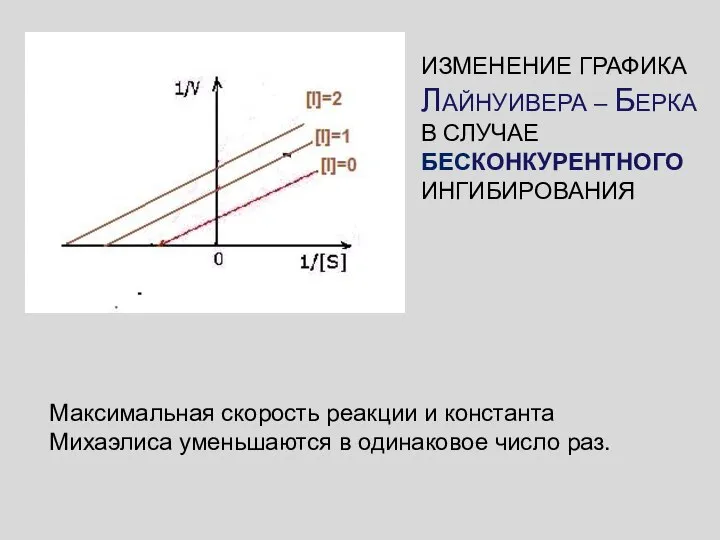
- 52. Максимальная скорость реакции и константа Михаэлиса уменьшаются в одинаковое число раз. ИЗМЕНЕНИЕ ГРАФИКА ЛАЙНУИВЕРА – БЕРКА
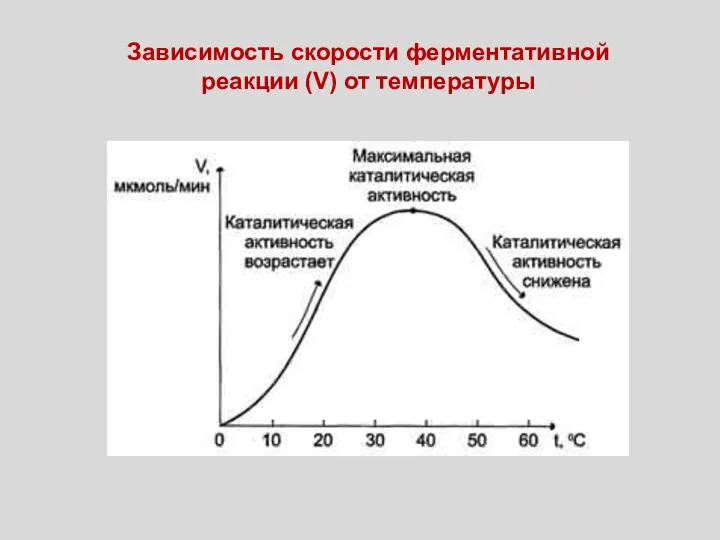
- 53. Зависимость скорости ферментативной реакции (V) от температуры
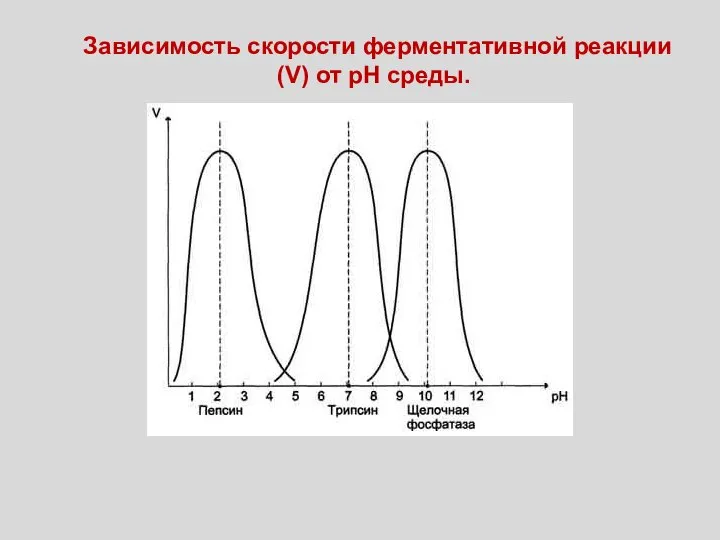
- 54. Зависимость скорости ферментативной реакции (V) от рН среды.
- 56. Скачать презентацию












![lg[Y/1-Y] lg[X] График Хилла для насыщенного кислородом гемоглобина](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302937/slide-27.jpg)








![Зависимость степени насыщения Y активных центров фермента от концентрации субстрата [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302937/slide-37.jpg)







 Технология электромонтажных работ. Символы и обозначения, применяемые в схемах и чертежах
Технология электромонтажных работ. Символы и обозначения, применяемые в схемах и чертежах Россия в начале ХХI века
Россия в начале ХХI века Независимое поведение: объемная конкуренция. Модель Курно. Выполнила студентка 1 курса экономического факультета Редок Полина
Независимое поведение: объемная конкуренция. Модель Курно. Выполнила студентка 1 курса экономического факультета Редок Полина Школы научного управления
Школы научного управления Розборка ноутбука emashines
Розборка ноутбука emashines Территориальное планирование. Терминология
Территориальное планирование. Терминология Приложение производной к исследованию функции
Приложение производной к исследованию функции Методы планирования
Методы планирования Диуретики
Диуретики Жизнь первых людей в раю
Жизнь первых людей в раю Аппаратные средства вычислительной техники
Аппаратные средства вычислительной техники Основные свойства горных пород. Упругость, хрупкость и пластичность пород. Деформационные характеристики пород.д
Основные свойства горных пород. Упругость, хрупкость и пластичность пород. Деформационные характеристики пород.д 我们 去 游泳 好 吗
我们 去 游泳 好 吗 Презентация Место научной подготовки специалиста в новой образовательной парадигме
Презентация Место научной подготовки специалиста в новой образовательной парадигме Грамматика, как раздел языкознания
Грамматика, как раздел языкознания Современные школы и направления в теории международных отношений. (Лекции 4-5)
Современные школы и направления в теории международных отношений. (Лекции 4-5) А.М. Новиков Д.А. Новиков МЕТОДОЛОГИЯ (ПРЕДМЕТ И ОСНОВАН
А.М. Новиков Д.А. Новиков МЕТОДОЛОГИЯ (ПРЕДМЕТ И ОСНОВАН Определение ОЦТ аналитическим способом
Определение ОЦТ аналитическим способом О требованиях федерального законодательства к печатным и сетевым СМИ
О требованиях федерального законодательства к печатным и сетевым СМИ Синдром коронарной недостаточности
Синдром коронарной недостаточности Положение о наставничестве АО «ОДК-СТАР»
Положение о наставничестве АО «ОДК-СТАР» Системы парового отопления
Системы парового отопления Основы построения диаграмм. - презентация
Основы построения диаграмм. - презентация Понятие международной конкурентоспособности. Основные факторы конкурентоспособности страны Петрова В.О. Бондарева Е.Д.
Понятие международной конкурентоспособности. Основные факторы конкурентоспособности страны Петрова В.О. Бондарева Е.Д. Ерденевская средняя школа Ляшенко Ольга Юрьевна 2006 год
Ерденевская средняя школа Ляшенко Ольга Юрьевна 2006 год Экономика стран Европейского региона
Экономика стран Европейского региона Бытовая химия для дома Clean Home
Бытовая химия для дома Clean Home My idol Tetyukhin Sergey
My idol Tetyukhin Sergey