Содержание
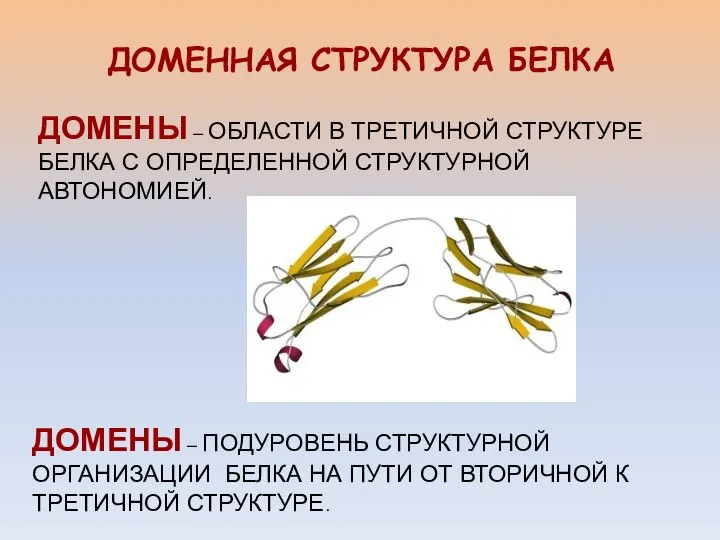
- 2. ДОМЕННАЯ СТРУКТУРА БЕЛКА ДОМЕНЫ – ОБЛАСТИ В ТРЕТИЧНОЙ СТРУКТУРЕ БЕЛКА С ОПРЕДЕЛЕННОЙ СТРУКТУРНОЙ АВТОНОМИЕЙ. ДОМЕНЫ –
- 3. ВПЕРВЫЕ ДОМЕННАЯ СТРУКТУРА ПОКАЗАНА НА ПРИМЕРЕ ЛИЗОЦИМА, ИММУНОГЛОБУЛИНОВ, ХИМОТРИПСИНА, ПАПАИНА И ДР. Домены в структуре протеолитического
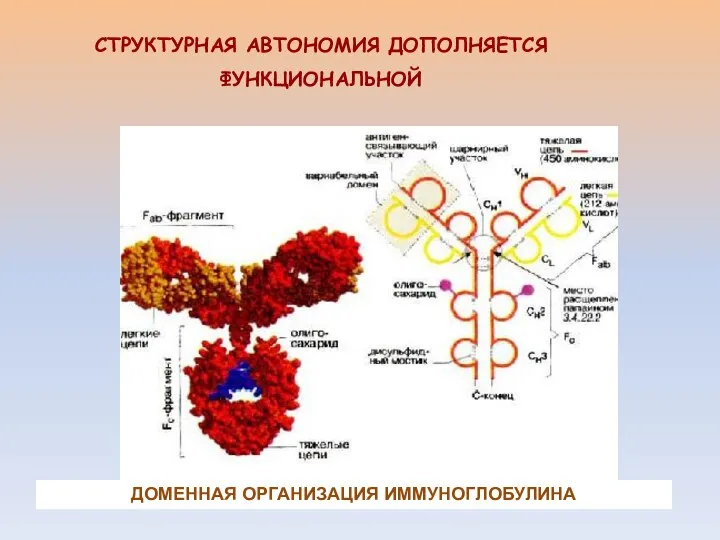
- 4. СТРУКТУРНАЯ АВТОНОМИЯ ДОПОЛНЯЕТСЯ ФУНКЦИОНАЛЬНОЙ ДОМЕННАЯ ОРГАНИЗАЦИЯ ИММУНОГЛОБУЛИНА
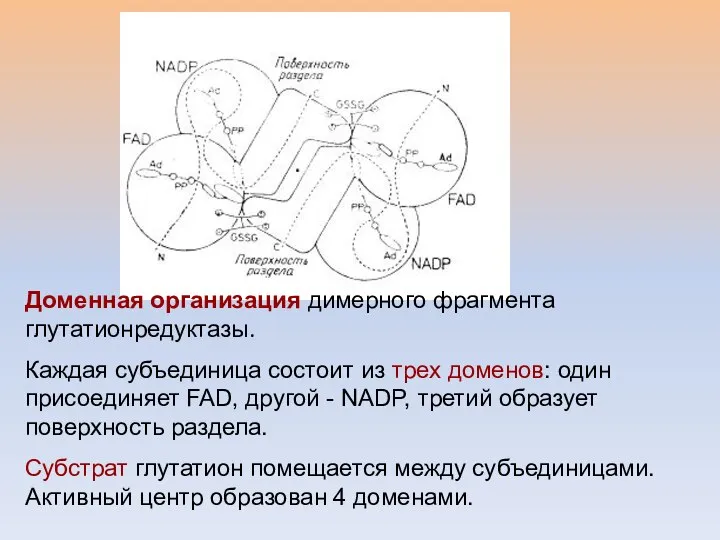
- 5. Доменная организация димерного фрагмента глутатионредуктазы. Каждая субъединица состоит из трех доменов: один присоединяет FAD, другой -
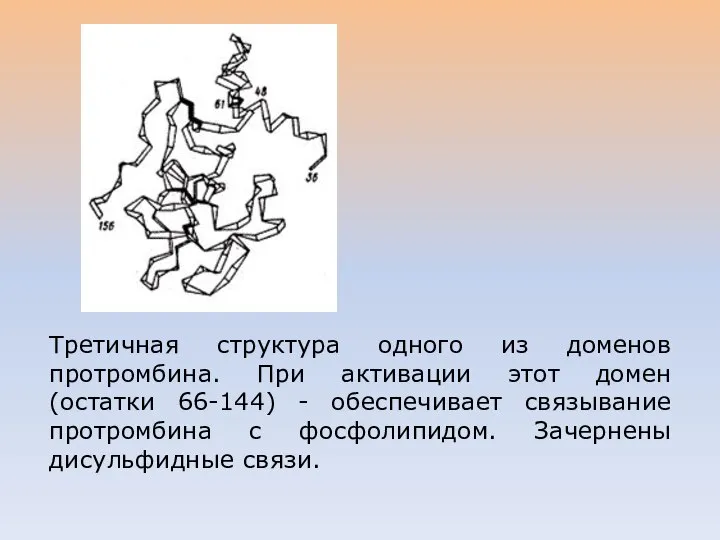
- 6. Третичная структура одного из доменов протромбина. При активации этот домен (остатки 66-144) - обеспечивает связывание протромбина
- 7. РАЗЛИЧАЮТ ДВА ВИДА ДОМЕНОВ (Д.УЕТЛАУФЕР) С НЕПРЕРЫВНОЙ ПОЛИПЕПТИДНОЙ ЦЕПЬЮ С РАЗРЫВНОЙ ПОЛИПЕПТИДНОЙ ЦЕПЬЮ ОБЛАСТЬ, ОБЪЕДИНЯЮЩАЯ ДОМЕНЫ
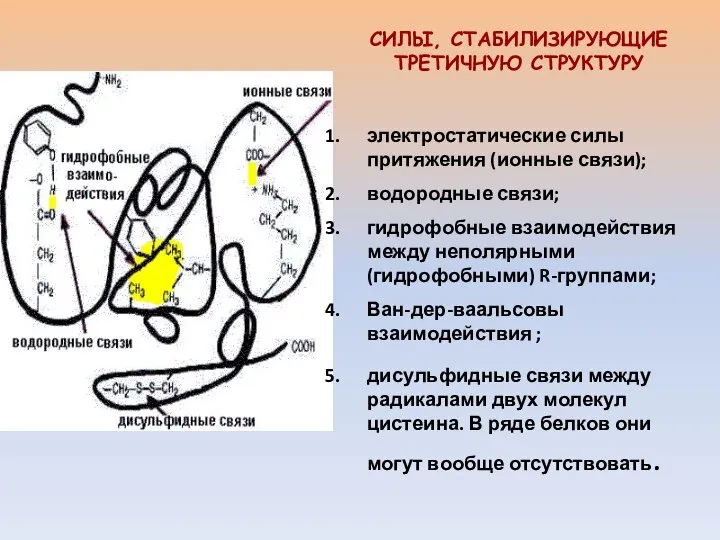
- 8. ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА И СИЛЫ, ЕЁ СТАБИЛИЗИРУЮЩИЕ
- 9. Третичная структура белка - пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
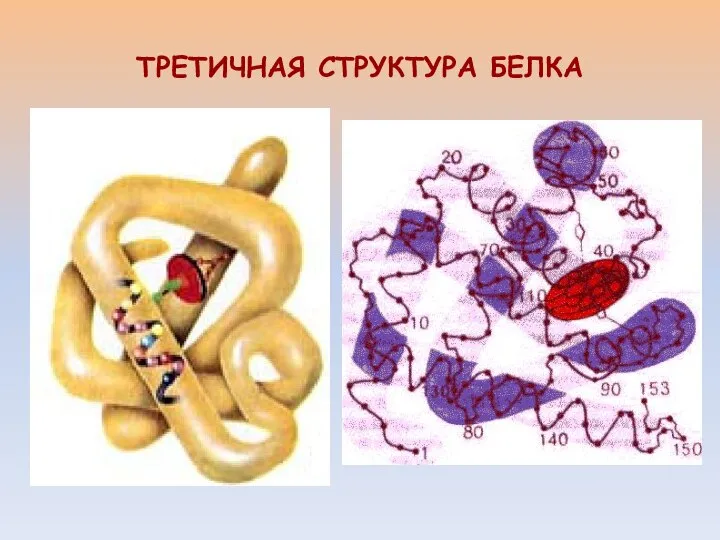
- 10. ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА
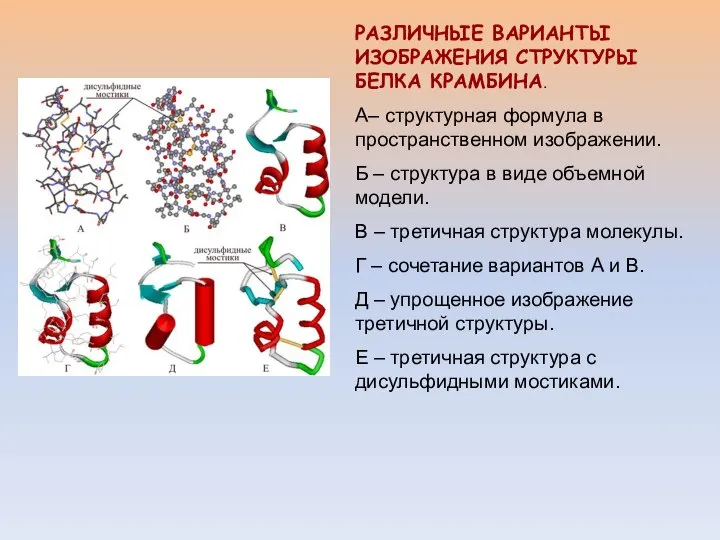
- 11. РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА. А– структурная формула в пространственном изображении. Б – структура в
- 12. электростатические силы притяжения (ионные связи); водородные связи; гидрофобные взаимодействия между неполярными (гидрофобными) R-группами; Ван-дер-ваальсовы взаимодействия ;
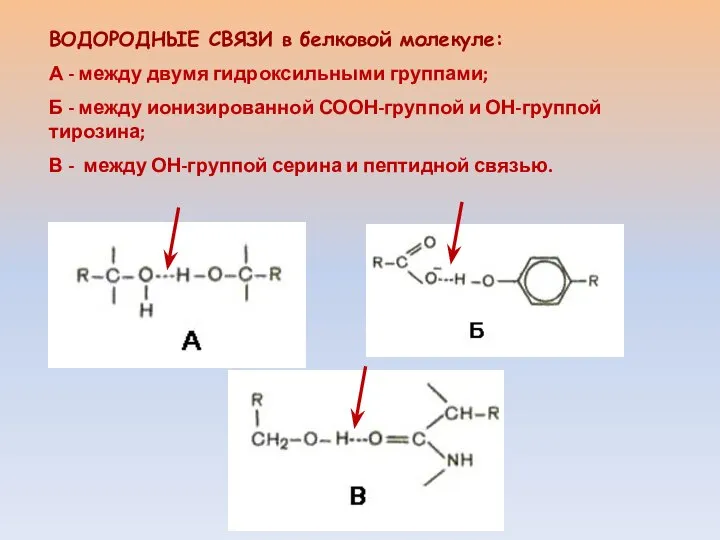
- 13. ВОДОРОДНЫЕ СВЯЗИ в белковой молекуле: А - между двумя гидроксильными группами; Б - между ионизированной СООН-группой
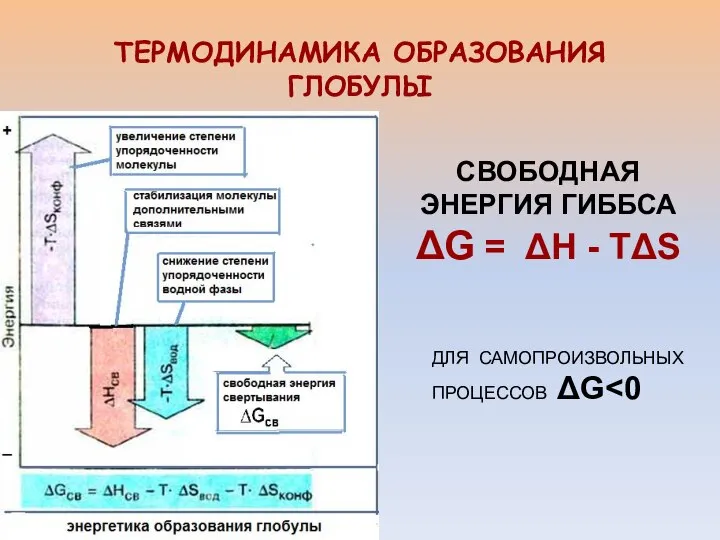
- 14. ДЛЯ САМОПРОИЗВОЛЬНО ПРОТЕКАЮЩИХ ПРОЦЕССОВ ΔG ВЫГОДНО УМЕНЬШЕНИЕ ЭНТАЛЬПИИ или УВЕЛИЧЕНИЕ ЭНТРОПИИ. ОБРАЗОВАНИЕ СВЯЗЕЙ →ЭНТАЛЬПИЯ СНИЖАЕТСЯ РАЗРЫВ
- 15. При свертывании белковой глобулы выигрыша в числе водородных связей не происходит, т к одновременно утрачиваются водородные
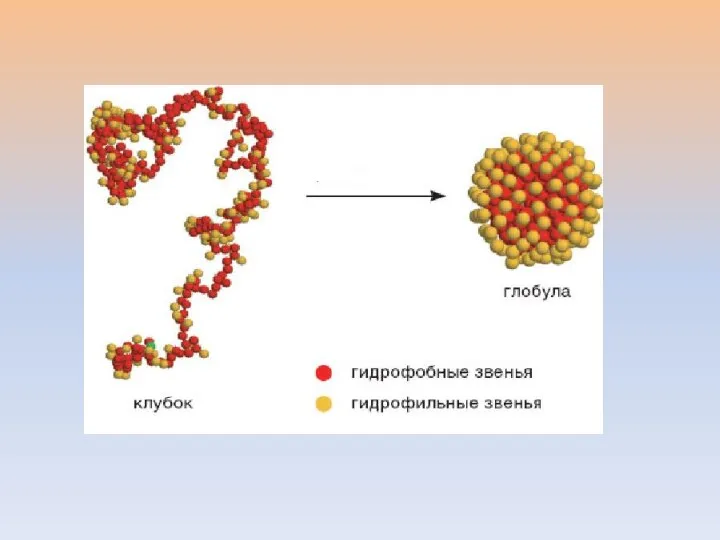
- 16. ТЕРМОДИНАМИКА ОБРАЗОВАНИЯ ГЛОБУЛЫ СВОБОДНАЯ ЭНЕРГИЯ ГИББСА ΔG = ΔH - TΔS ДЛЯ САМОПРОИЗВОЛЬНЫХ ПРОЦЕССОВ ΔG
- 17. СТЕПЕНЬ ГИДРОФОБНОСТИ АМИНОКИСЛОТЫ ОПРЕДЕЛЯЮТ ПО РАЗНОСТИ СВОБОДНЫХ ЭНЕРГИЙ ЕЕ РАСТВОРЕНИЯ В СЛАБОПОЛЯРНОМ РАСТВОРИТЕЛЕ И ВОДЕ ГИДРОФОБНЫЕ
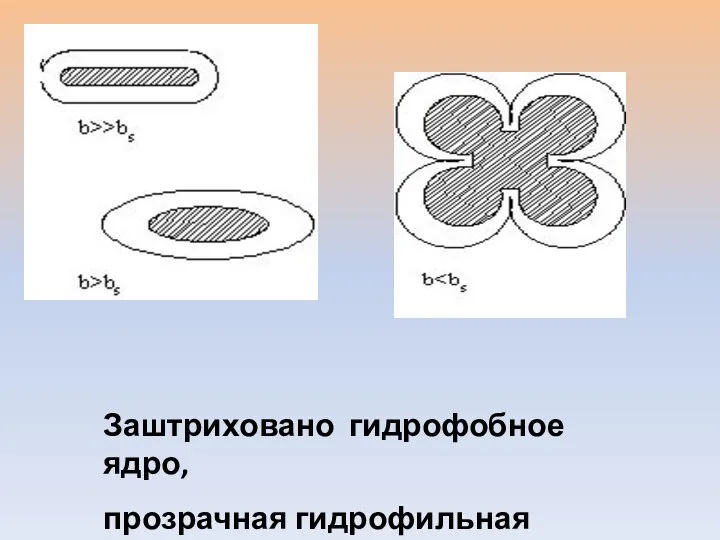
- 19. В 1964 году Фишер установил, что, зная общее число аминокислотных остатков в ядре и отношение полярных
- 20. Заштриховано гидрофобное ядро, прозрачная гидрофильная оболочка
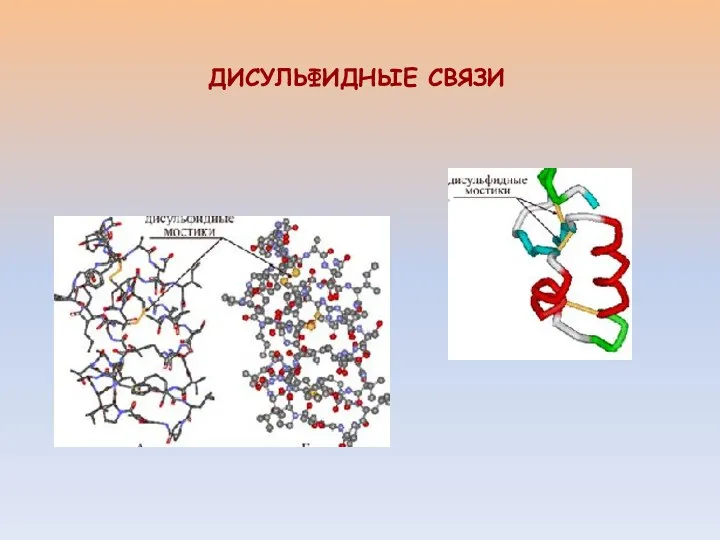
- 21. ДИСУЛЬФИДНЫЕ СВЯЗИ
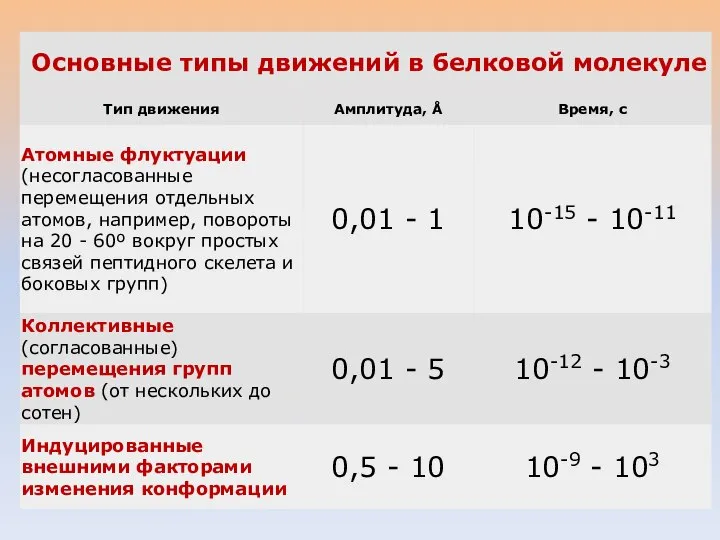
- 22. ОСНОВНЫЕ ТИПЫ ДВИЖЕНИЙ В БЕЛКОВОЙ МОЛЕКУЛЕ
- 24. Гидрофильные остатки не полностью покрывают гидрофобное ядро, что приводит к образованию надмолекулярных структур. ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА
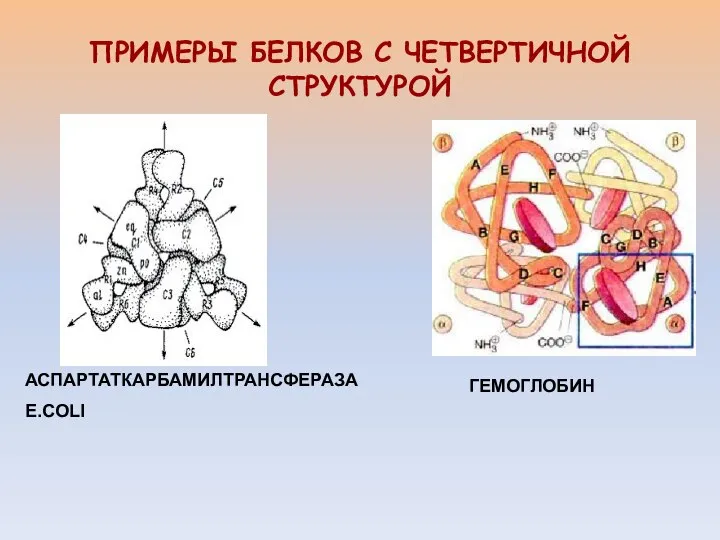
- 25. ГЕМОГЛОБИН ПРИМЕРЫ БЕЛКОВ С ЧЕТВЕРТИЧНОЙ СТРУКТУРОЙ АСПАРТАТКАРБАМИЛТРАНСФЕРАЗА E.COLI
- 26. РОЛЬ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ АРХИТЕКТУРНАЯ ФУНКЦИЯ ОБЕСПЕЧЕНИЕ МНОЖЕСТВЕННЫХ ВЗАИМОДЕЙСТВИЙ БЕЛКА С ПРОТЯЖЕННЫМИ СТРУКТУРАМИ РЕГУЛЯТОРНАЯ ФУНКЦИЯ ОБЪЕДИНЕНИЕ НЕСКОЛЬКИХ
- 27. САМООРГАНИЗАЦИЯ БЕЛКА Аминокислотная последовательность сама (при подходящей температуре и рН среды) определяет пространственную структуру белка —
- 28. Несмотря на громадное число теоретически возможных для отдельной аминокислотной последовательности пространственных структур, сворачивание каждого белка приводит
- 29. Каждый ако имеет около 10 возможных конформаций. Цепь из 100 ако – порядка 10100 возможных конформаций.
- 30. С одной стороны, нативная пространственная структура ведет себя как самая стабильная из всех существующих структур цепи:
- 31. С.Левинталь предположил, что нативная структура белка определяется не стабильностью, не термодинамикой, а кинетикой, т.е. она соответствует
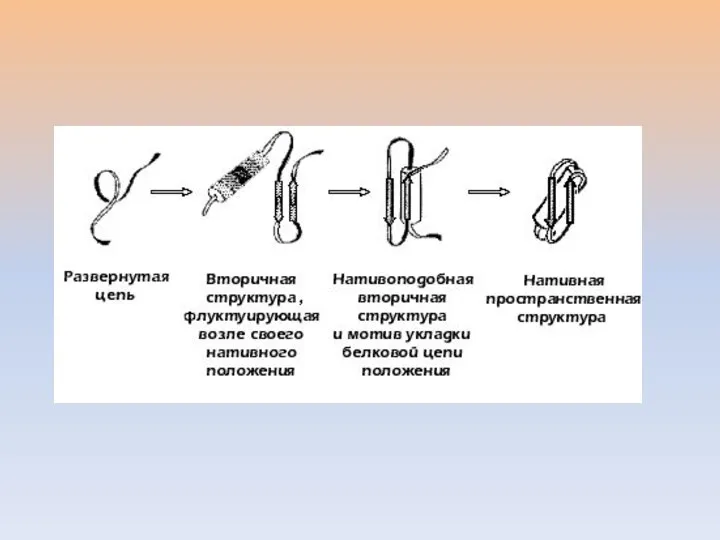
- 32. КОНЦЕПЦИЯ СТАДИЙНОГО СВОРАЧИВАНИЯ БЕЛКА О.Б.ПТИЦЫНА (1973) (концепция каркасной модели)
- 33. Очень быстрое формирование элементов вторичной структуры, служащих как бы "затравками" для образования более сложных архитектурных мотивов
- 34. Специфическая ассоциация некоторых элементов вторичной структуры с образованием супервторичной структуры: сочетания нескольких α-спиралей, нескольких β-цепей либо
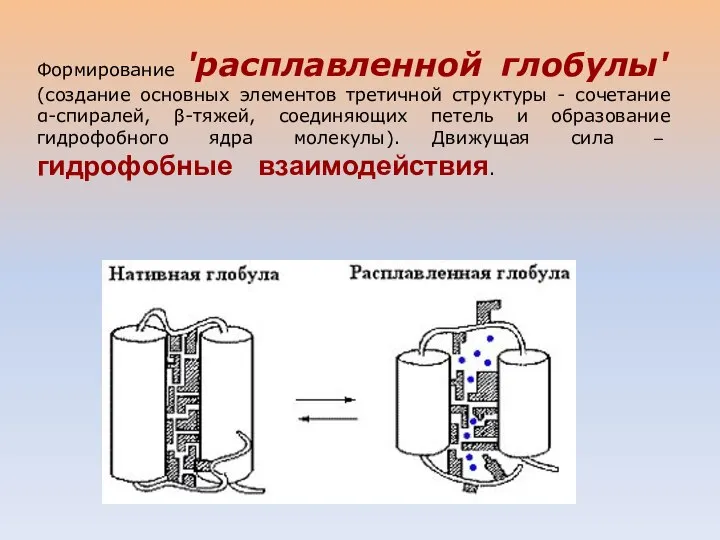
- 35. Формирование 'расплавленной глобулы' (создание основных элементов третичной структуры - сочетание α-спиралей, β-тяжей, соединяющих петель и образование
- 36. Формирование нативной структуры белка ЕЕ ОБЕСПЕЧИВАЮТ Вандерваальсовы силы Водородные связи Ионные связи
- 38. ВНУТРИКЛЕТОЧНАЯ РЕГУЛЯЦИЯ ФОРМИРОВАНИЯ ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ БЕЛКА
- 39. ФЕРМЕНТЫ, УСКОРЯЮЩИЕ ПРОЦЕСС СВОРАЧИВАНИЯ
- 40. Транс-конформация более стабильна, она преобладает во вновь синтезированной полипептидной цепи. Для образования нативной структуры белка необходимо,
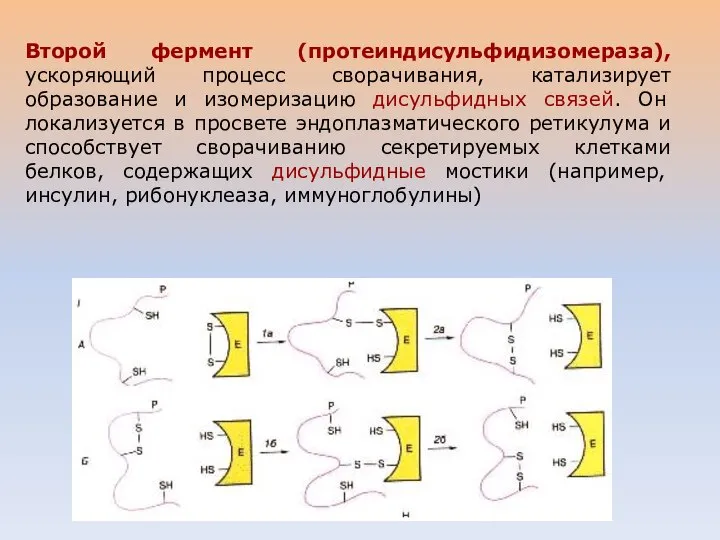
- 41. Второй фермент (протеиндисульфидизомераза), ускоряющий процесс сворачивания, катализирует образование и изомеризацию дисульфидных связей. Он локализуется в просвете
- 42. ШАПЕРОНЫ И ШАПЕРОНИНЫ
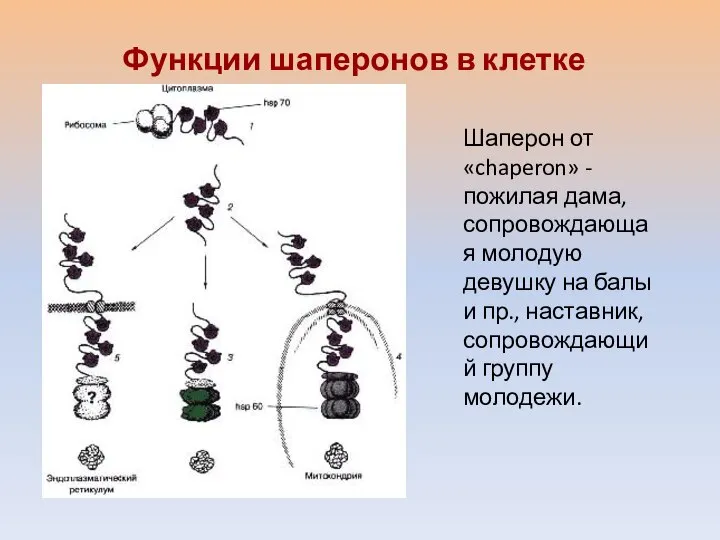
- 43. Функции шаперонов в клетке Шаперон от «chaperon» - пожилая дама, сопровождающая молодую девушку на балы и
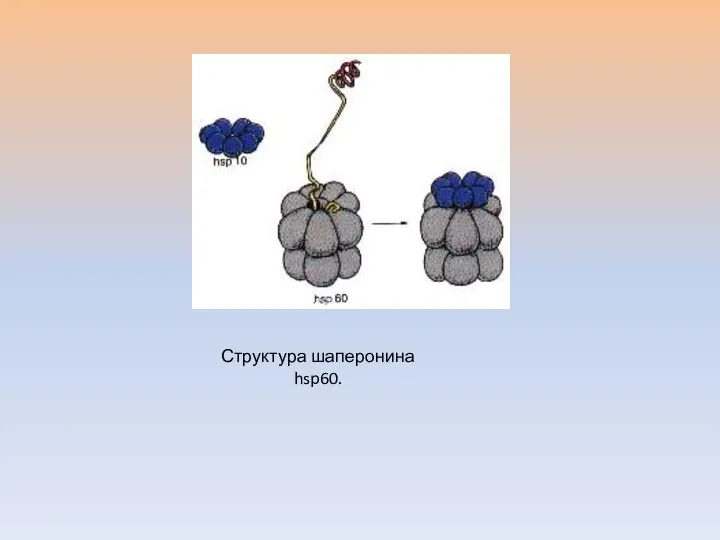
- 44. Структура шаперонина hsp60.
- 46. Скачать презентацию
























 Чемпионат мира по футболу
Чемпионат мира по футболу Конференция для менеджеров
Конференция для менеджеров День пожелого человека - презентация для начальной школы
День пожелого человека - презентация для начальной школы Виды и структуры знаний, отражаемые в языке
Виды и структуры знаний, отражаемые в языке Найнезвичайніші споруди світу
Найнезвичайніші споруди світу Операции арифметические, сравнения, логические и поразрядные. Лекция 10
Операции арифметические, сравнения, логические и поразрядные. Лекция 10 Способы увеличения протяженности акустического канала утечки информации
Способы увеличения протяженности акустического канала утечки информации С чего начинается поход?
С чего начинается поход? Воспитание физических способностей, качеств
Воспитание физических способностей, качеств Своя среди чужих, чужой среди своих: Маша против Лунтика. Упражнение в культурологическом анализе
Своя среди чужих, чужой среди своих: Маша против Лунтика. Упражнение в культурологическом анализе Урок алгебры в 9 классе Бовина Ольга Кузьминична учитель математики МОУ «СОШ
Урок алгебры в 9 классе Бовина Ольга Кузьминична учитель математики МОУ «СОШ  16 грипп лекц.ppt
16 грипп лекц.ppt Презентация Институциональная система таможенного союза
Презентация Институциональная система таможенного союза Климатические факторы, влияющие на проектирование зданий и сооружений
Климатические факторы, влияющие на проектирование зданий и сооружений Последующие поколения компьютеров
Последующие поколения компьютеров Презентация на тему "Теоретические и методологические основы изучения и распространения передового педагогического опыта" -
Презентация на тему "Теоретические и методологические основы изучения и распространения передового педагогического опыта" - Средства измерения с механическим преобразованием. Индикаторы. Рычажно-зубчатые измерительные головки
Средства измерения с механическим преобразованием. Индикаторы. Рычажно-зубчатые измерительные головки Право потребителя на качество услуг общественного питания
Право потребителя на качество услуг общественного питания Chciałem poznać nowy Świat
Chciałem poznać nowy Świat Презентация Правовая теория Ч. Беккариа
Презентация Правовая теория Ч. Беккариа Практика в ООО ТЕКОМ. Тестирование
Практика в ООО ТЕКОМ. Тестирование Трехфазные и специальные трансформаторы
Трехфазные и специальные трансформаторы Ахматова Анна Андреевна (урожденная Горенко; 11 июня 1889, Одесса — 5 марта 1966)
Ахматова Анна Андреевна (урожденная Горенко; 11 июня 1889, Одесса — 5 марта 1966) Политология как наука. Возникновение и развитие политики, политических учений и политической науки: концепции власти
Политология как наука. Возникновение и развитие политики, политических учений и политической науки: концепции власти Права, обязанности и ответственность несовершеннолетних
Права, обязанности и ответственность несовершеннолетних Организации складского хозяйства
Организации складского хозяйства Презентация "Перспектива" - скачать презентации по МХК
Презентация "Перспектива" - скачать презентации по МХК Причіпні пожежні мотопомпи. Експлуатація мотопомп
Причіпні пожежні мотопомпи. Експлуатація мотопомп