Содержание
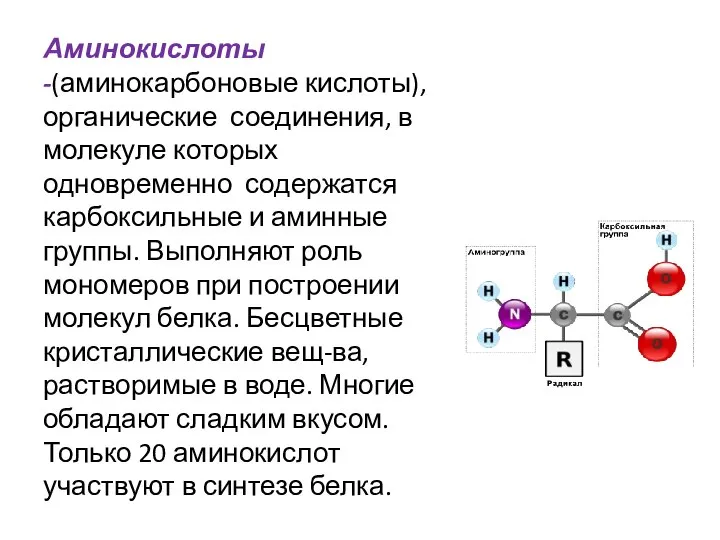
- 2. Аминокислоты -(аминокарбоновые кислоты), органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Выполняют роль
- 3. Варианты классификации аминокислот: В зависимости от положения аминогруппы (альфа-аминокислоты,бета-аминокислоты) По конфигурации молекулы- L и D-изомеры. По
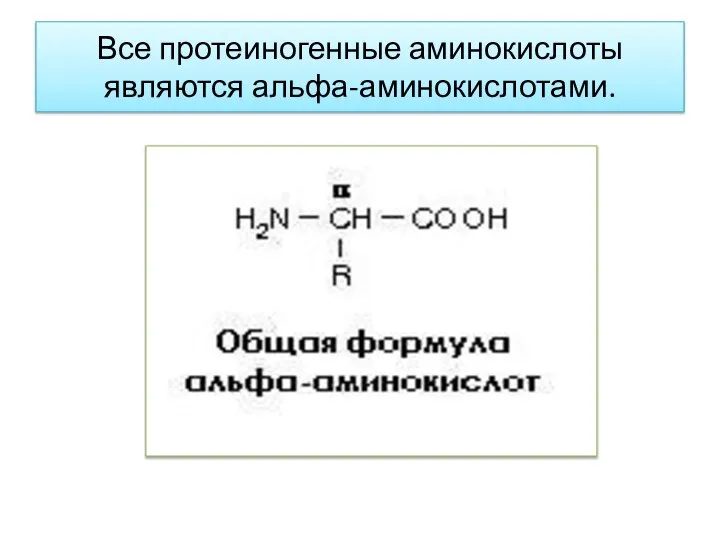
- 4. Все протеиногенные аминокислоты являются альфа-аминокислотами.
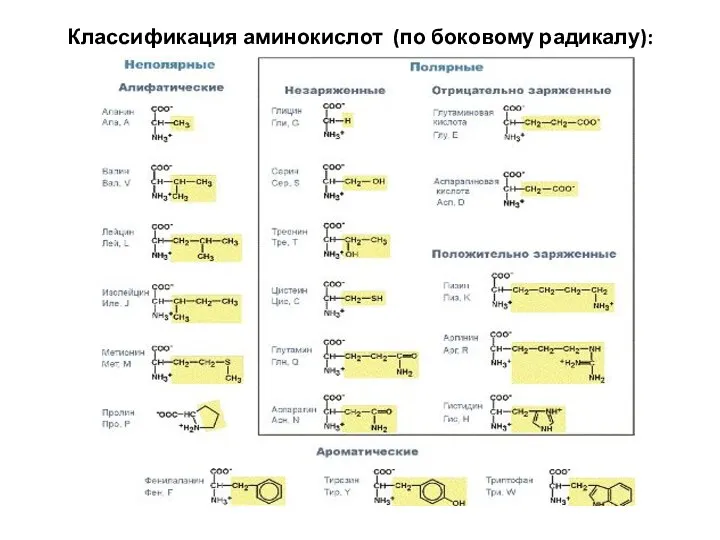
- 5. Классификация аминокислот (по боковому радикалу):
- 6. Незаменимые: лейцин (ЛЕЙ, L), изолейцин (ИЛЕ, J), валин (ВАЛ,V), фенилаланин (ФЕН, F), триптофан (ТРИ, W), треонин
- 7. Отдельные представители аминокислот и их свойства. Алифатические: Глицин(ГЛИ), или гликокол, аминоуксусная кислота. Единственная оптически неактивная. Участвует
- 8. Серосодержащие: Цистеин (ЦИС) -благодаря активной группе –SH легко вступает в окислительно-восстановительные реакции, защищая клетку от действия
- 9. Содержащие -ОН группу (гидроксиаминокислоты) Группа -ОН легко взаимодействует с фосфорной кислотой , что бывает необходимо для
- 10. Отдельно рассматривается пролин (ПРО) Не соответствует общей формуле аминокислот. Входит в структуру коллагена.
- 11. Общие свойства аминокислот. Кислотноосновные свойства аминокислот определяют многие свойства белков.Все аминокислоты-амфотерные соединения , они могут проявлять
- 12. Реакция поликонденсации с образованием пептидной связи.
- 13. Получают аминокислоты гидролизом белков или с помощью химических реакций в присутствии катализатора.
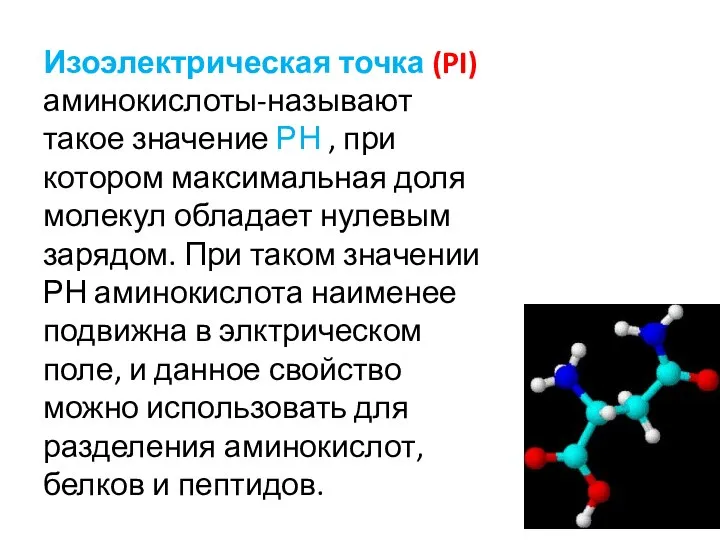
- 14. Изоэлектрическая точка (PI) аминокислоты-называют такое значение РН , при котором максимальная доля молекул обладает нулевым зарядом.
- 15. Биологическое значение аминокислот. Входят в состав белков и пептидов. Образуют биол. активные вещества (биогенные амины). Часть
- 16. Стереохимия аминокислот. Некоторые вещества существуют в двух изомерных формах L(levo-левый) и D(dextro-правый), молекулы которых представляют собой
- 17. Пептиды (от греч. “питательный”) – семейство веществ, молекулы которых построены из остатков альфа-аминокислот, соединённых в цепь
- 18. На сегодняшний день известно > 1500 видов пептидов. Пептиды постоянно синтезируются во всех живых организмах. Свойства
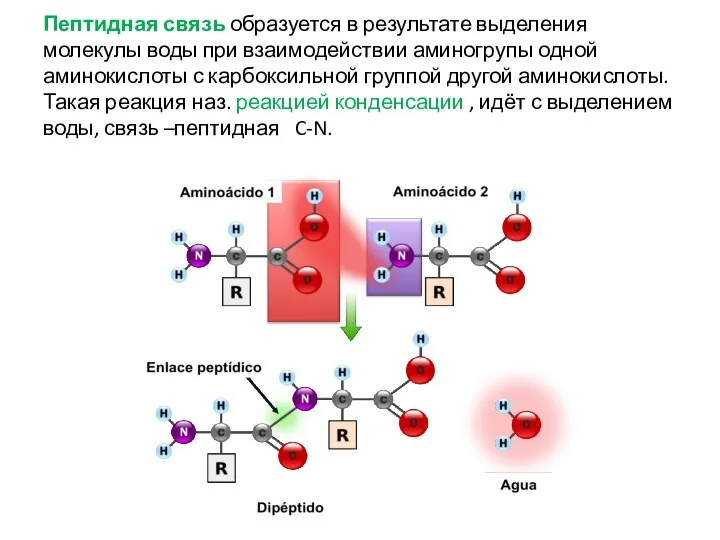
- 19. Пептидная связь образуется в результате выделения молекулы воды при взаимодействии аминогрупы одной аминокислоты с карбоксильной группой
- 20. Классификация пептидов. Их биологическая роль. Группа пептидов, содержащих глутаминовую кислоту, образующих пептидную связь своей гамма-карбоксильной группой.
- 21. 5. Пептиды-нейромедиаторы-существуют группы нейронов, связанных между собой молекулами-посредниками пептидной природы (“субстанция Р”). 6. Нейропептиды –секретируются нервными
- 23. Скачать презентацию















 Специфика технологии как товара
Специфика технологии как товара Стратегические направления Стратегическое видение Миссия SWOT - анализ
Стратегические направления Стратегическое видение Миссия SWOT - анализ  Поэзия С.А. Клычкова
Поэзия С.А. Клычкова РЕФЕРАТ НА ТЕМУ: «Московский метрополитен как памятник архитектуры » . Группа РГ-08-6
РЕФЕРАТ НА ТЕМУ: «Московский метрополитен как памятник архитектуры » . Группа РГ-08-6 Контрабанда в Дальневосточном таможенном управлении
Контрабанда в Дальневосточном таможенном управлении Александр Сергеевич Пушкин (1799 - 1837)
Александр Сергеевич Пушкин (1799 - 1837) РАЗВИТИЕ ПОЗНАВАТЕЛЬНЫХ ПРОЦЕССОВ И ИГРОВОЙ ДЕЯТЕЛЬНОСТИ В ДОШКОЛЬНОМ ВОЗРАСТЕ
РАЗВИТИЕ ПОЗНАВАТЕЛЬНЫХ ПРОЦЕССОВ И ИГРОВОЙ ДЕЯТЕЛЬНОСТИ В ДОШКОЛЬНОМ ВОЗРАСТЕ Макияж тигра - презентация для начальной школы_
Макияж тигра - презентация для начальной школы_ Что такое йога
Что такое йога Презентация____
Презентация____ Рождество Христово
Рождество Христово Устойчивость оболочек
Устойчивость оболочек Проблемы материи в истории философии
Проблемы материи в истории философии Презентация "Инвестиционный банк – посредник между эмитентом и рынком" - скачать презентации по Экономике
Презентация "Инвестиционный банк – посредник между эмитентом и рынком" - скачать презентации по Экономике История
История ДИФФЕРЕНЦИАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ (ПОНЯТИЯ И СУЩНОСТЬ)
ДИФФЕРЕНЦИАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ (ПОНЯТИЯ И СУЩНОСТЬ)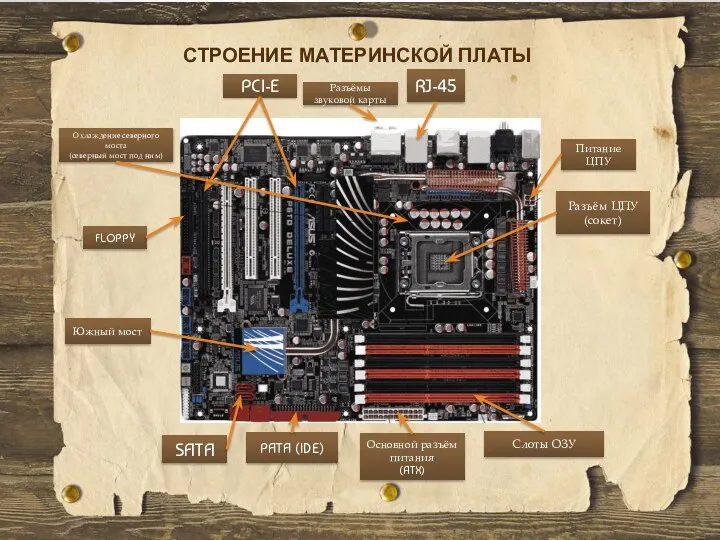 Строение материнской платы
Строение материнской платы Разработка металлических ювелирных и декоративных изделий «Jewelry & paste»
Разработка металлических ювелирных и декоративных изделий «Jewelry & paste» DeVita Ritm base - цифровое устройство оздоровления
DeVita Ritm base - цифровое устройство оздоровления Правовые основы деятельности международных спортивных организаций и олимпийских игр
Правовые основы деятельности международных спортивных организаций и олимпийских игр Презентация Киотская конвенция
Презентация Киотская конвенция Сортоводство лесных древесных пород
Сортоводство лесных древесных пород Языки программирования
Языки программирования Коробка передач на ВАЗ-2106
Коробка передач на ВАЗ-2106 Трещины на торце вала верхнего рулевого управления. LADA 4x4
Трещины на торце вала верхнего рулевого управления. LADA 4x4 第二课 《汉语口语速成 基础 篇》 吃点什么 作者 支悠儿
第二课 《汉语口语速成 基础 篇》 吃点什么 作者 支悠儿 Мақтаншақ бұлақ
Мақтаншақ бұлақ Однофазные линейные электрические цепи синусоидального тока. Элементы цепи. Мощность. Резонанс
Однофазные линейные электрические цепи синусоидального тока. Элементы цепи. Мощность. Резонанс