Содержание
- 2. Функции белков. Как формируется молекула белка?
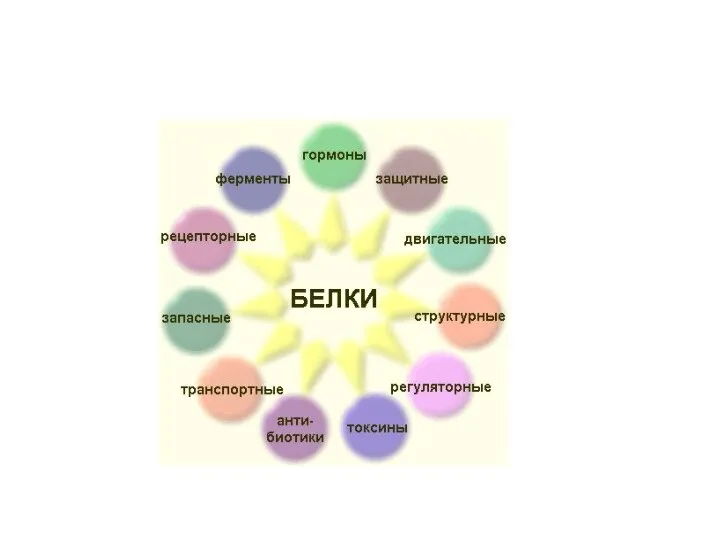
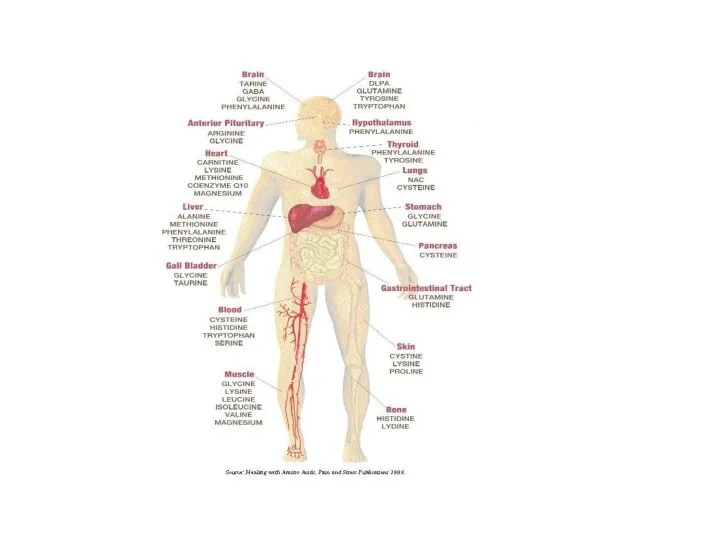
- 3. Белок-последовательность аминокислот, связанных друг с другом пептидными связями. Функции белков: 1. Структурная (пластическая). Белки формируют все
- 4. 3. Белки-гормоны. 50% гормонов человека-белки. Инсулин- регулирует потребление глюкозы, вазопрессин- стимулирует обратное всасывание воды почками. 4.
- 5. 6. Рецепторная. С помощью белков-рецепторов происходит связывание различных биорегуляторов (гормонов, медиаторов, биогенных аминов...). 7. Сократитительная. Актин,
- 6. 11. Создание биопотенциалов мембран клеток и мембран митохондрий. 12. Геннорегуляторная функция-биосинтез белка в клетке. 13. Белки-
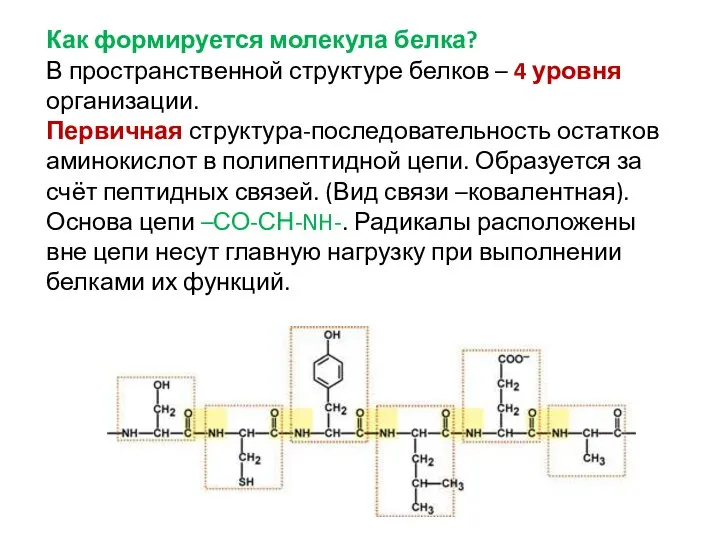
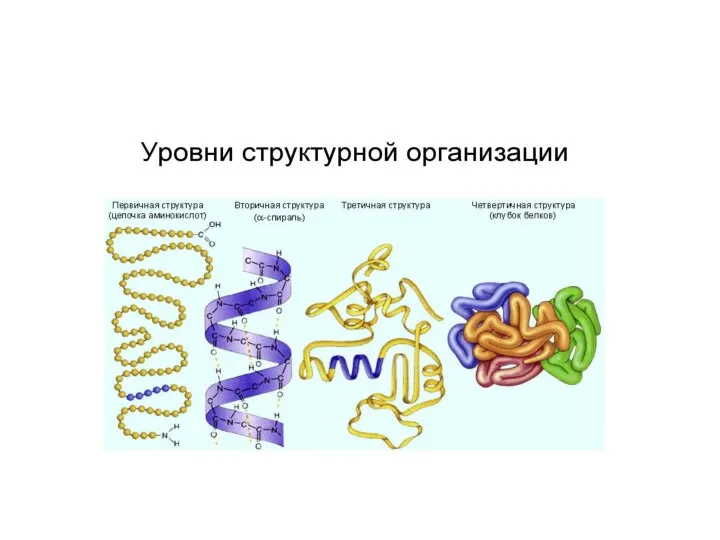
- 9. Как формируется молекула белка? В пространственной структуре белков – 4 уровня организации. Первичная структура-последовательность остатков аминокислот
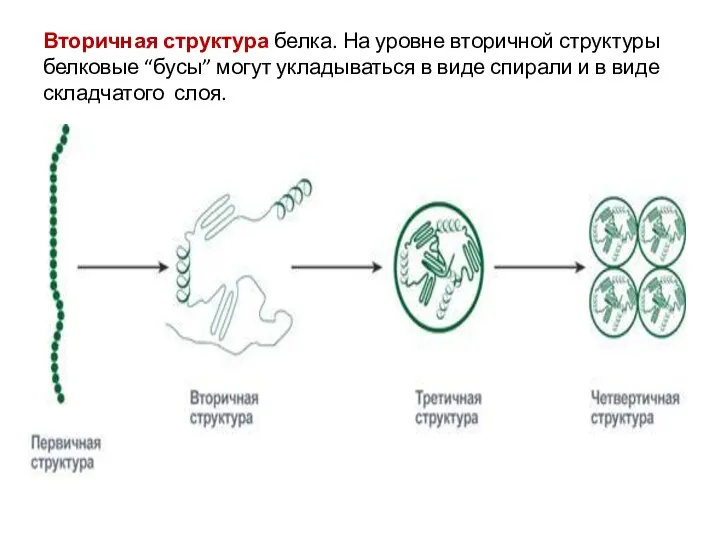
- 10. Вторичная структура белка. На уровне вторичной структуры белковые “бусы” могут укладываться в виде спирали и в
- 11. Вторичная укладка происходит только за счёт водородных связей –N-H......O=C- Два варианта укладки цепи: Альфа- спираль (альфа-структура).
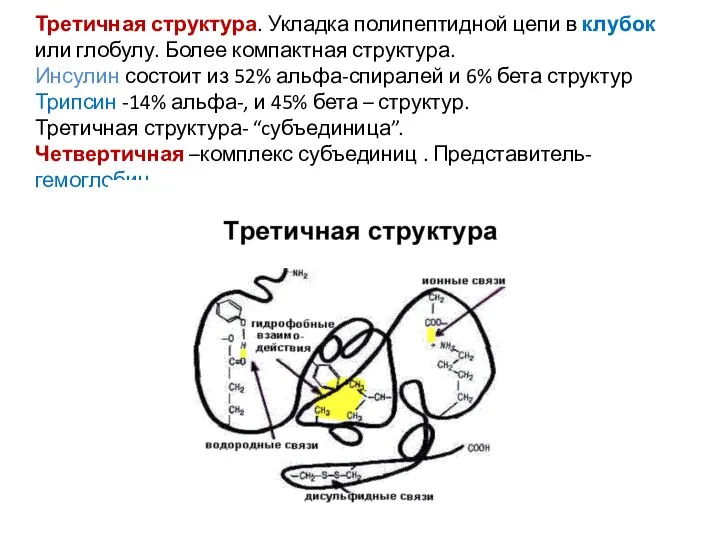
- 12. Третичная структура. Укладка полипептидной цепи в клубок или глобулу. Более компактная структура. Инсулин состоит из 52%
- 14. Виды химических связей, формирующих структуру белка: Водородные-между НО-, COOH-, NH2- группами. Гидрофобные-между остатками алифатических и ароматических
- 15. Единица измерения массы белковой молекулы - Дальтон. (Джон Дальтон, 1766-1844), англ. ученый- ввел понятие –”единица атомной
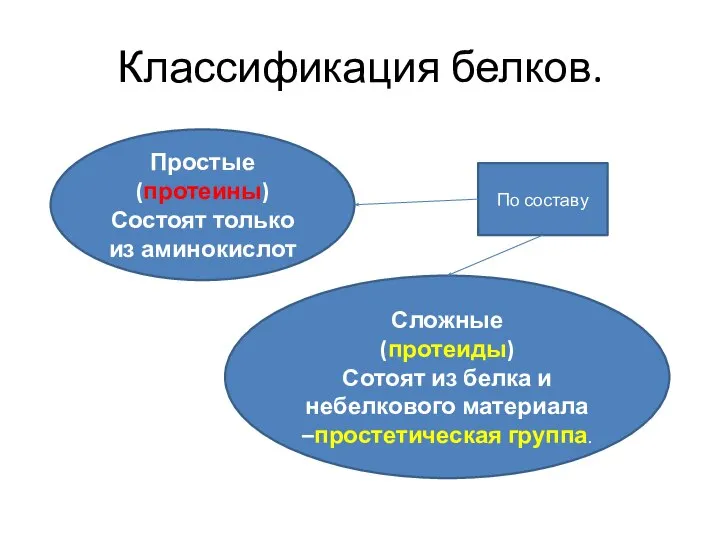
- 16. Классификация белков. Простые (протеины) Состоят только из аминокислот Сложные (протеиды) Сотоят из белка и небелкового материала
- 17. Простые (протеины).
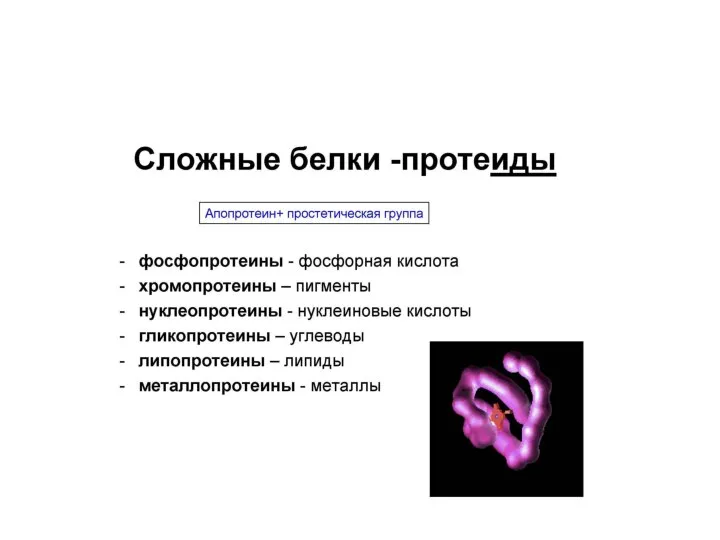
- 19. Сложные белки –протеиды. (Белок +простетическая группа).
- 20. Классификация белков по структуре.
- 21. Волокнистый актин (белок, фибриллярная форма которого образует с миозином мышц сократительный элемент – актомиозин , увеличение
- 22. Физические свойства белков.
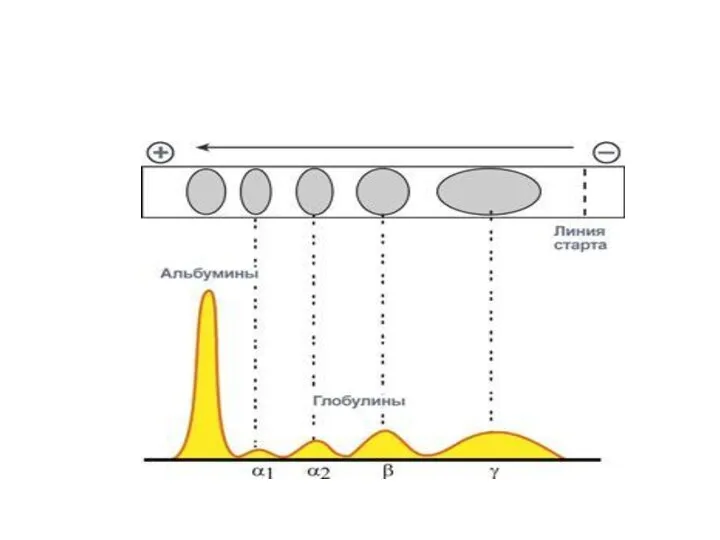
- 23. Растворы белков- коллоидные растворы. Виды растворов: 1. Истинные- частицы растворимого вещества невелики, сравнимы по величине с
- 24. 3. Суспензии и эмульсии. Если частицы твердые-суспензия, если -жидкие (масло)-эмульсия. Оседают под действием силы тяжести.
- 25. Свойства белковых растворов определяются большими размерами молекул, т.е. белки являются коллоидными частицами и образуют коллоидные растворы.
- 26. 4. Создание онкотического давления, т.е. перемещение воды в сторону более высокой концентрации белка. Проявляется при отеках.
- 27. Растворимость белков зависит от заряда и наличия гидратной оболочки. Исчезновение одного из этих факторов ведет к
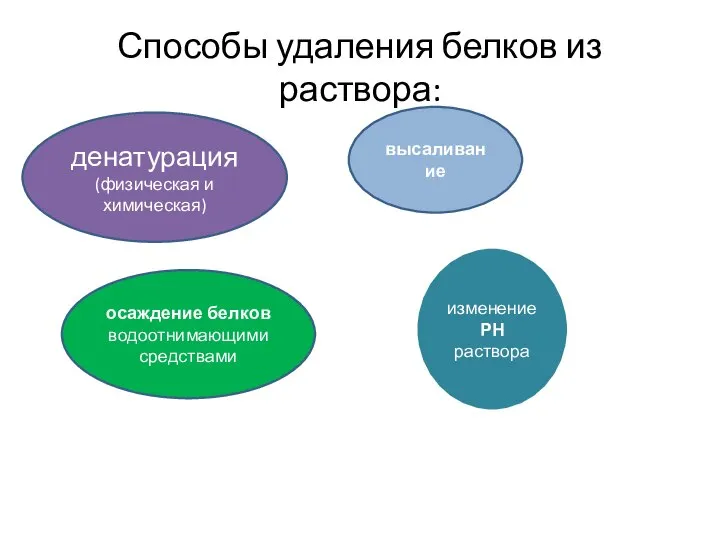
- 28. Способы удаления белков из раствора: денатурация (физическая и химическая) высаливание осаждение белков водоотнимающими средствами изменение РН
- 29. Денатурация белка.
- 30. Денатурация-необратимое осаждение белка из-за разрыва связей 2-й, 3-й, и 4-й структуры. Первичная структура сохраняется. Молекула белка
- 31. Физическая – вызывается повышением T, ультрафиолетовым и микроволновым излучением, механическим воздействием, ионизацией. В основе –возбуждение колебаний
- 32. Химическая . Действие кислот и щелочей - уменьшает число ионных связей. Ионы тяжелых металлов - образуют
- 34. Высаливание- не разрушает структуры белков. Добавление к раствору белка солей . Na2SO4, (NH4)2 SO4). Механизм высаливания
- 35. Осаждение белков водоотнимающими средствами. При добавлении водоотнимающих средств (этанол, ацетон) происходит отнятие у белка гидратной оболочки,
- 36. Изоэлектрическая точка белка (PI). Свойства белков определяются свойствами аминокислот. Белки-амфотерные соединения. Их свойства обусловлены амино- и
- 39. Обмен белков.
- 40. План: . Азотистое равновесие. Биологическая ценность белка. - Переваривание белков. (пищеварение в тонком и толстом кишечнике,
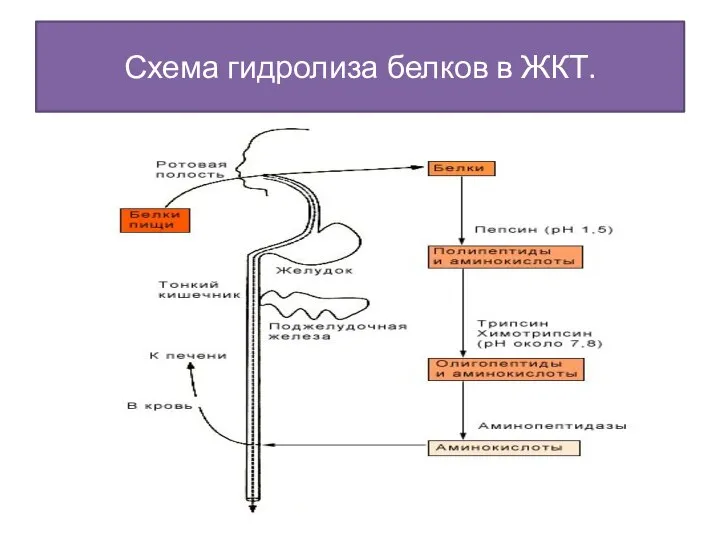
- 41. Схема гидролиза белков в ЖКТ.
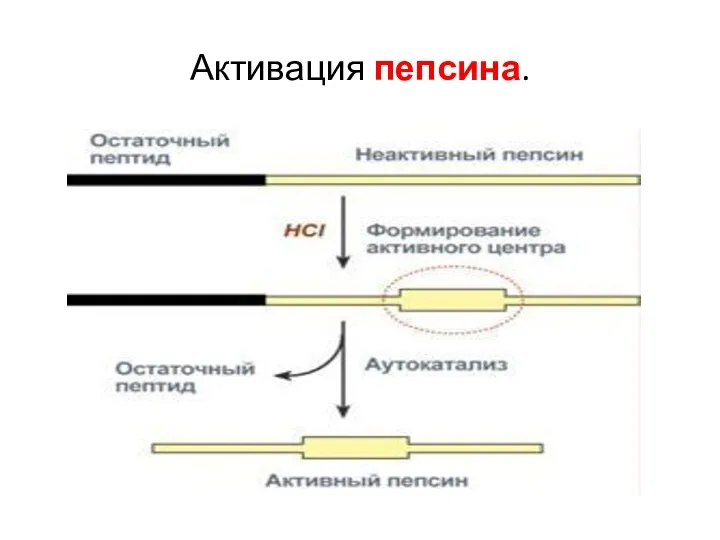
- 42. Активация пепсина.
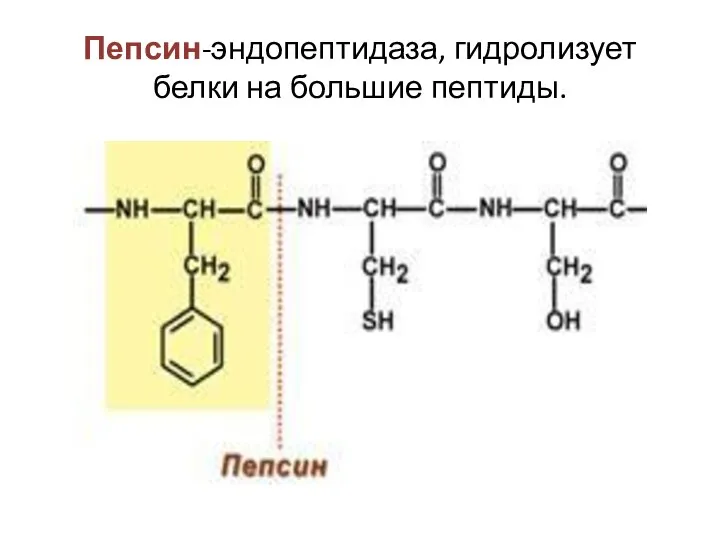
- 43. Пепсин-эндопептидаза, гидролизует белки на большие пептиды.
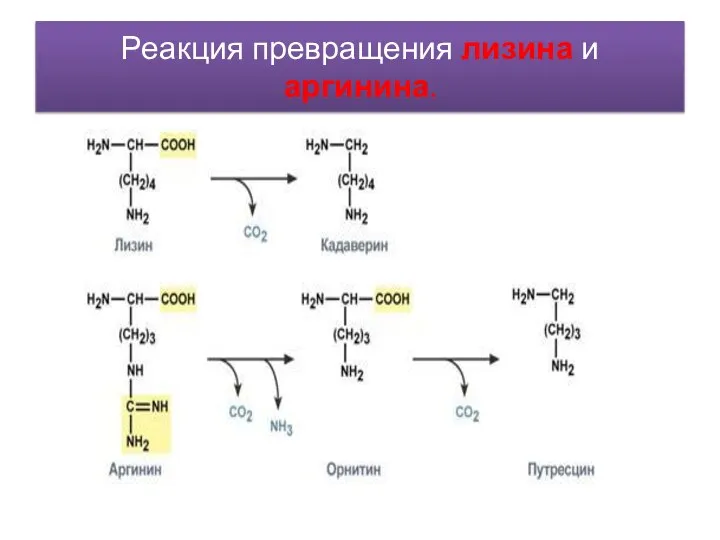
- 44. Реакция превращения лизина и аргинина.
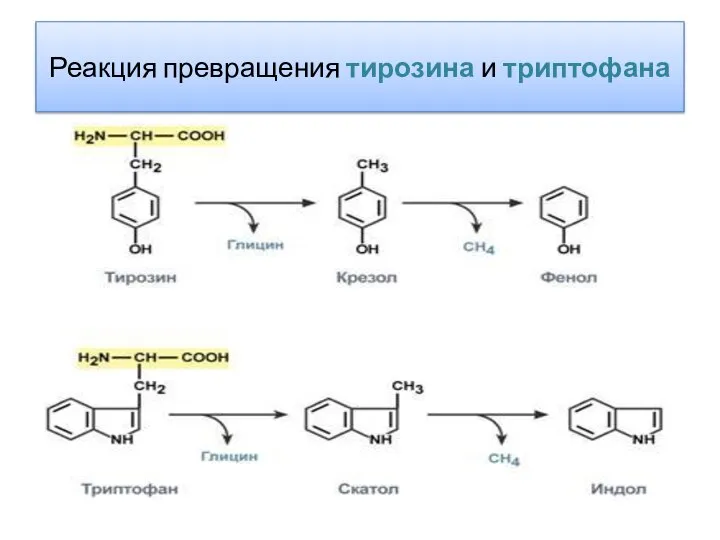
- 45. Реакция превращения тирозина и триптофана
- 46. Участие гормонов в процессе пищеварения. Гормоны ЖКТ – пептиды. Гастрин – секретируется G-клетками желудка и 12
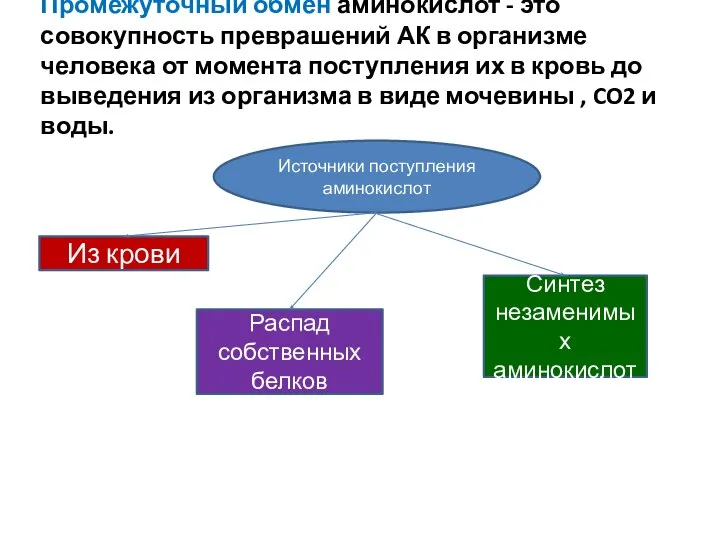
- 47. Промежуточный обмен аминокислот.
- 48. Тема:Промежуточный обмен аминокислот. Общие пути обмена аминокислот. Биогенные амины. Обмена аммиака, обезвреживание аммиака. Орнитиновый цикл. Мочевина.
- 49. Промежуточный обмен аминокислот - это совокупность преврашений АК в организме человека от момента поступления их в
- 51. Условно промежуточный обмен делят на 2: 1. Общие пути обмена АК. 2. Индивидуальные пути обмена АК.
- 52. Общие пути обмена аминокислот. Включает реакции: ДЕЗАМИНИРОВАНИЕ -восстановительное дезаминирование -гидролитическое дезаминирование -внутримолекулярное дезаминирование -окислительное дезаминирование ТРАНСАМИНИРОВАНИЕ
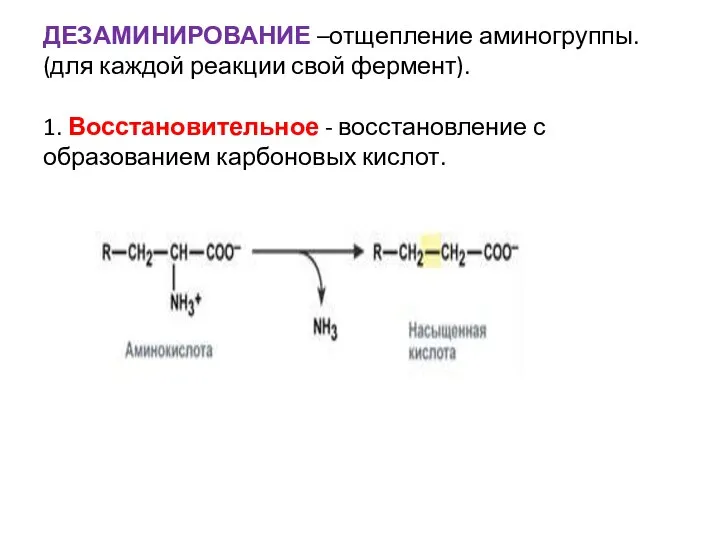
- 53. ДЕЗАМИНИРОВАНИЕ –отщепление аминогруппы. (для каждой реакции свой фермент). 1. Восстановительное - восстановление с образованием карбоновых кислот.
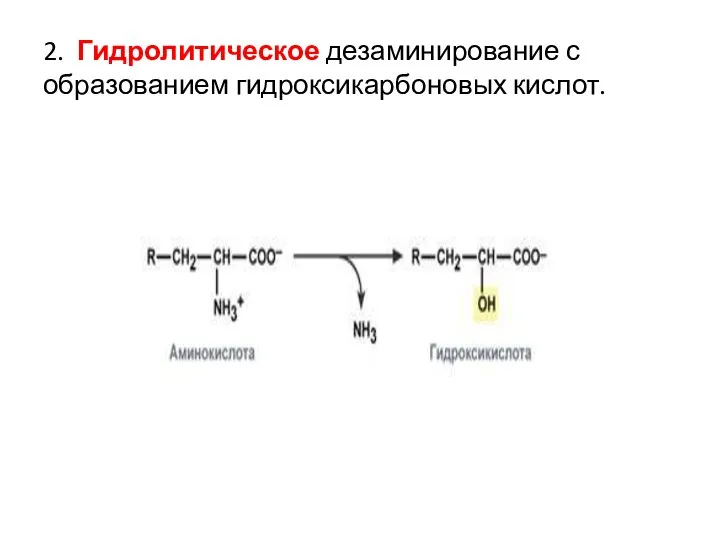
- 54. 2. Гидролитическое дезаминирование с образованием гидроксикарбоновых кислот.
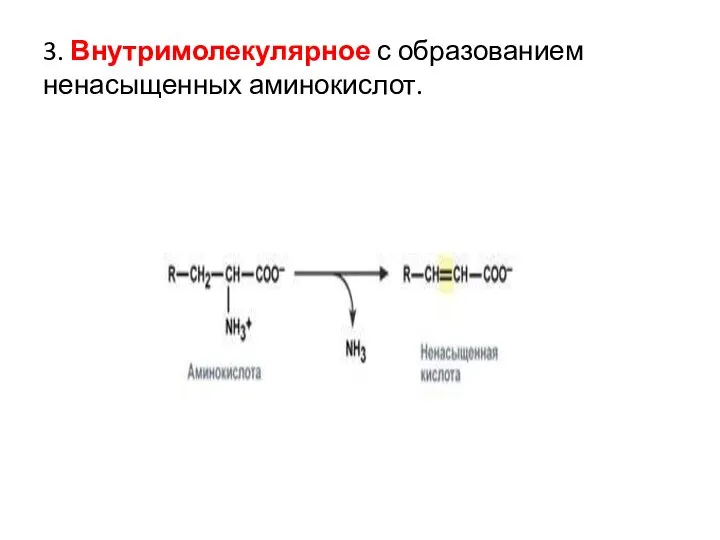
- 55. 3. Внутримолекулярное с образованием ненасыщенных аминокислот.
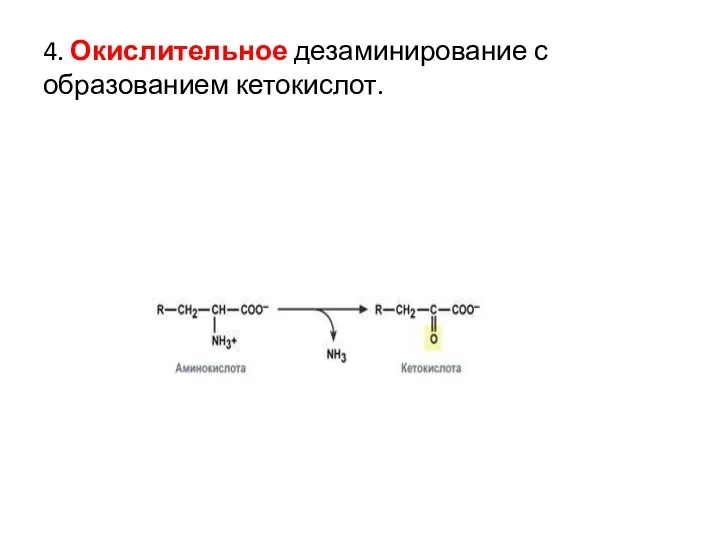
- 56. 4. Окислительное дезаминирование с образованием кетокислот.
- 57. ТРАНСАМИНИРОВАНИЕ- реакции межмолекулярного переноса аминогруппы (NH2) от аминокислоты на альфа-кетогруппу без образования аммиака. Впервые эти реакции
- 58. Биологическое значение реакций трансаминирования: Синтез 10 заменимых аминокислот Доставка аминогруппы АК из мышц в печень в
- 59. В клинике широко используется определение активности АСТ и АЛТ.
- 60. ДЕКАРБОКСИЛИРОВАНИЕ – процесс отщепления карбоксильной группы в виде CO2. Фермент- декарбоксилаза аминокислот при участии активной формы
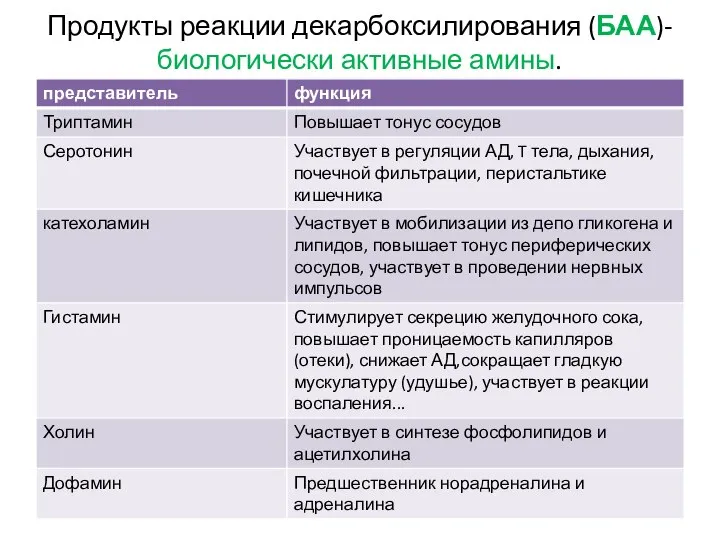
- 61. Продукты реакции декарбоксилирования (БАА)-биологически активные амины.
- 62. Судьба биогенных аминов. Накопление БАА может отрицательно сказаться на физиологическом статусе. Однако, органы и ткани имеют
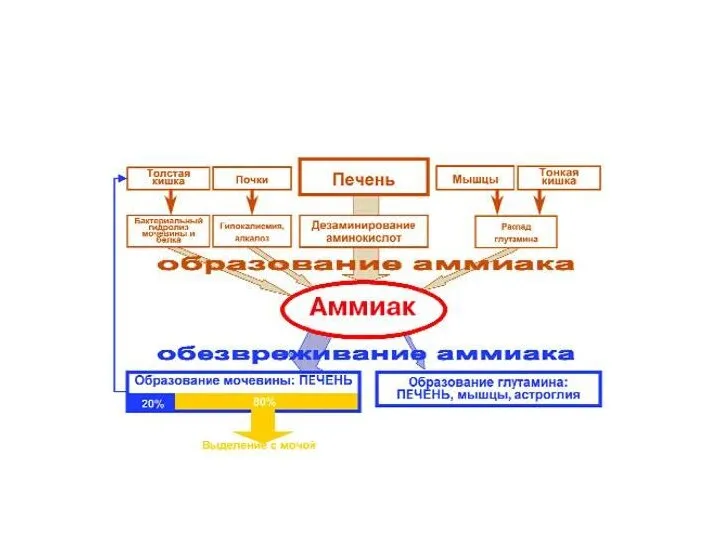
- 63. Обмен аммиака. В сутки распадается 70 г. аминокислот (АК). При этом в результате дезаминирования , трансаминирования
- 65. Обезвреживание аммиака. Образующийся в процессе дезаминирования аммиакиспользуется в небольших количествах в процессе внутриклеточного метаболизма. Аммиак-токсичен. Основная
- 66. Основные пути обезвреживания аммиака. Образование амонийных солей NH4Cl, (NH4)2SO4 (0,5 г в сутки), которые выводятся с
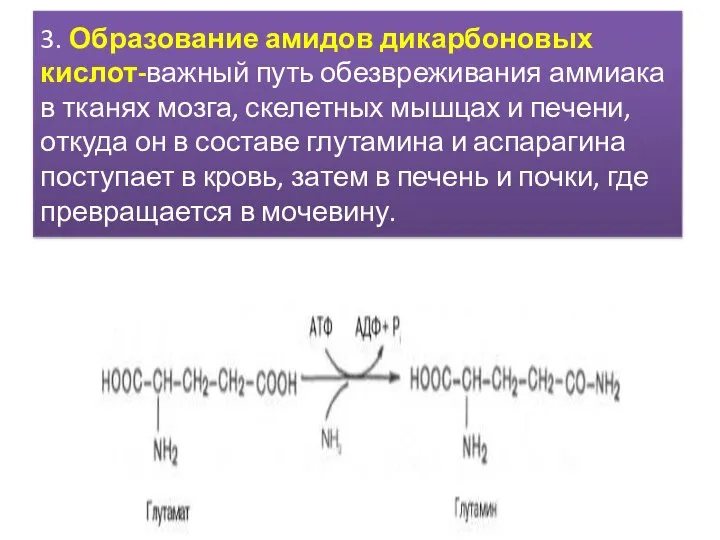
- 67. 3. Образование амидов дикарбоновых кислот-важный путь обезвреживания аммиака в тканях мозга, скелетных мышцах и печени, откуда
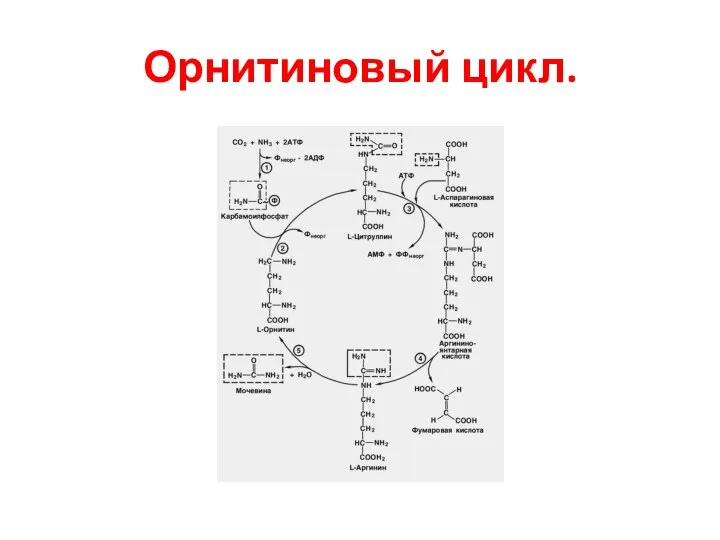
- 68. Орнитиновый цикл. 4. Основной механизм обезвреживания аммиака- биосинтез мочевины. Выводится с мочой в качестве главного конечного
- 69. Орнитиновый цикл.
- 70. Биологическое значение орнитинового цикла: Обезвреживание аммиака. Регуляция азотистого балланса. Биосинтез заменимых АК. Участие в биосинтезе глюкозы
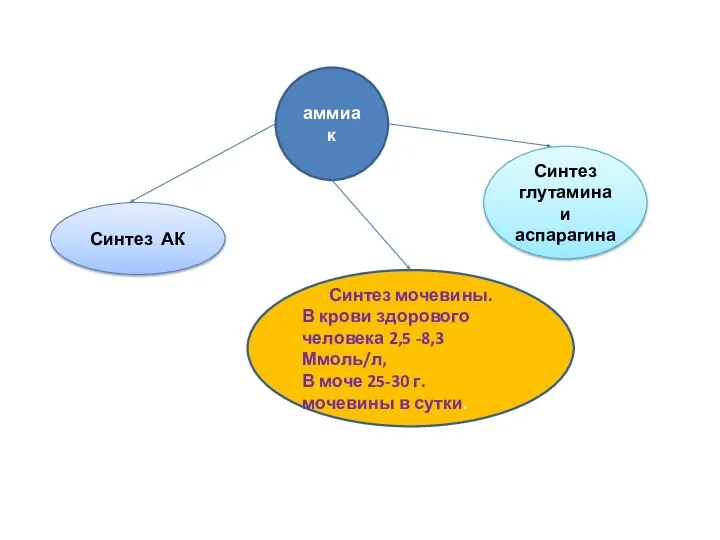
- 71. аммиак Синтез АК Синтез глутамина и аспарагина Синтез мочевины. В крови здорового человека 2,5 -8,3 Ммоль/л,
- 73. Скачать презентацию










































 Цели внутреннего контроля и аудита финансового бизнес-цикла и его функции
Цели внутреннего контроля и аудита финансового бизнес-цикла и его функции Заболевания сосудистого тракта у детей
Заболевания сосудистого тракта у детей Кәсіпкерліктің ұйымдық-құқықтық нысандары. (Такырып 2)
Кәсіпкерліктің ұйымдық-құқықтық нысандары. (Такырып 2) Массивы в C#. Лекция 6
Массивы в C#. Лекция 6 Применение аналоговых перемножителей и балансных модуляторов
Применение аналоговых перемножителей и балансных модуляторов Программирование (Паскаль)
Программирование (Паскаль) Активные методы обучения персонала. Деловая игра, мозговой штурм, кейс-метод, баскет-метод
Активные методы обучения персонала. Деловая игра, мозговой штурм, кейс-метод, баскет-метод РУКОВОДСТВО ОРГАНИЗАЦИОННО-ИСПОЛНИТЕЛЬНАЯ
РУКОВОДСТВО ОРГАНИЗАЦИОННО-ИСПОЛНИТЕЛЬНАЯ  Өндірістік практика бойынша есеп Орал
Өндірістік практика бойынша есеп Орал ПРЕЗЕНТАЦИЯ СИСТЕМЫ © EleWise 2006 – 2010 Управление бизнес процессами. - презентация
ПРЕЗЕНТАЦИЯ СИСТЕМЫ © EleWise 2006 – 2010 Управление бизнес процессами. - презентация Финансовый контроль
Финансовый контроль  Микроциркуляция. Движение крови по венам. Регуляция системы кровообращения
Микроциркуляция. Движение крови по венам. Регуляция системы кровообращения  политология1 лекция
политология1 лекция Природова Ольга Федоровна Декан Факультета усовершенствования врачей ГБОУ ВПО РНИМУ им. Н.И.Пирогова Минздравсоцразвития
Природова Ольга Федоровна Декан Факультета усовершенствования врачей ГБОУ ВПО РНИМУ им. Н.И.Пирогова Минздравсоцразвития Политические роли личности
Политические роли личности Бременские музыканты Художник Сергий Елена
Бременские музыканты Художник Сергий Елена  Творческая работа «Особенности атакующих действий команд в гандболе»
Творческая работа «Особенности атакующих действий команд в гандболе» Материнский (семейный) капитал
Материнский (семейный) капитал Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Из истории причесок Учитель технологии МОУ СОШ №1 город Буденновск Салогуб Марина Ивановна
Из истории причесок Учитель технологии МОУ СОШ №1 город Буденновск Салогуб Марина Ивановна  Интерьер
Интерьер Статистика дифференциации доходов
Статистика дифференциации доходов Создание и управление ассортиментом гипермаркета товаров для дома исходя из позиционирования бренда и соответствующей этому ком
Создание и управление ассортиментом гипермаркета товаров для дома исходя из позиционирования бренда и соответствующей этому ком Контроль качества сварных соединений
Контроль качества сварных соединений Страны исламского мира. Саудовская Аравия
Страны исламского мира. Саудовская Аравия Презентация Заполнение таможенной расписки
Презентация Заполнение таможенной расписки Министерство образования и науки РФ Муниципальное казенное общеобразовательное учреждение “Средняя общеобразовательная школа №13” Образовательная область: Мировая Художественная Культура Тема: Творчество И.Е. Репина Выполнил: ученик 9-в класса Бесене
Министерство образования и науки РФ Муниципальное казенное общеобразовательное учреждение “Средняя общеобразовательная школа №13” Образовательная область: Мировая Художественная Культура Тема: Творчество И.Е. Репина Выполнил: ученик 9-в класса Бесене Леонард Эйлер (1707-1783)
Леонард Эйлер (1707-1783)