Содержание
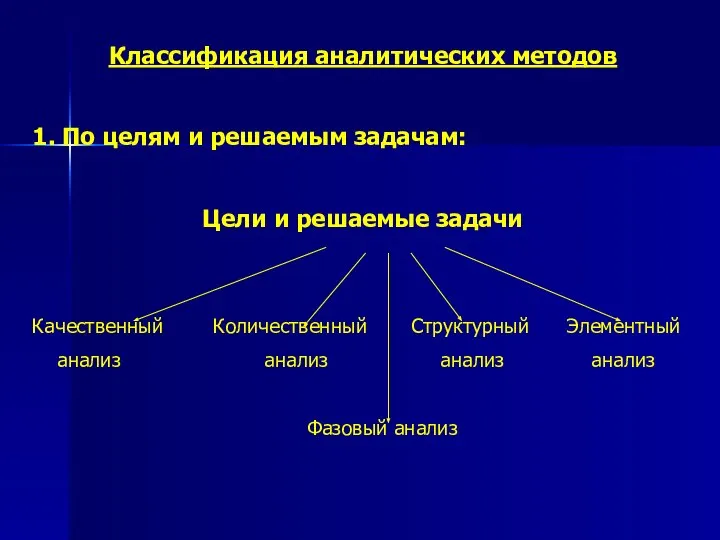
- 2. Классификация аналитических методов 1. По целям и решаемым задачам: Цели и решаемые задачи Качественный Количественный Структурный
- 3. 2. По количеству анализируемого вещества: Количество анализируемого вещества Макрометоды Полумикрометоды Микрометоды Ультрамикрометоды Методы Масса Объем анализируемого
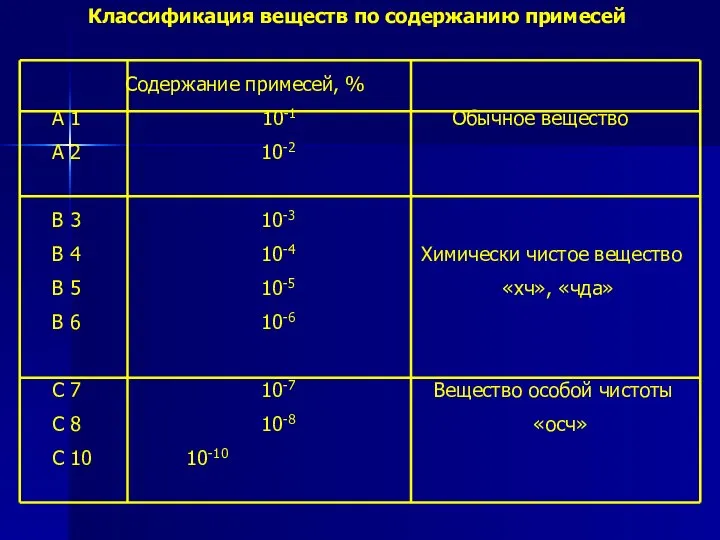
- 4. Классификация веществ по содержанию примесей Содержание примесей, % А 1 10-1 Обычное вещество А 2 10-2
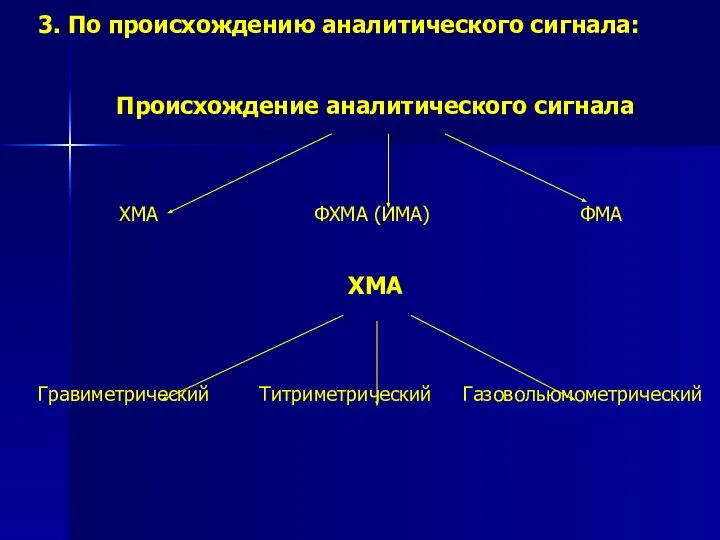
- 5. 3. По происхождению аналитического сигнала: Происхождение аналитического сигнала ХМА ФХМА (ИМА) ФМА ХМА Гравиметрический Титриметрический Газовольюмометрический
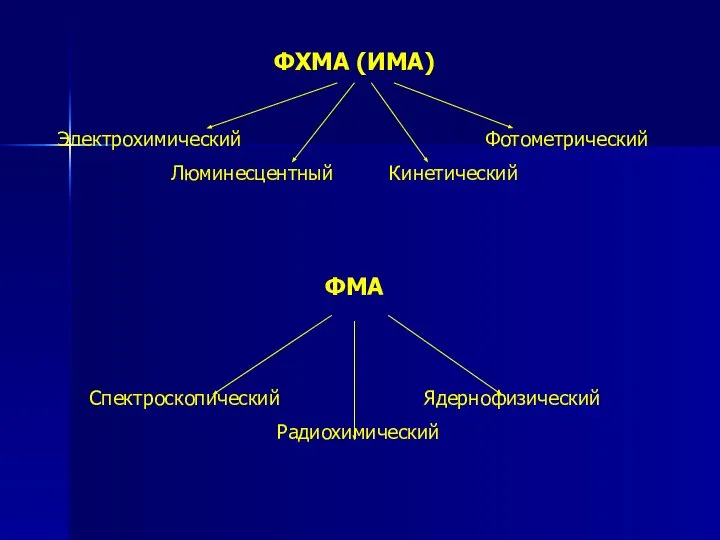
- 6. ФХМА (ИМА) Электрохимический Фотометрический Люминесцентный Кинетический ФМА Спектроскопический Ядернофизический Радиохимический
- 7. Химические методы анализа Общая схема аналитического процесса Образец Пробоотбор Подготовка пробы к анализу Химическая реакция Детекция
- 8. Аналитическая реакция: Х + R → Продукты реакции Определяемый компонент Реагент Примеры: Ba2+ + SO42- →
- 9. Коэффициент чувствительности: S = dJ/dC или S = ΔJ/ΔC J 3 2 1 J3 > J2
- 10. Нижний предел обнаружения (НПО): – lg Cmin = pCmin pCmin = 3-4 – высокий предел обнаружения
- 11. Классификация аналитических реакций По способу проведения: Аналитические реакции Пробирочные Капельные Твердофазовые Пирохимические Микрокристаллоскопические Хроматографические Со2+ +
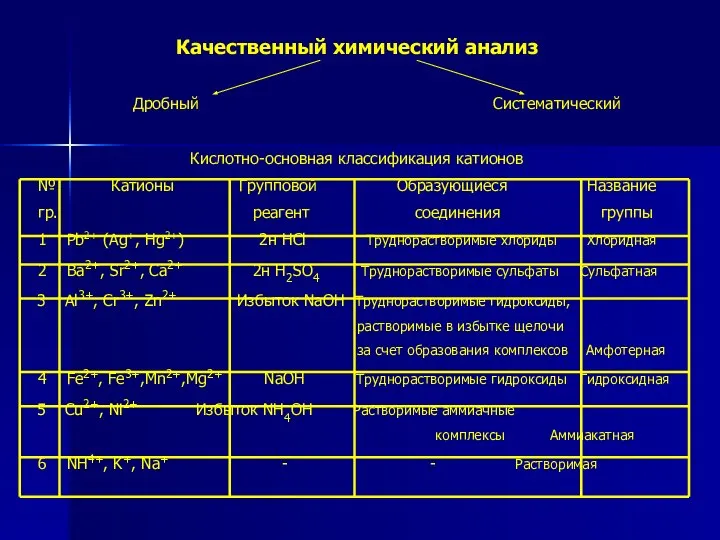
- 12. Качественный химический анализ Дробный Систематический Кислотно-основная классификация катионов № Катионы Групповой Образующиеся Название гр. реагент соединения
- 13. Кислотно-основная классификация анионов № Анионы Групповой Образующиеся Название группы реагент соединения группы 1 SO42-, CO32-, BaCl2
- 14. Общая схема анализа соли Образец I Раствор (катион, анион) II III Определение группы катиона Определение группы
- 15. Анализ катионов Растворение образца Предварительные исследования (цвет, запах) + 2н HCl Обнаружение и отделение хлоридной группы
- 17. Скачать презентацию









 Написание итогового сочинения.
Написание итогового сочинения. MapInfo
MapInfo  Фундаменты малоэтажных зданий
Фундаменты малоэтажных зданий Творческие работы учащихся художественного отделения МОУ школы № 124 г.о.Самара на тему «Батик» Автор: © Куприна Евгения Владимировна учитель МХК и истории изобразительного искусства МОУ школы № 124 г.о. Самара
Творческие работы учащихся художественного отделения МОУ школы № 124 г.о.Самара на тему «Батик» Автор: © Куприна Евгения Владимировна учитель МХК и истории изобразительного искусства МОУ школы № 124 г.о. Самара Облицовка - фреска
Облицовка - фреска Проект по продвижению комплекса ГТО
Проект по продвижению комплекса ГТО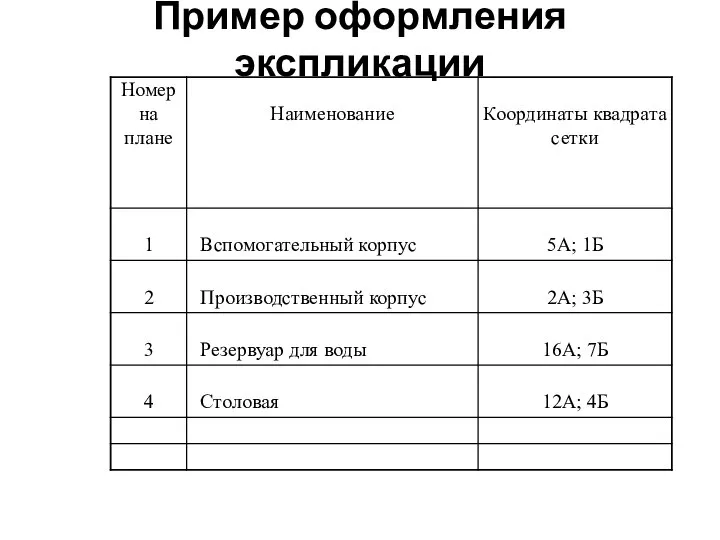 Пример оформления экспликации
Пример оформления экспликации Олимпйские игры современности
Олимпйские игры современности ТЕПЛОИЗОЛЯЦИОННЫЕ МАТЕРИАЛЫ И ИЗДЕЛИЯ Неорганические
ТЕПЛОИЗОЛЯЦИОННЫЕ МАТЕРИАЛЫ И ИЗДЕЛИЯ Неорганические  Практическое занятие 1. Пароли.
Практическое занятие 1. Пароли. Общественное движение в 80-90-ые годы XIX века
Общественное движение в 80-90-ые годы XIX века Информационная система по управлению складскими запасами предприятия
Информационная система по управлению складскими запасами предприятия Презентация Рынок недвижимости
Презентация Рынок недвижимости 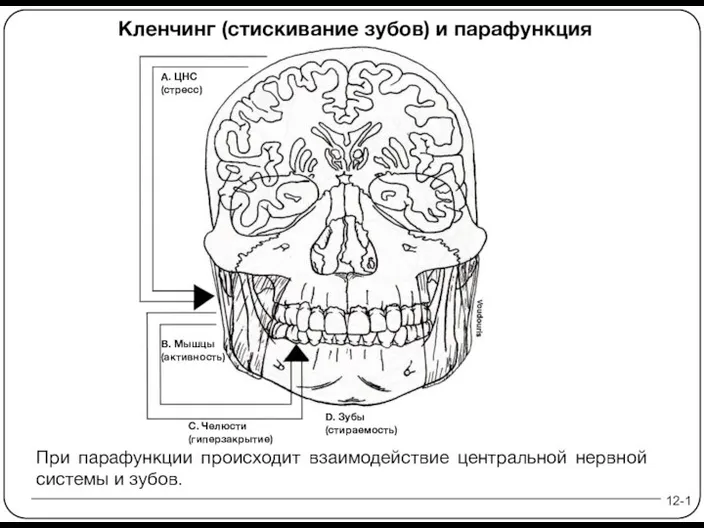 Презентация на тему "Кленчинг (стискивание зубов) и парафункция" - скачать презентации по Медицине
Презентация на тему "Кленчинг (стискивание зубов) и парафункция" - скачать презентации по Медицине Годы священной войны Великая Отечественная война 1941-1945 гг.
Годы священной войны Великая Отечественная война 1941-1945 гг. Патология белой крови
Патология белой крови Деятельность учителя в рамках школы информационной компетенции. Конюхова О.А. учитель английского языка
Деятельность учителя в рамках школы информационной компетенции. Конюхова О.А. учитель английского языка Усилители электрических сигналов
Усилители электрических сигналов ДИСТОЦИЯ ПЛЕЧИКОВ ПЛОДА
ДИСТОЦИЯ ПЛЕЧИКОВ ПЛОДА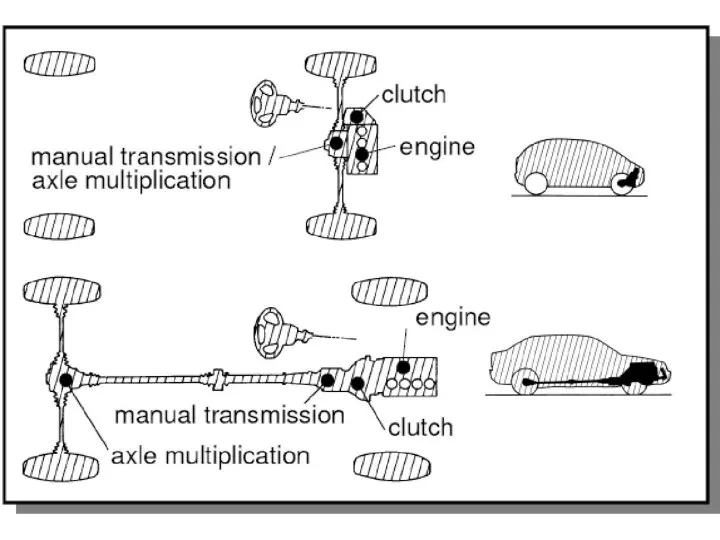 Сцепление. Назначение сцепления
Сцепление. Назначение сцепления история бух учета
история бух учета Аудит бизнес плана и порядок проведения
Аудит бизнес плана и порядок проведения  Дорога жизни.
Дорога жизни.  Engetronics. Internet datacenter
Engetronics. Internet datacenter Рабочая тетрадь
Рабочая тетрадь Аукцион в электронной форме
Аукцион в электронной форме Стратегическое управление в образовании
Стратегическое управление в образовании Математическое моделирование транспортных процессов и принципы их построения
Математическое моделирование транспортных процессов и принципы их построения