Содержание
- 2. Литература Артеменко А. И. Органическая химия: Учебное пособие. – М.: Высш. шк., 2003. – С. 371-461.
- 3. Ароматические соединения (или арены) – это большая группа соединений карбоциклического ряда, молекулы которых содержат устойчивую циклическую
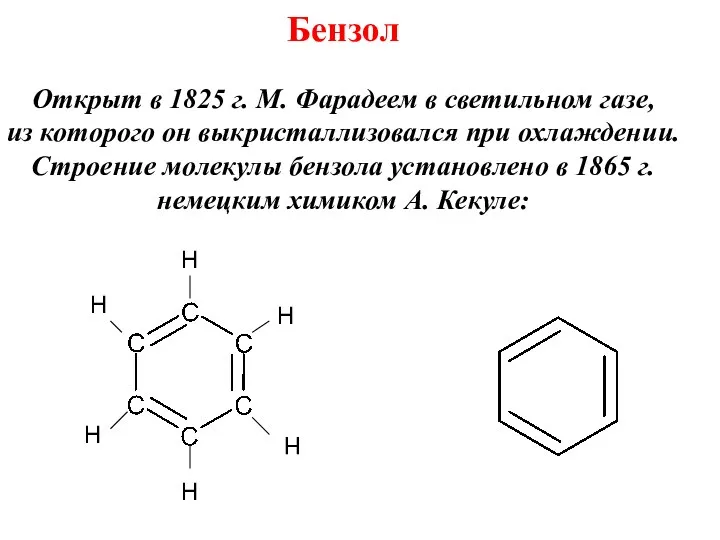
- 4. Открыт в 1825 г. М. Фарадеем в светильном газе, из которого он выкристаллизовался при охлаждении. Строение
- 5. Предложенная формула опиралась на следующие факты: а) бензол и его гомологи имеют общую формулу СnН2n–6 ,
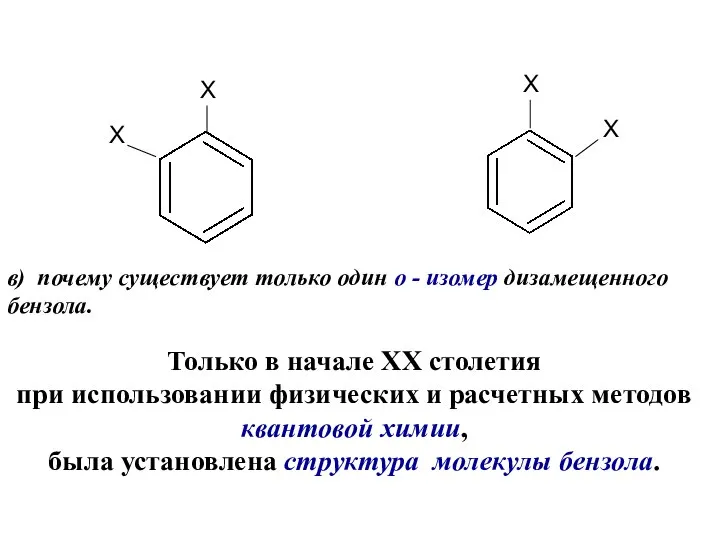
- 6. Х Х Х Х в) почему существует только один о - изомер дизамещенного бензола. Только в
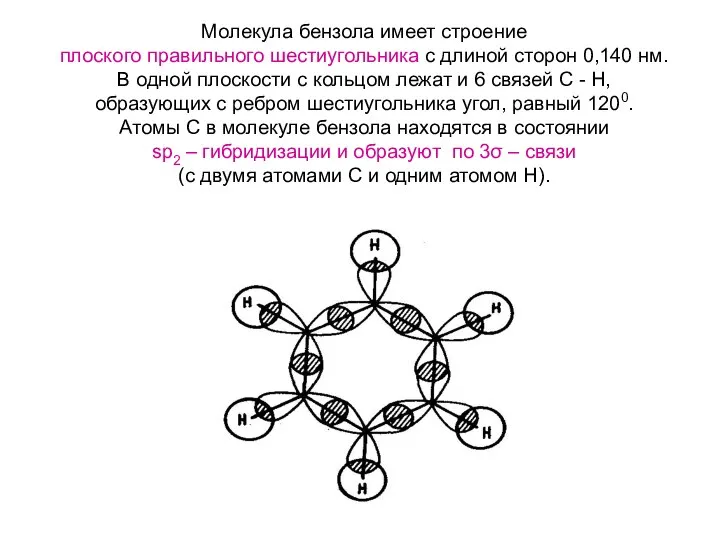
- 7. Молекула бензола имеет строение плоского правильного шестиугольника с длиной сторон 0,140 нм. В одной плоскости с
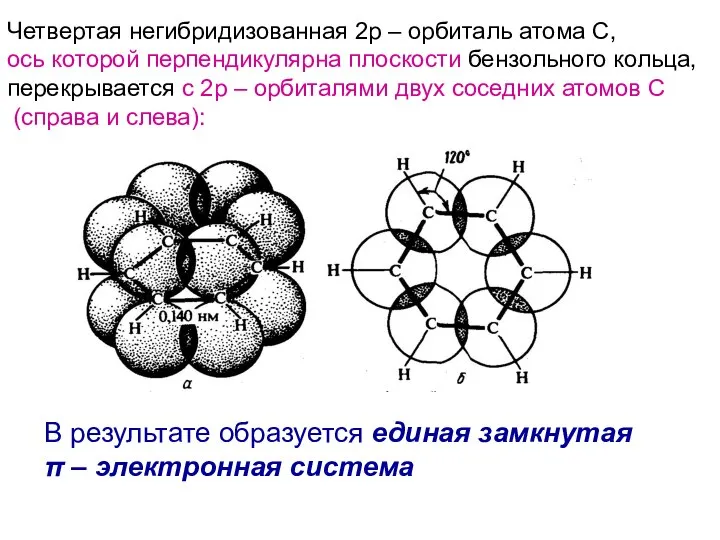
- 8. Четвертая негибридизованная 2р – орбиталь атома С, ось которой перпендикулярна плоскости бензольного кольца, перекрывается с 2р
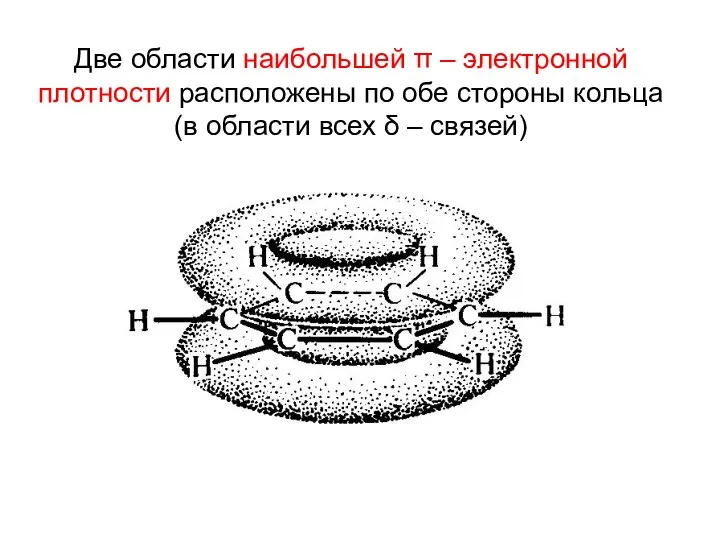
- 9. Две области наибольшей π – электронной плотности расположены по обе стороны кольца (в области всех δ
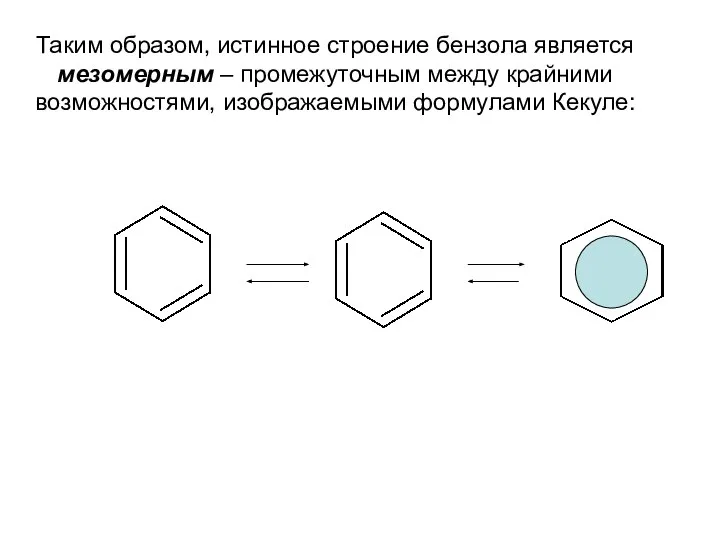
- 10. Таким образом, истинное строение бензола является мезомерным – промежуточным между крайними возможностями, изображаемыми формулами Кекуле:
- 11. Понятие «ароматичности» Главная особенность ароматических углеводородов - равномерное распределение π − электронной плотности в молекуле. Немецкий
- 12. Молекулы ароматических соединений должны обязательно иметь плоское строение. Если это условие не выполняется, то круговое сопряжение
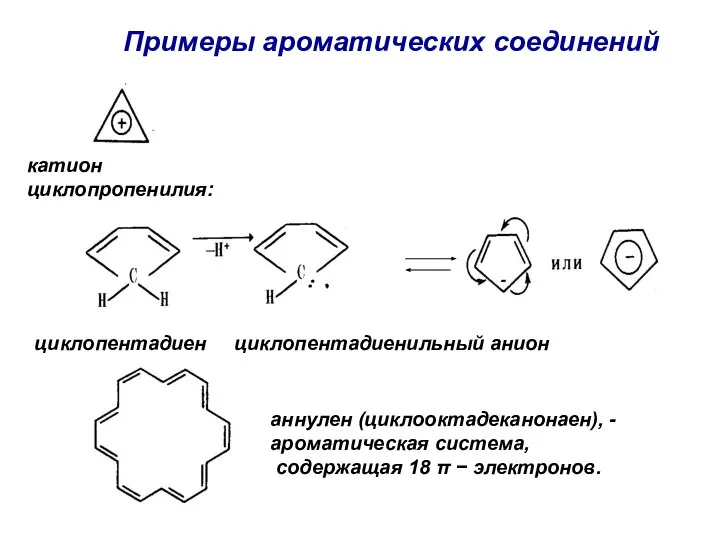
- 13. Примеры ароматических соединений циклопентадиен циклопентадиенильный анион катион циклопропенилия: аннулен (циклооктадеканонаен), - ароматическая система, содержащая 18 π
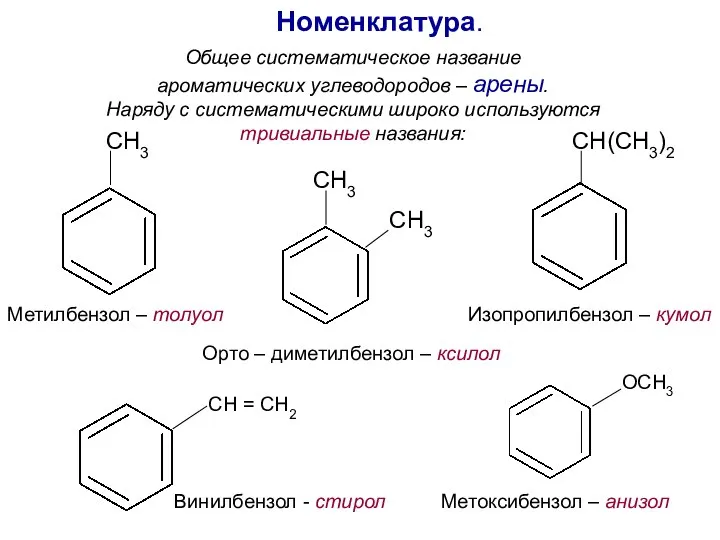
- 14. Номенклатура. Общее систематическое название ароматических углеводородов – арены. Наряду с систематическими широко используются тривиальные названия: СН3
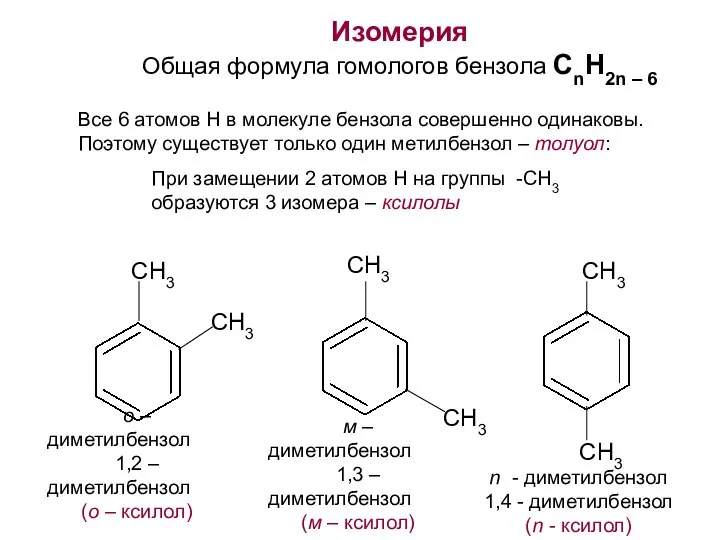
- 15. Изомерия Общая формула гомологов бензола СnH2n – 6 Все 6 атомов H в молекуле бензола совершенно
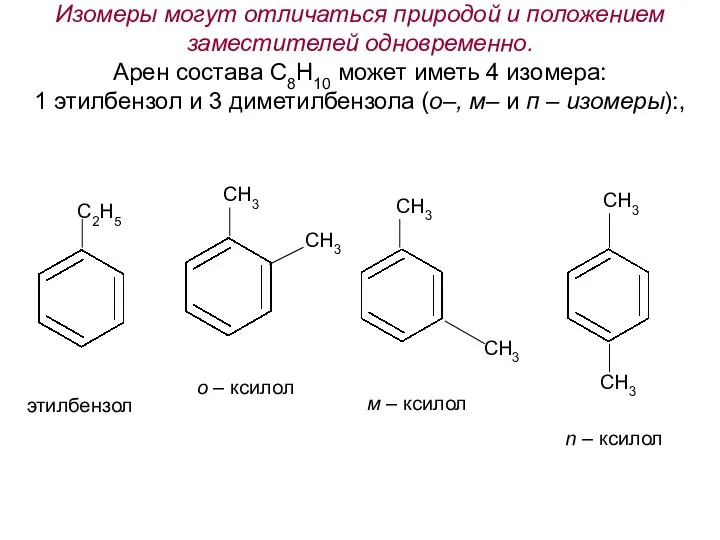
- 16. Изомеры могут отличаться природой и положением заместителей одновременно. Арен состава С8Н10 может иметь 4 изомера: 1
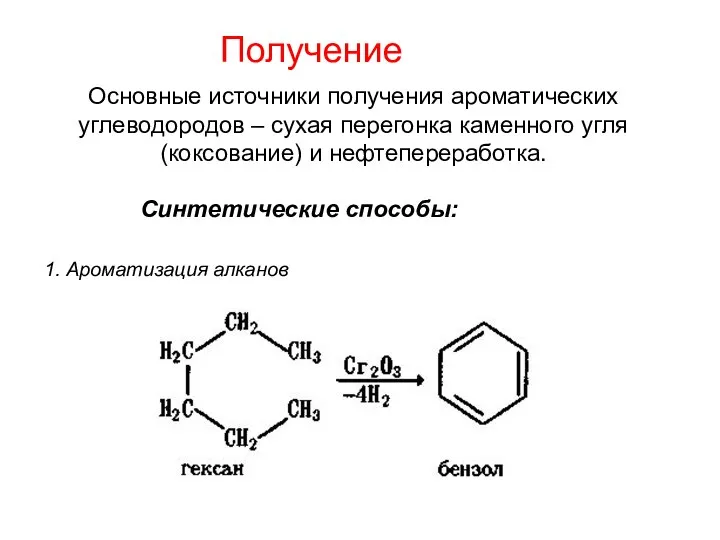
- 17. Получение Основные источники получения ароматических углеводородов – сухая перегонка каменного угля (коксование) и нефтепереработка. Синтетические способы:
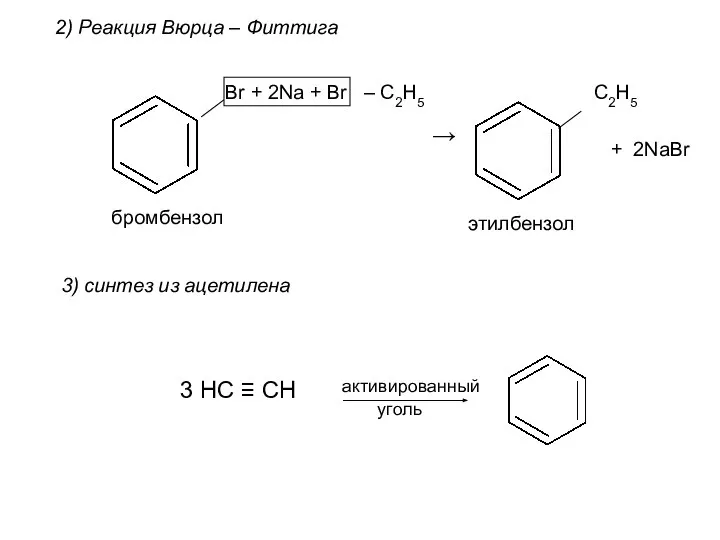
- 18. 2) Реакция Вюрца – Фиттига Br + 2Na + Br – C2H5 → C2H5 + 2NaBr
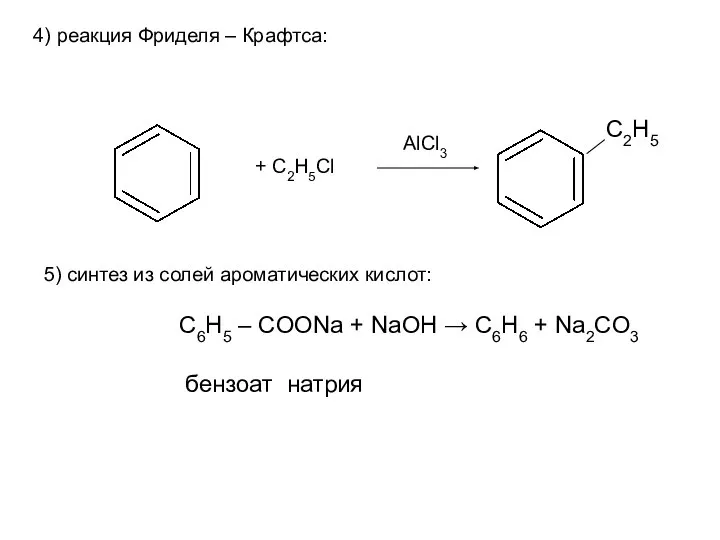
- 19. 4) реакция Фриделя – Крафтса: 5) синтез из солей ароматических кислот: + C2H5Cl AlCl3 C2H5 C6H5
- 20. Физические свойства. Низшие члены гомологического ряда бензола – чаще жидкости со своеобразным запахом, нерастворимые в воде,
- 21. Химические свойства. Для ароматических углеводородов наиболее характерны реакции замещения, в меньшей степени – реакции присоединения, протекающие
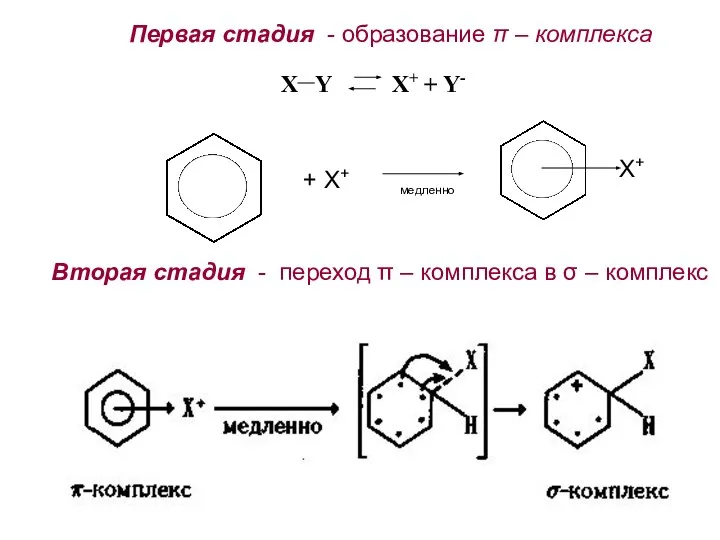
- 22. Первая стадия - образование π – комплекса X Y Х+ + Y- + Х+ медленно Х+
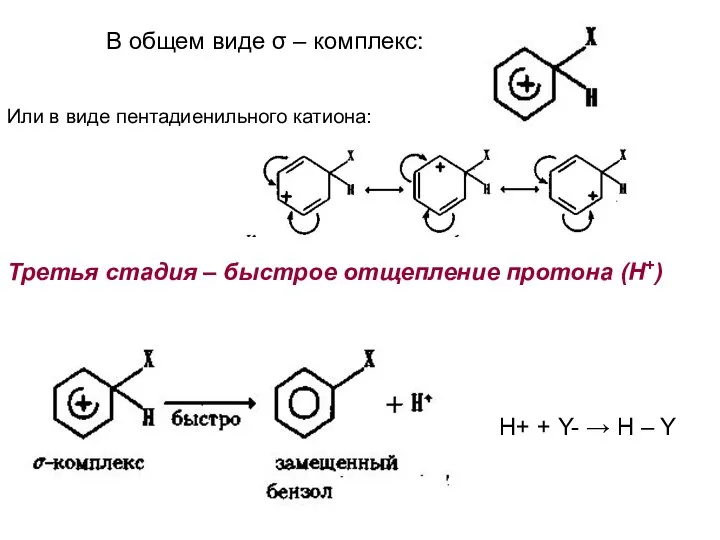
- 23. В общем виде σ – комплекс: Или в виде пентадиенильного катиона: Третья стадия – быстрое отщепление
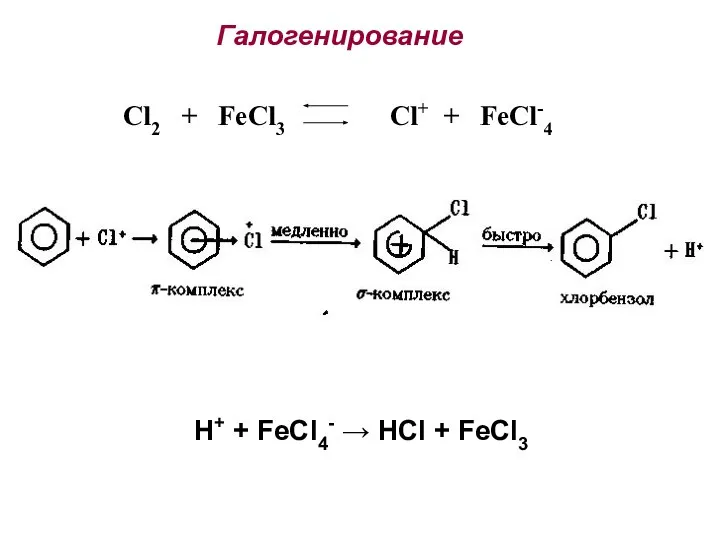
- 24. Галогенирование Cl2 + FeCl3 Cl+ + FeCl-4 H+ + FeCl4- → HCl + FeCl3
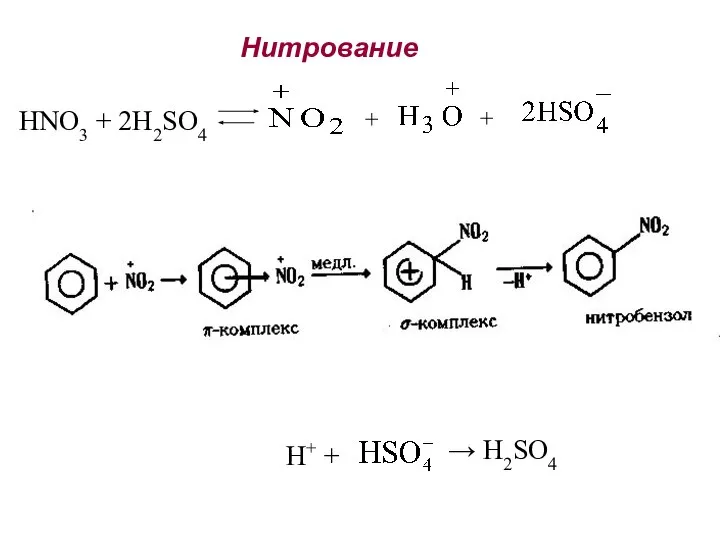
- 25. Нитрование HNO3 + 2H2SO4 + + H+ + → H2SO4
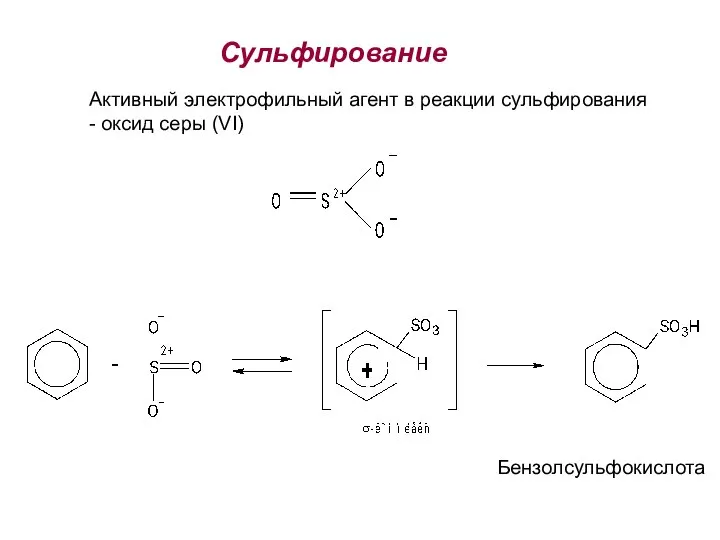
- 26. Cульфирование Активный электрофильный агент в реакции сульфирования - оксид серы (VI) Бензолсульфокислота
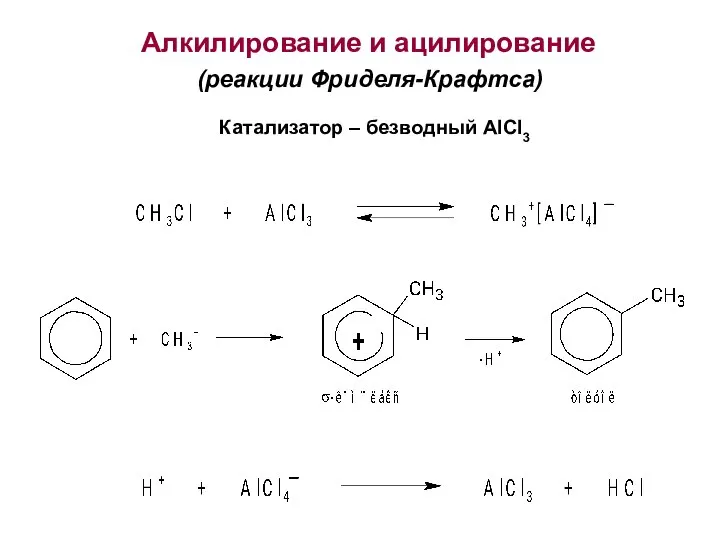
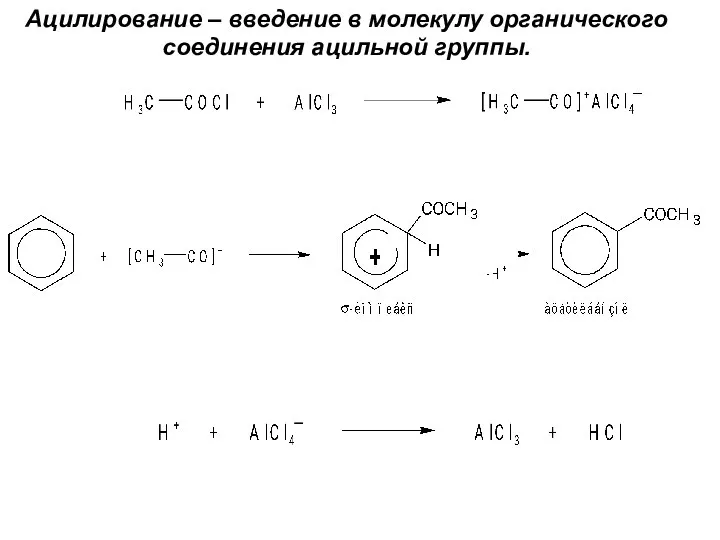
- 27. Алкилирование и ацилирование (реакции Фриделя-Крафтса) Катализатор – безводный AlCl3
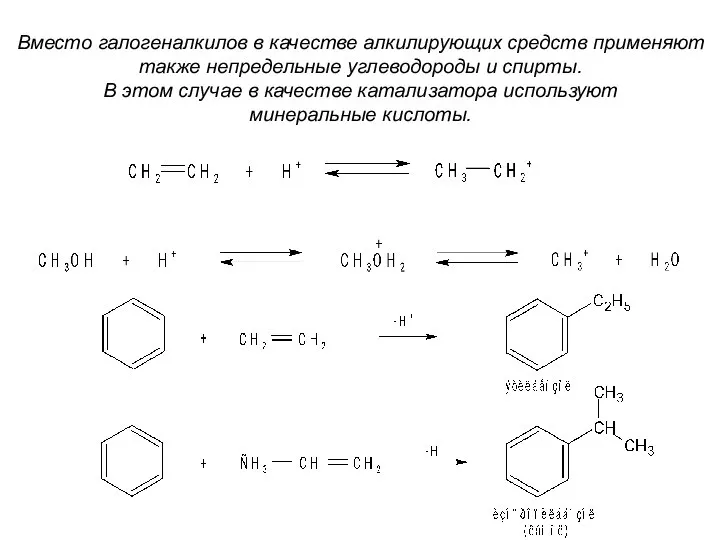
- 28. Вместо галогеналкилов в качестве алкилирующих средств применяют также непредельные углеводороды и спирты. В этом случае в
- 29. Ацилирование – введение в молекулу органического соединения ацильной группы.
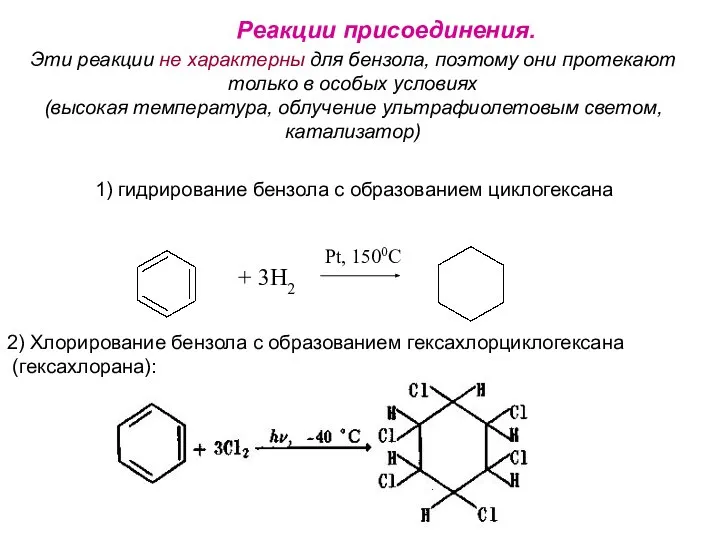
- 30. Реакции присоединения. Эти реакции не характерны для бензола, поэтому они протекают только в особых условиях (высокая
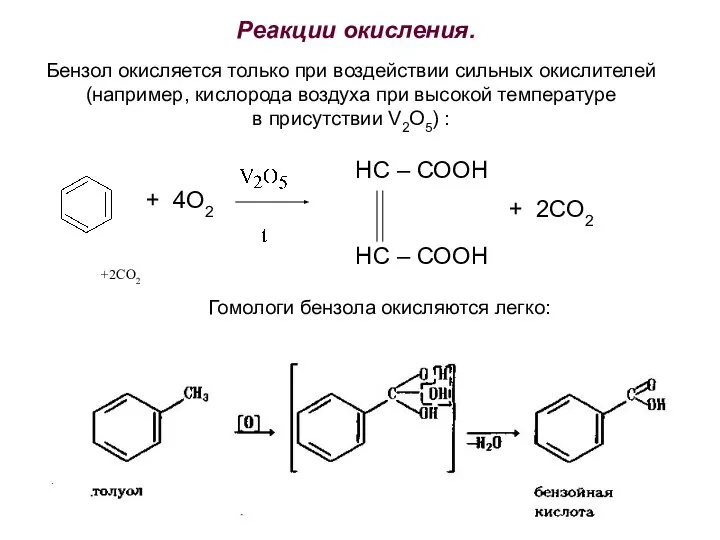
- 31. Реакции окисления. Бензол окисляется только при воздействии сильных окислителей (например, кислорода воздуха при высокой температуре в
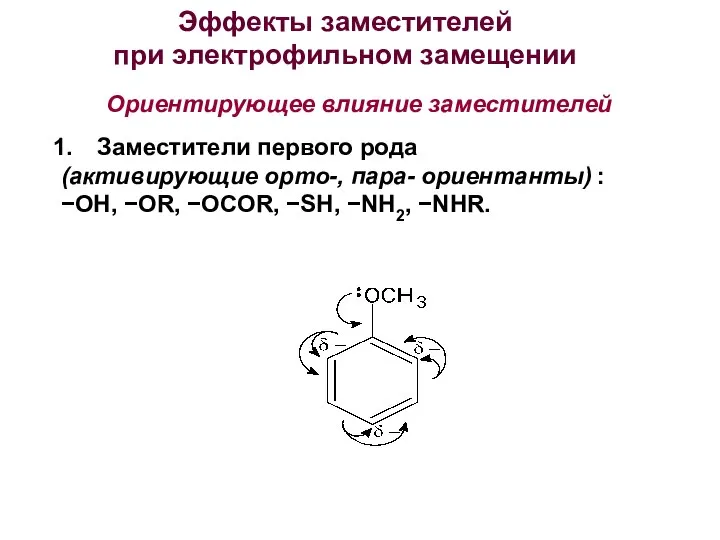
- 32. Ориентирующее влияние заместителей Эффекты заместителей при электрофильном замещении Заместители первого рода (активирующие орто-, пара- ориентанты) :
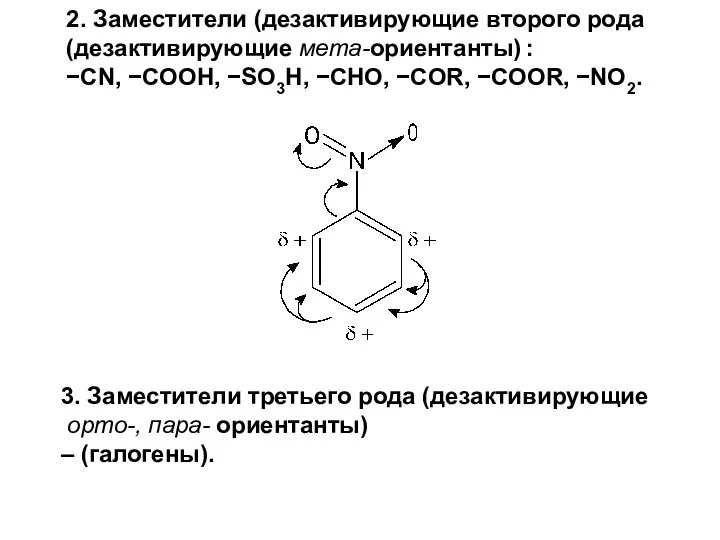
- 33. 3. Заместители третьего рода (дезактивирующие орто-, пара- ориентанты) – (галогены). 2. Заместители (дезактивирующие второго рода (дезактивирующие
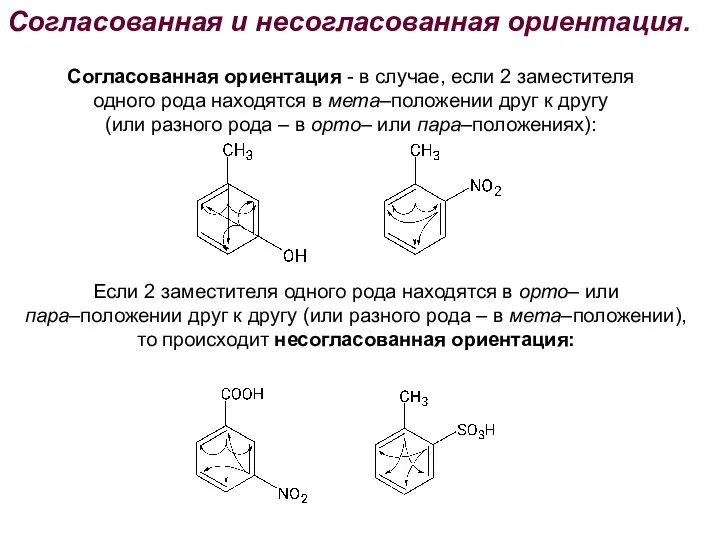
- 34. Согласованная и несогласованная ориентация. Согласованная ориентация - в случае, если 2 заместителя одного рода находятся в
- 36. Скачать презентацию







 Стиль модерн Подготовил ученик 7А класса Тарасов Евгений Тальменка 2012г.
Стиль модерн Подготовил ученик 7А класса Тарасов Евгений Тальменка 2012г. Субъекты международного таможенного сотрудничества
Субъекты международного таможенного сотрудничества Презентация Таможенное дело в период царствования Елизаветы Петровны
Презентация Таможенное дело в период царствования Елизаветы Петровны Frankfurt
Frankfurt С П О СО Б Ы О Б Р А З О В А Н И Я С У Щ Е С Т В И Т Е Л Ь Н Ы Х
С П О СО Б Ы О Б Р А З О В А Н И Я С У Щ Е С Т В И Т Е Л Ь Н Ы Х Теория железобетона
Теория железобетона Бюджет домохозяйства
Бюджет домохозяйства Подготовка к ЕГЭ по обществознанию. Политические режимы
Подготовка к ЕГЭ по обществознанию. Политические режимы Лингвистический анализ художественного текста как способ формирования языковых комуникативных компетенций учащихся
Лингвистический анализ художественного текста как способ формирования языковых комуникативных компетенций учащихся Презентация "Архитектура древней Греции 4 класс" - скачать презентации по МХК
Презентация "Архитектура древней Греции 4 класс" - скачать презентации по МХК Утилизация отходов – проблема 21 века
Утилизация отходов – проблема 21 века  Поперечные электромагнитные волны
Поперечные электромагнитные волны Наследование. Классы в С++
Наследование. Классы в С++ Преобразователь НБ-436В
Преобразователь НБ-436В Система метролоогического обеспечения в Российской Федерации
Система метролоогического обеспечения в Российской Федерации Правоохранительные органы
Правоохранительные органы Новая рекламная кампания «Мы сделаем все сами» ГрузовичкоФ. сделает всё сам
Новая рекламная кампания «Мы сделаем все сами» ГрузовичкоФ. сделает всё сам Формы государственного устройства
Формы государственного устройства Създаване на БЛОГ за нуждите на часовете по чужд език Албена Димитрова Серра, Даниела Александрова и Агапито Флориано Лакайе СЪЗДА
Създаване на БЛОГ за нуждите на часовете по чужд език Албена Димитрова Серра, Даниела Александрова и Агапито Флориано Лакайе СЪЗДА Совершенствование системы оплаты труда персонала организации
Совершенствование системы оплаты труда персонала организации ФИЗИОЛОГИЯ АНАЛИЗАТОРОВ
ФИЗИОЛОГИЯ АНАЛИЗАТОРОВ  Culture shock of Island
Culture shock of Island Создание многофайловых проектов. Их компиляция и сборка. Работа с заголовочными файлами
Создание многофайловых проектов. Их компиляция и сборка. Работа с заголовочными файлами Гаагские конвенции 1899 и 1907 годов: эволюция международного гуманитарного права на случай войны. (анализ документов)
Гаагские конвенции 1899 и 1907 годов: эволюция международного гуманитарного права на случай войны. (анализ документов) Електронні ваги
Електронні ваги Презентация Электронное декларирование
Презентация Электронное декларирование Информационные технологии корпоративных сетей
Информационные технологии корпоративных сетей Теории управления персоналом
Теории управления персоналом