Содержание
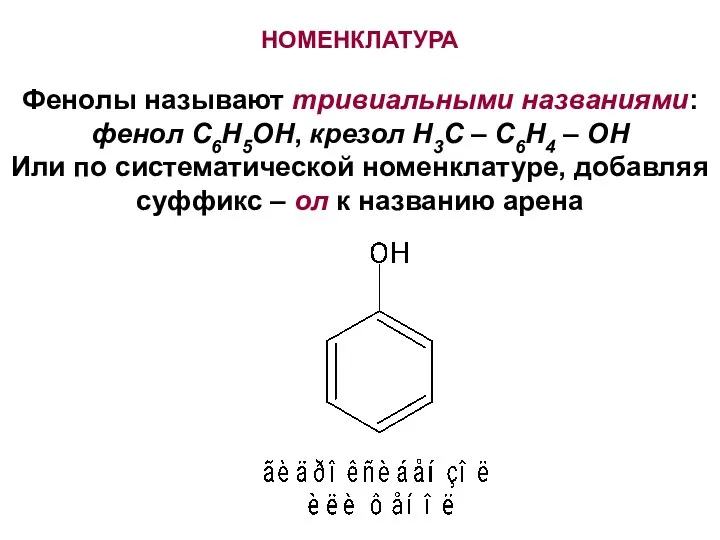
- 2. НОМЕНКЛАТУРА Фенолы называют тривиальными названиями: фенол С6H5OH, крезол H3C – C6H4 – OH Или по систематической
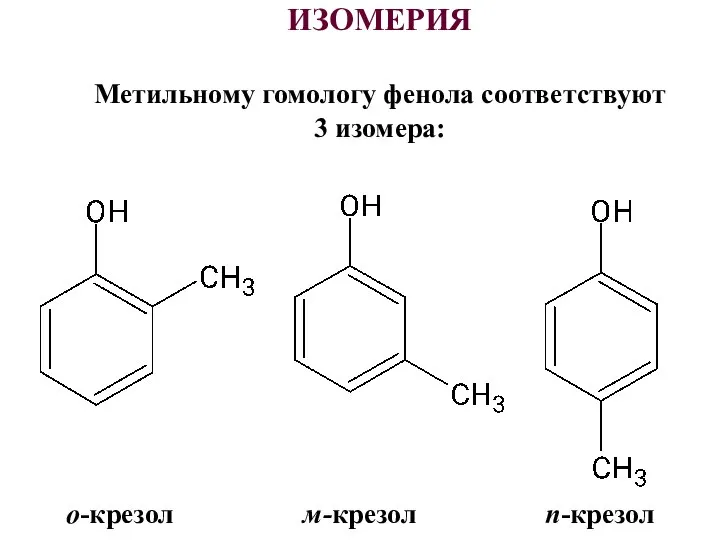
- 3. ИЗОМЕРИЯ Метильному гомологу фенола соответствуют 3 изомера:
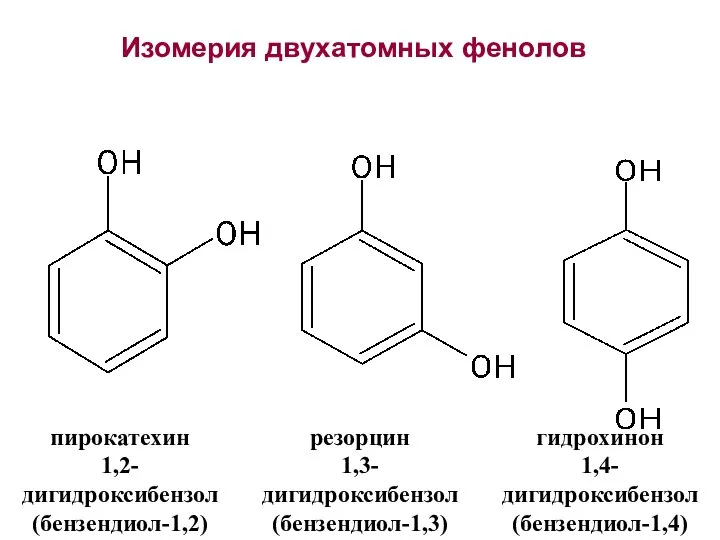
- 4. Изомерия двухатомных фенолов
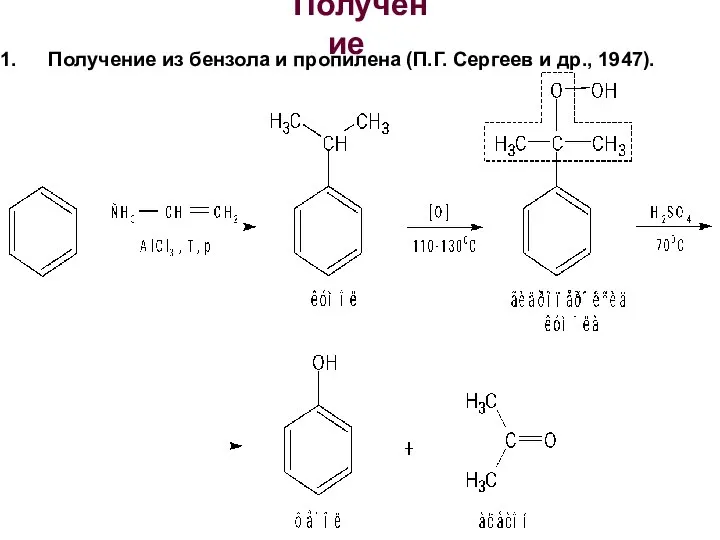
- 5. Получение Получение из бензола и пропилена (П.Г. Сергеев и др., 1947).
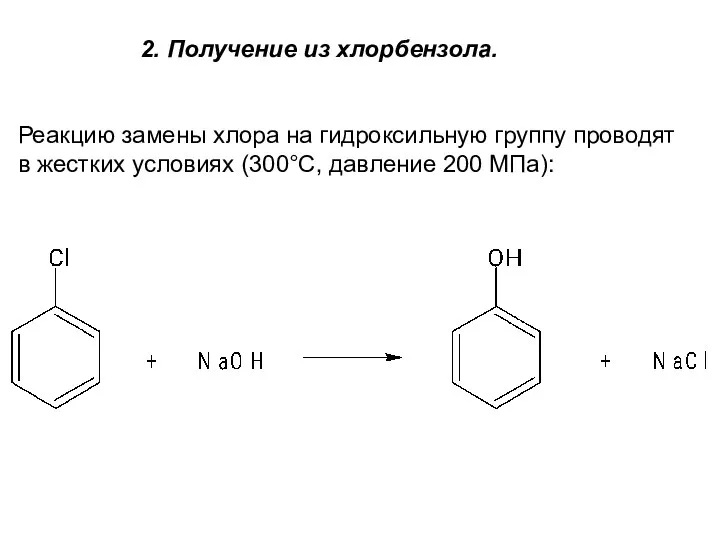
- 6. 2. Получение из хлорбензола. Реакцию замены хлора на гидроксильную группу проводят в жестких условиях (300°С, давление
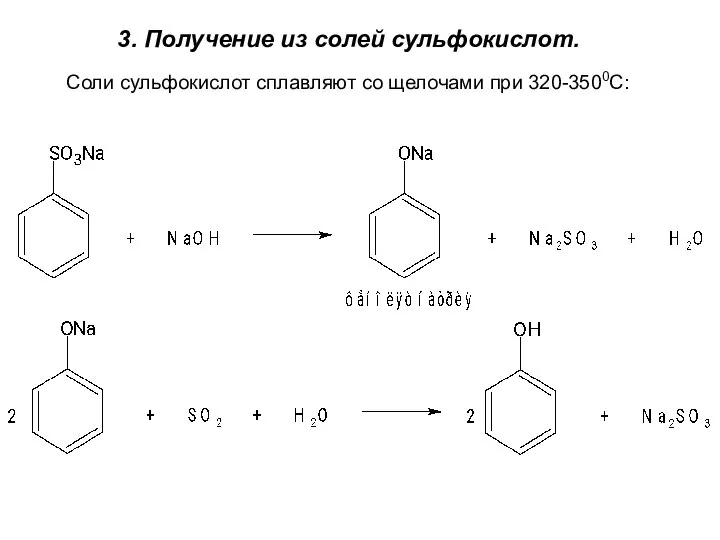
- 7. 3. Получение из солей сульфокислот. Соли сульфокислот сплавляют со щелочами при 320-3500C:
- 8. Физические свойства Фенол – кристаллическое вещество, трудно растворимое в воде. С увеличением числа гидроксильных групп растворимость
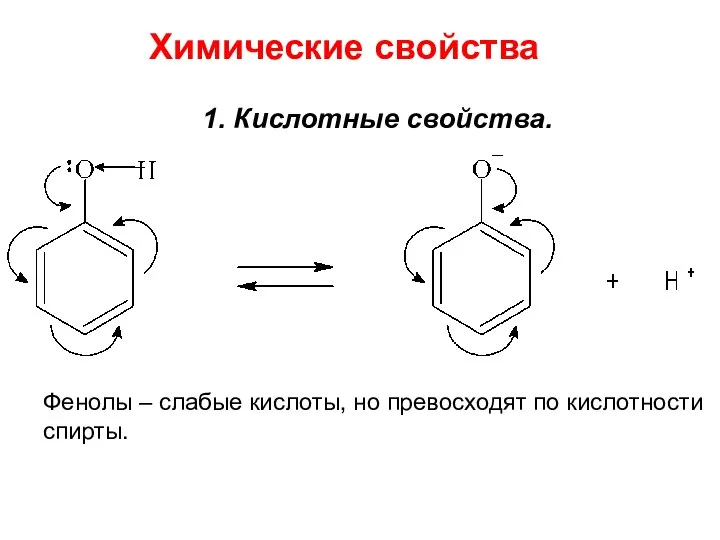
- 9. Химические свойства 1. Кислотные свойства. Фенолы – слабые кислоты, но превосходят по кислотности спирты.
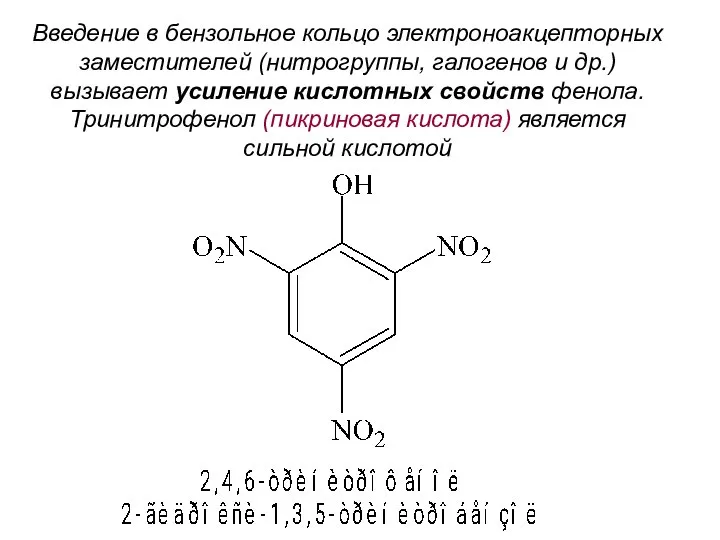
- 10. Введение в бензольное кольцо электроноакцепторных заместителей (нитрогруппы, галогенов и др.) вызывает усиление кислотных свойств фенола. Тринитрофенол
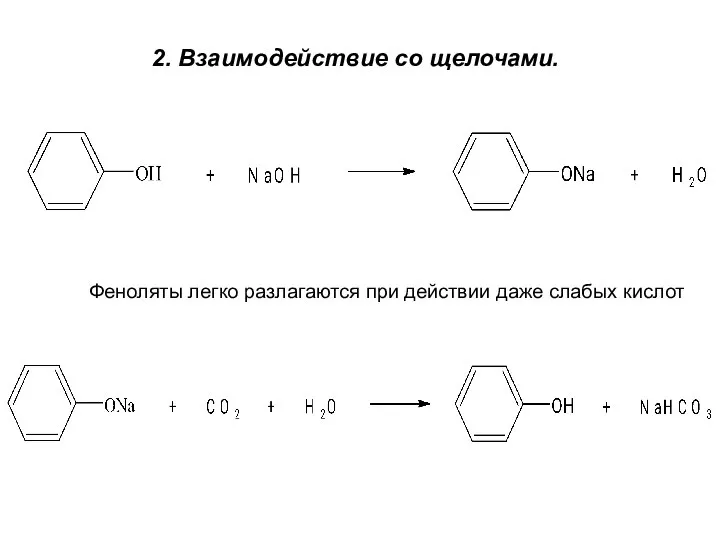
- 11. 2. Взаимодействие со щелочами. Феноляты легко разлагаются при действии даже слабых кислот
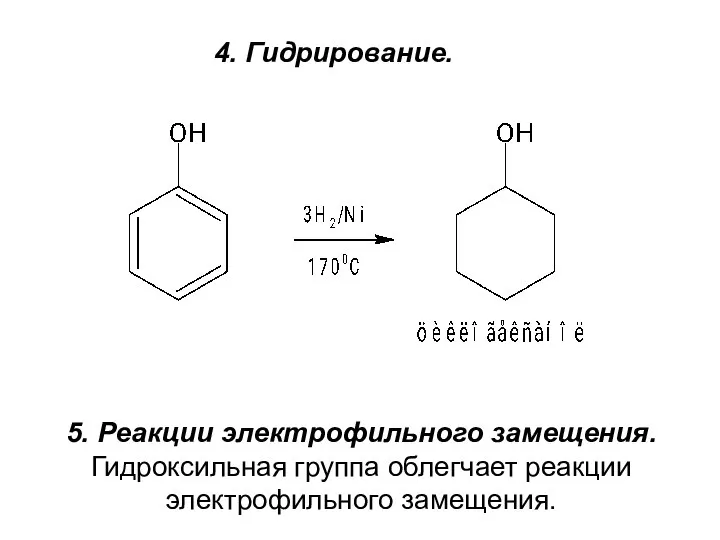
- 12. 4. Гидрирование. 5. Реакции электрофильного замещения. Гидроксильная группа облегчает реакции электрофильного замещения.
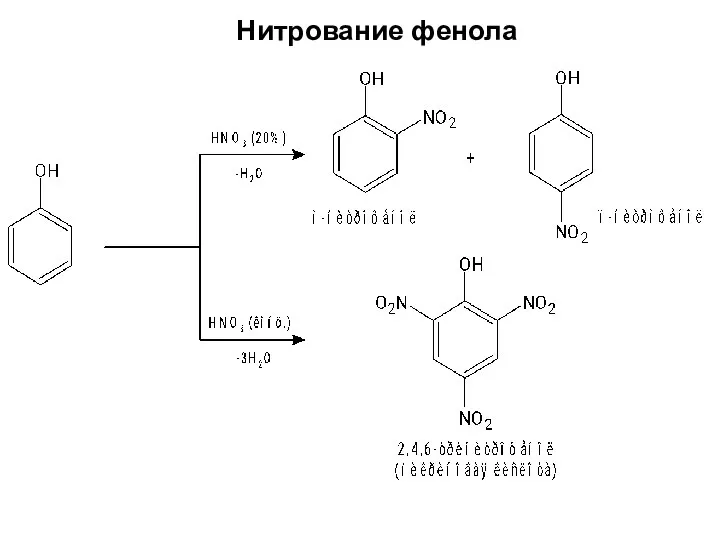
- 13. Нитрование фенола
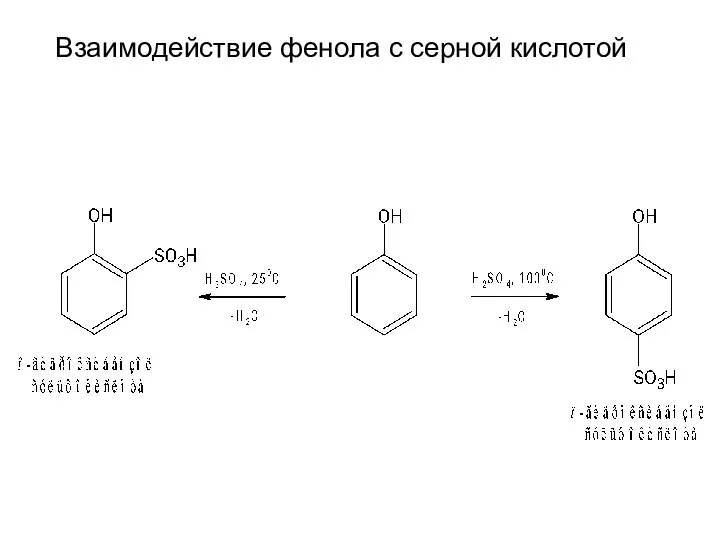
- 14. Взаимодействие фенола с серной кислотой
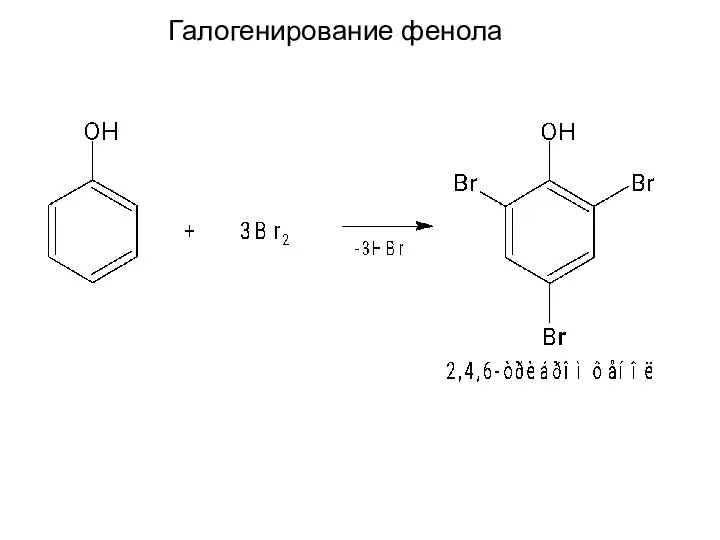
- 15. Галогенирование фенола
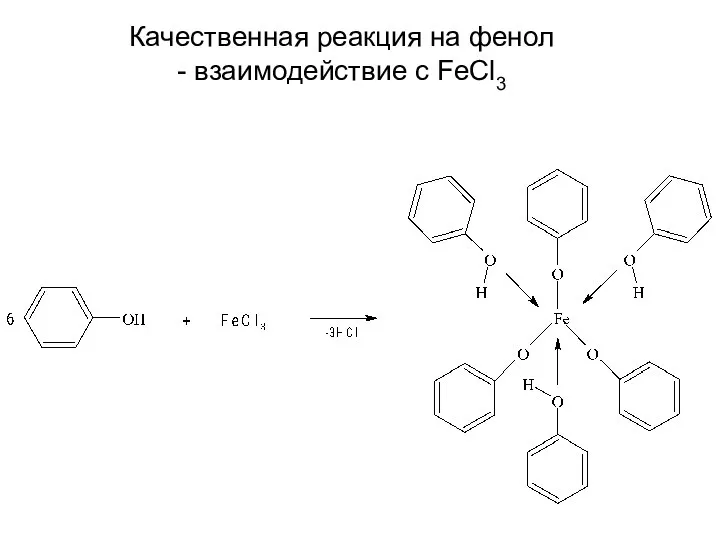
- 16. Качественная реакция на фенол - взаимодействие с FeCl3
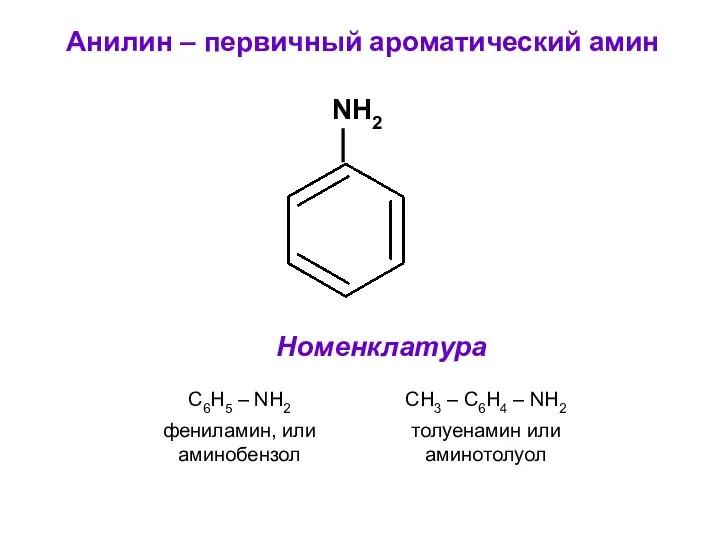
- 17. Анилин – первичный ароматический амин NH2 Номенклатура
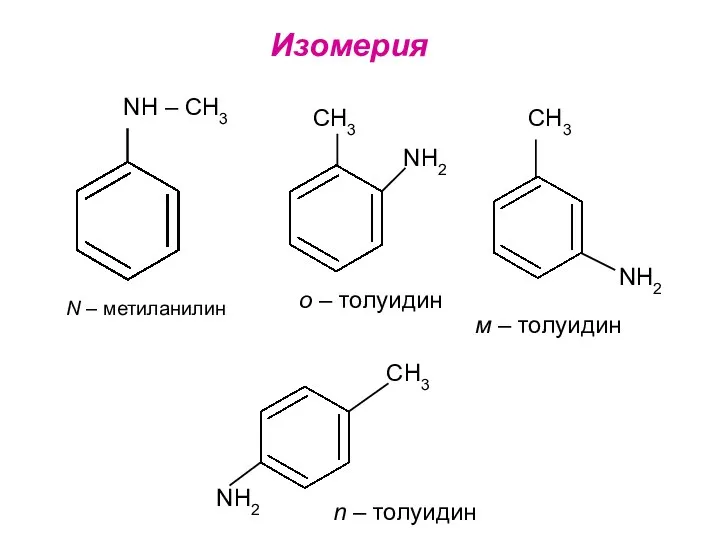
- 18. Изомерия NH – CH3 N – метиланилин CH3 NH2 о – толуидин CH3 NH2 м –
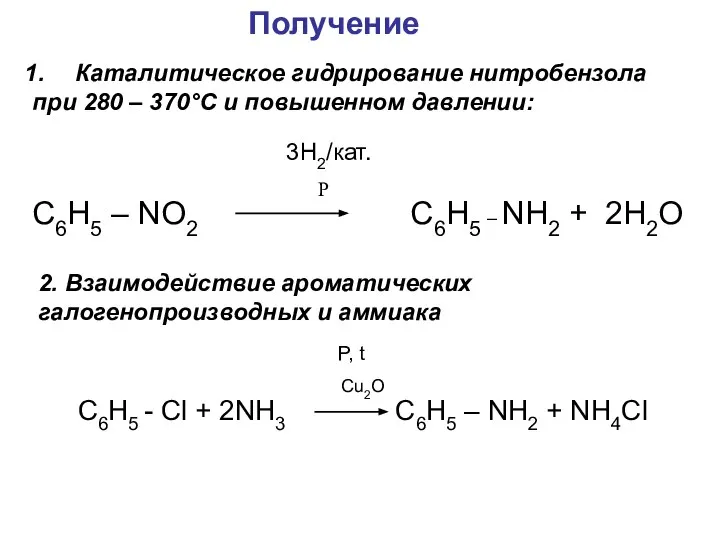
- 19. Получение Каталитическое гидрирование нитробензола при 280 – 370°С и повышенном давлении: Р C6H5 – NO2 C6H5
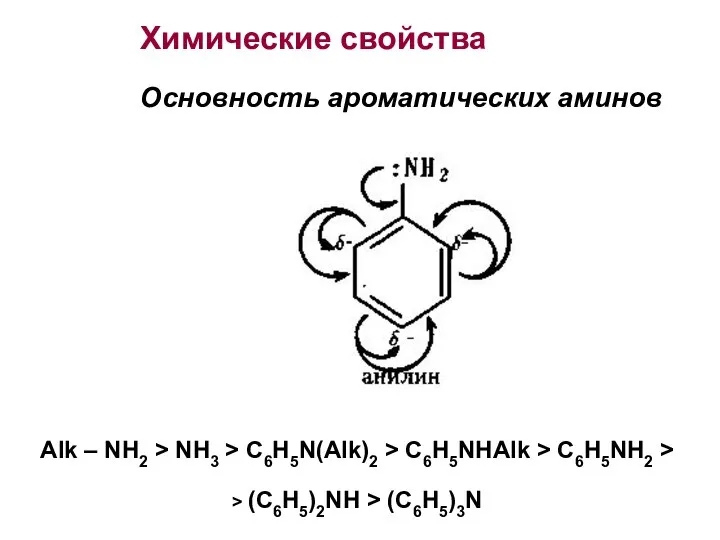
- 20. Химические свойства Основность ароматических аминов Alk – NH2 > NH3 > C6H5N(Alk)2 > C6H5NHAlk > C6H5NH2
- 21. Образование солей. С6H5 – NH2 + HCl → [C6H5 – NH3]+Cl- солянокислый анилин 2. Реакции алкилирования
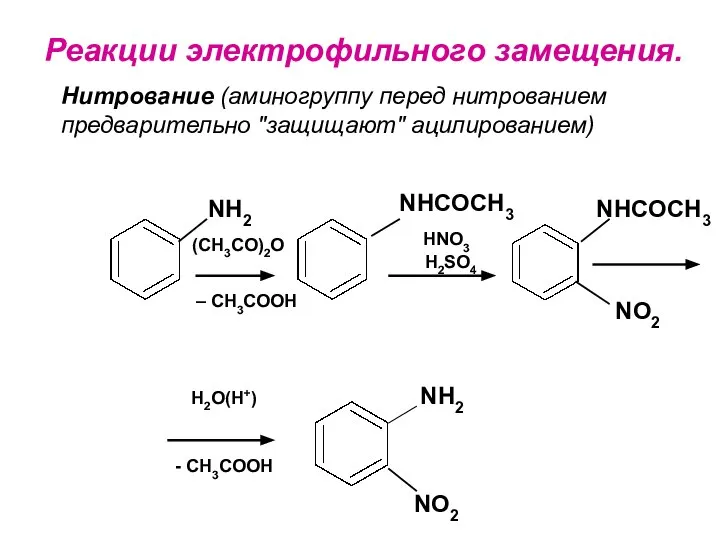
- 22. Реакции электрофильного замещения. Нитрование (аминогруппу перед нитрованием предварительно "защищают" ацилированием) NH2 NHCOCH3 NHCOCH3 NO2 (CH3CO)2O –
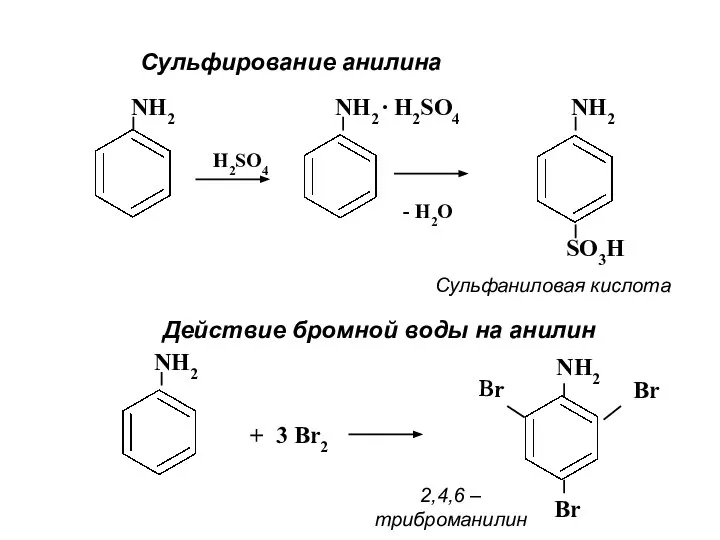
- 23. Cульфирование анилина NH2 H2SO4 NH2 ∙ H2SO4 - H2O NH2 SO3H Сульфаниловая кислота Действие бромной воды
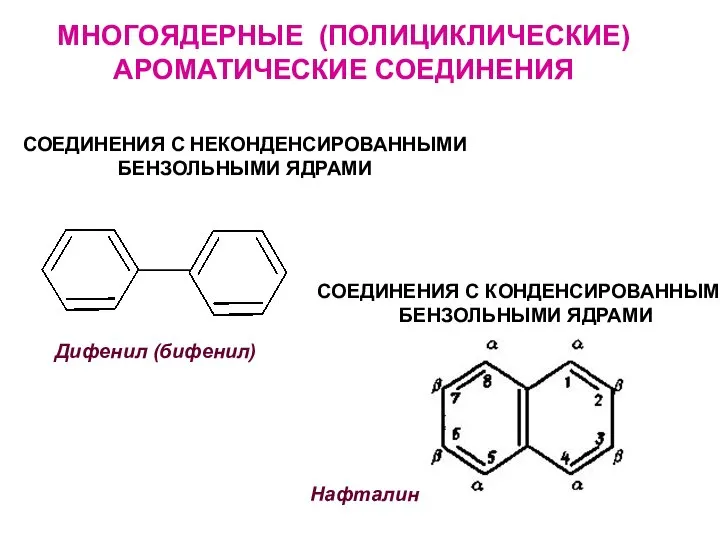
- 24. МНОГОЯДЕРНЫЕ (ПОЛИЦИКЛИЧЕСКИЕ) АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ СОЕДИНЕНИЯ С НЕКОНДЕНСИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЯДРАМИ Дифенил (бифенил) СОЕДИНЕНИЯ С КОНДЕНСИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЯДРАМИ
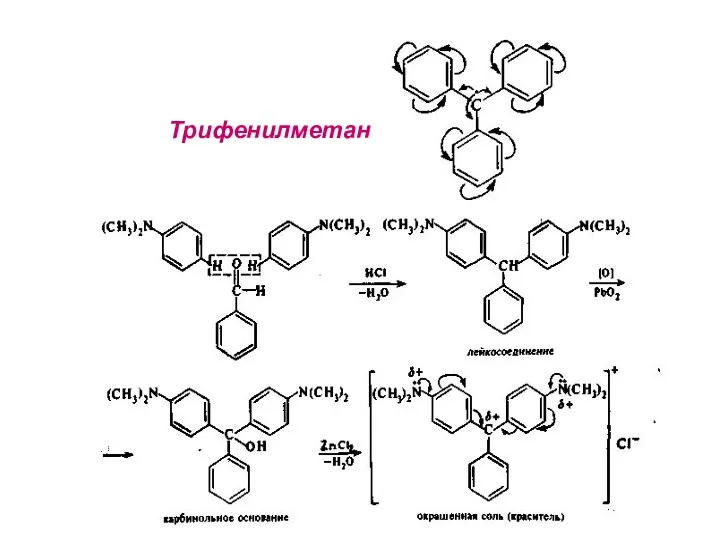
- 25. Трифенилметан
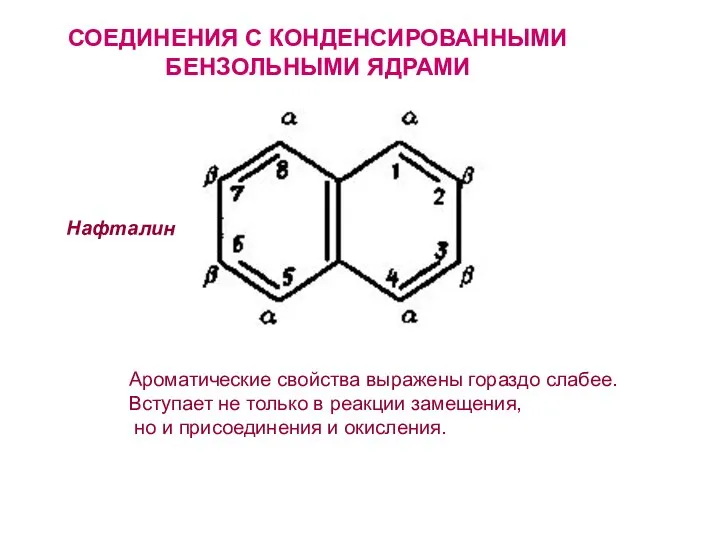
- 26. СОЕДИНЕНИЯ С КОНДЕНСИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЯДРАМИ Нафталин Ароматические свойства выражены гораздо слабее. Вступает не только в реакции
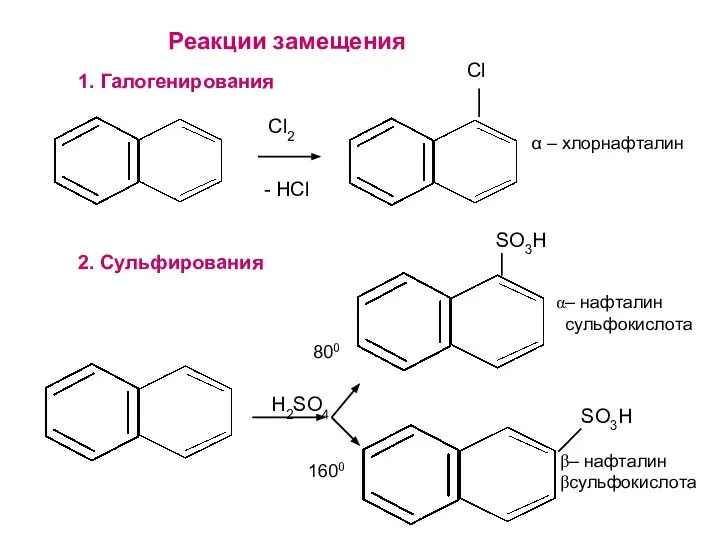
- 27. α – хлорнафталин – нафталин сульфокислота – нафталин сульфокислота Реакции замещения 1. Галогенирования 2. Сульфирования -
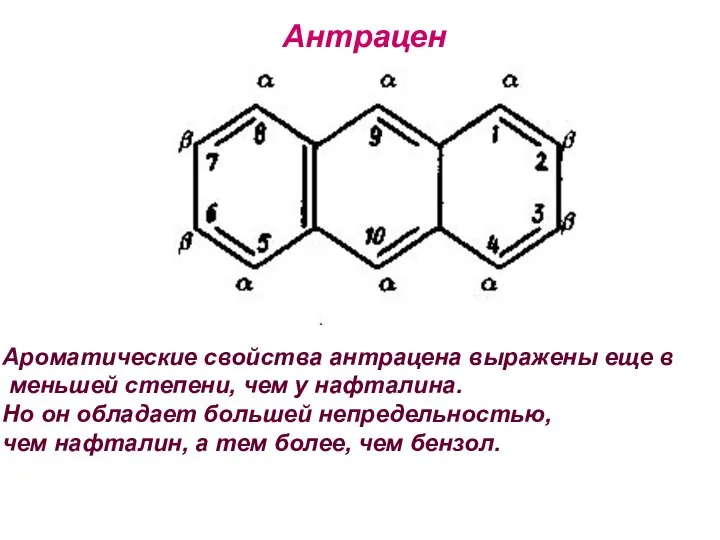
- 28. Антрацен Ароматические свойства антрацена выражены еще в меньшей степени, чем у нафталина. Но он обладает большей
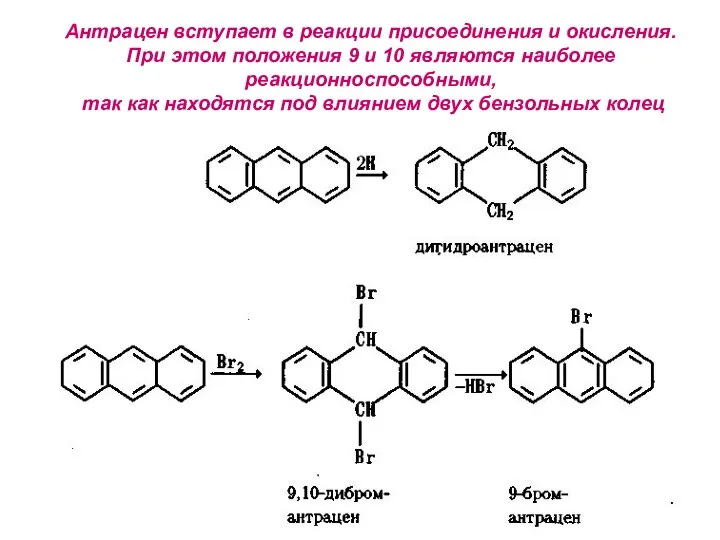
- 29. Антрацен вступает в реакции присоединения и окисления. При этом положения 9 и 10 являются наиболее реакционноспособными,
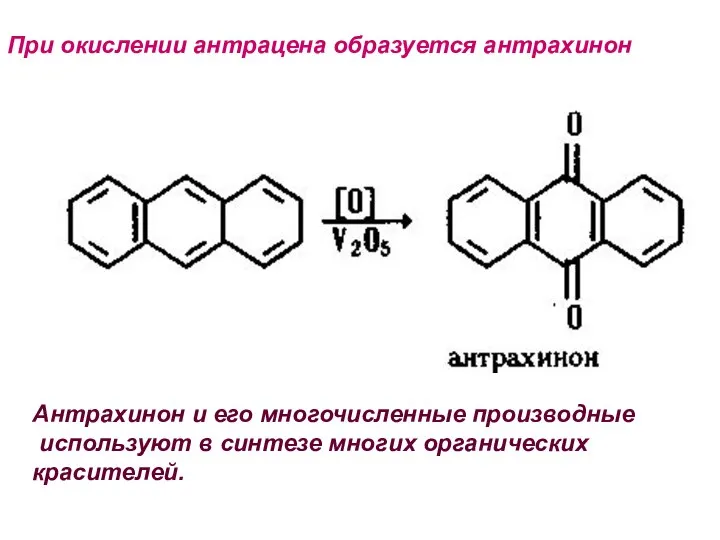
- 30. При окислении антрацена образуется антрахинон Антрахинон и его многочисленные производные используют в синтезе многих органических красителей.
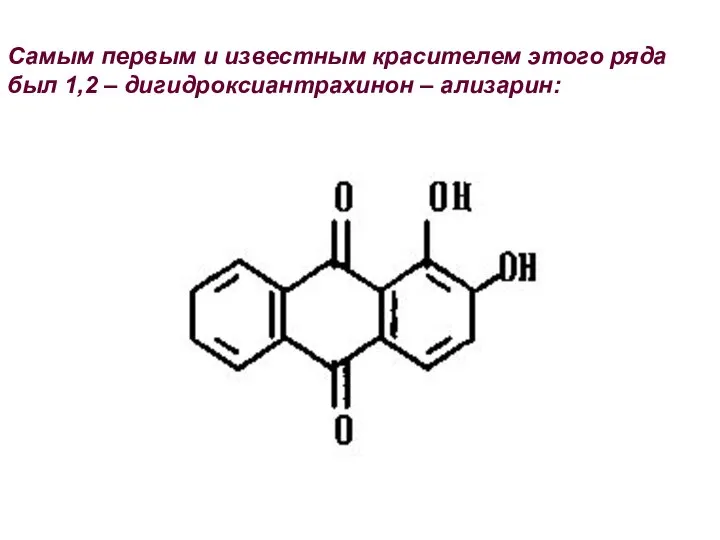
- 31. Самым первым и известным красителем этого ряда был 1,2 – дигидроксиантрахинон – ализарин:
- 33. Скачать презентацию

![Образование солей. С6H5 – NH2 + HCl → [C6H5 – NH3]+Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1303988/slide-20.jpg)
 наш адрес в мире - презентация для начальной школы
наш адрес в мире - презентация для начальной школы Лизинг ИМ корп.мен 5-1 Чистовой Анастасии
Лизинг ИМ корп.мен 5-1 Чистовой Анастасии Ядерный автомобильный двигатель
Ядерный автомобильный двигатель Либералы, консерваторы, социалисты: какими должно быть общество и государство
Либералы, консерваторы, социалисты: какими должно быть общество и государство ЧЕМ БОЛЕЛ ВЕЛИКИЙ ВАН ГОГ? La tristesse durera toujours («Печаль будет длиться вечно»)
ЧЕМ БОЛЕЛ ВЕЛИКИЙ ВАН ГОГ? La tristesse durera toujours («Печаль будет длиться вечно»)  Народные промыслы
Народные промыслы  Трансформатор – основний пристрій для перетворення електричної енергії
Трансформатор – основний пристрій для перетворення електричної енергії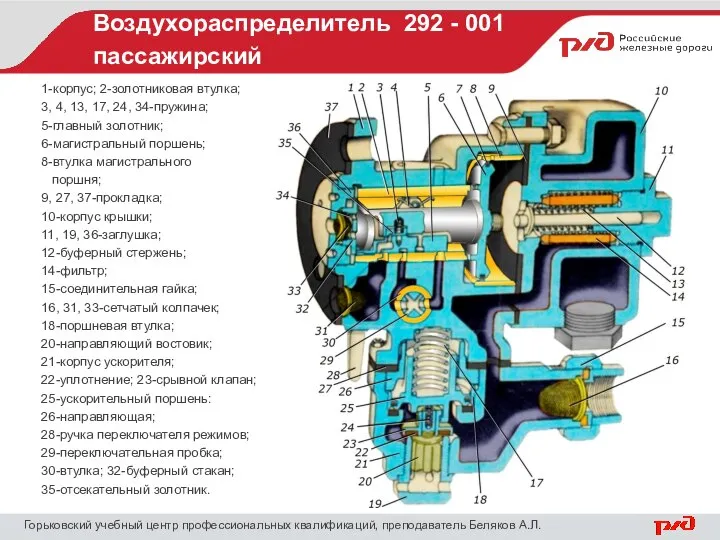 Воздухораспределитель 292 - 001 пассажирский
Воздухораспределитель 292 - 001 пассажирский Обработка исключений
Обработка исключений Культура Древней Руси
Культура Древней Руси Let’s learn Korean
Let’s learn Korean Тормозная система ВАЗ 2114
Тормозная система ВАЗ 2114 Губкин спортивный
Губкин спортивный Презентация "Поведение фирмы в условиях монополии" - скачать презентации по Экономике
Презентация "Поведение фирмы в условиях монополии" - скачать презентации по Экономике Презентация Культура России в 19 веке
Презентация Культура России в 19 веке  Кинематика вращательного движения
Кинематика вращательного движения Формирование государства на Руси. Русь Феодальная IX- начала XVII вв.
Формирование государства на Руси. Русь Феодальная IX- начала XVII вв. Machen sie sich mit neuen buchstaben und kombinationen vertraut
Machen sie sich mit neuen buchstaben und kombinationen vertraut Китай. Шаолинь (буддизм)
Китай. Шаолинь (буддизм) Самые необычные природные явления
Самые необычные природные явления Трансформация сопротивлений в линиях передачи
Трансформация сопротивлений в линиях передачи Теория сетевого планирования (пример)
Теория сетевого планирования (пример) Презентация "Томас Шон Коннери (Thomas Sean Connery)" - скачать презентации по МХК
Презентация "Томас Шон Коннери (Thomas Sean Connery)" - скачать презентации по МХК иерсинии
иерсинии Урок по предпринимательству
Урок по предпринимательству  Организация производства и продаж прибора для неинвазивного мониторинга содержания сахара в крови
Организация производства и продаж прибора для неинвазивного мониторинга содержания сахара в крови Франкфуртська школа
Франкфуртська школа Анализ архитектуры исторического и современного города
Анализ архитектуры исторического и современного города