1. Измерение содержания различных пигментов (хлорофилл);
2. Сортировка клеток по содержанию
ДНК и РНК, в том числе изучение фаз клеточного цикла;
3. Определение количества копий ДНК в клетке;
4. Сортировка клеток по содержанию РНК;
5. Изучение структуры хромосом;
6. Изучение экспрессии белков и их локализацию;
7. Сортировка клеток по содержанию в них трансгеных продуктов
(белок зеленой флуоресценции – green fluorescenece protein)
и др.);
8. Изучение внутриклеточного содержания цитокинов или вторичных мессенджеров;
9. Выявление клеток, имеющих поверхностные антигены;
10. Измерение ферментативной активности;
11. Определение жизнеспособности клеток;
12. Оценка «дыхательного взрыва» макрофагов;
13. Оценка устойчивости опухолевых клеток к химиотерапевтическим препаратам
и др.
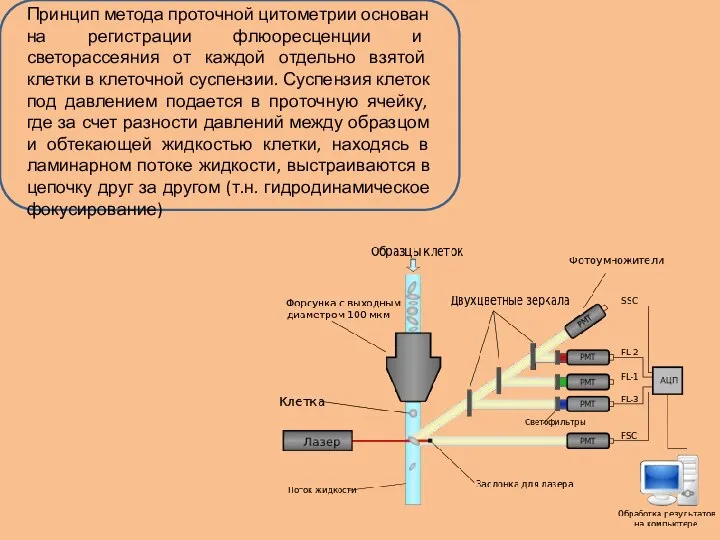
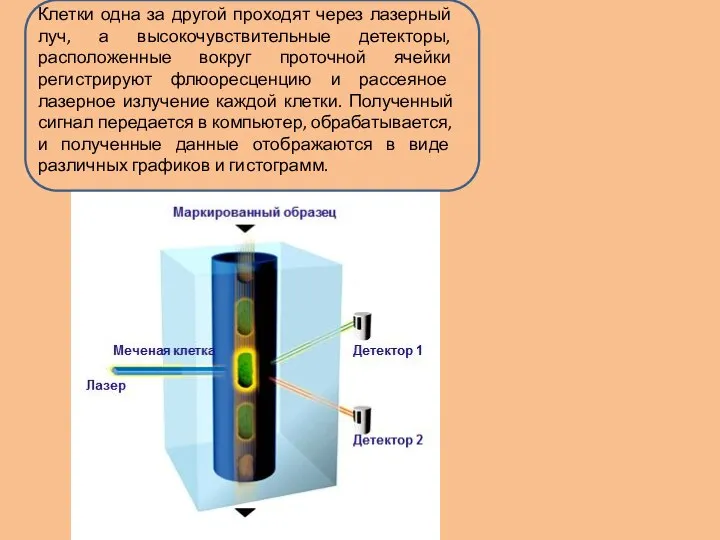
Информация, получаемая на основе анализа клеток








 Есеп беру. Алматытелекомнын атқаратын қызметі. Транспорттық желінің сипаттамасы
Есеп беру. Алматытелекомнын атқаратын қызметі. Транспорттық желінің сипаттамасы Правовая подготовка
Правовая подготовка Электрооборудование лифтов
Электрооборудование лифтов Исследовательские подходы и инструментарий проведения аудита персонала
Исследовательские подходы и инструментарий проведения аудита персонала Силовые линии электростатического поля Теорема Остроградского-Гаусса
Силовые линии электростатического поля Теорема Остроградского-Гаусса Урок информатики в 3 классе Работа учительницы начальных классов МОУ «Новоатайская СОШ» Яковлевой Светланы Витальевны
Урок информатики в 3 классе Работа учительницы начальных классов МОУ «Новоатайская СОШ» Яковлевой Светланы Витальевны Основы логики
Основы логики Нанесение размеров. Масштабы
Нанесение размеров. Масштабы Презентация "Бюджет государства" - скачать презентации по Экономике
Презентация "Бюджет государства" - скачать презентации по Экономике Новая книга «Оценка программ: методология и практика» Российско-американский проект представляют Росс Коннер, Алексей Кузьмин и
Новая книга «Оценка программ: методология и практика» Российско-американский проект представляют Росс Коннер, Алексей Кузьмин и Христианство. Католицизм. Часть II. Храм
Христианство. Католицизм. Часть II. Храм Программа "Антизомби"
Программа "Антизомби" Влияние цвета на организм человека
Влияние цвета на организм человека Религиозный терроризм
Религиозный терроризм Понятие и элементы политической модернизации
Понятие и элементы политической модернизации Проект устройства в виде очков или шлема, способного заменять видимый человеком объект на какой-либо другой объект
Проект устройства в виде очков или шлема, способного заменять видимый человеком объект на какой-либо другой объект Z -преобразование
Z -преобразование  Петр Смирнов
Петр Смирнов Татьянин день
Татьянин день СИНЭКОЛОГИЯ
СИНЭКОЛОГИЯ Вознесение Господне
Вознесение Господне Презентация Применение экспортного тарифа
Презентация Применение экспортного тарифа Уголок Н.Н.Благова С. Андреевка Чердаклинский район
Уголок Н.Н.Благова С. Андреевка Чердаклинский район Проект-журнал - презентация для начальной школы
Проект-журнал - презентация для начальной школы Easter in britain and russia
Easter in britain and russia А. И. Курнаков
А. И. Курнаков Микроконтроллерное устройство защиты электрооборудования
Микроконтроллерное устройство защиты электрооборудования Память 1
Память 1