Содержание
- 2. ЭЛЕКТРОФОРЕЗ – движение заряженных молекул в растворе (токопроводящей среде) под действием сил постоянного электрического поля Метод
- 3. Большинство биомолекул содержат ионизирующиеся функциональные группы, которые при определенных значениях рН обеспечивают молекуле свойства катиона или
- 4. Различия в скоростях движения заряженных молекул смеси будет определяться: - усиливает движение: движущая сила электрического поля,
- 5. Материалы носителя для электрофореза Хроматографическая бумага Ацетат целлюлозы Тонкие слои оксидов Si и Al Гели: -
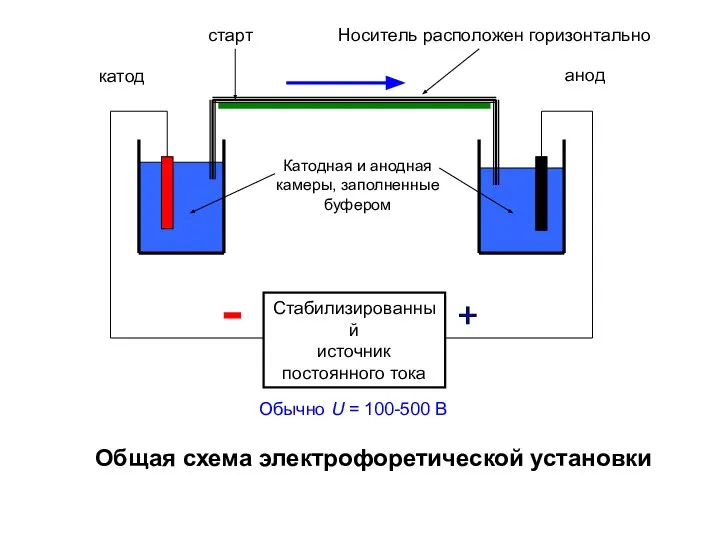
- 6. Стабилизированный источник постоянного тока катод анод Общая схема электрофоретической установки Катодная и анодная камеры, заполненные буфером
- 7. Буферы для электрофореза: фосфатный буфер веронал-мединаловый буфер трис-HCl буфер трис-глициновый буфер ацетатный буфер боратный буфер Буферы
- 8. Виды электрофореза Аналитический Э/Ф: - качественный анализ - количественный анализ - оценка чистоты препаратов - определение
- 9. Диск-электрофорез (Дэвис, 1959) Связан с изобретением полиакриламидного геля. Термин происходит от англ. discontinuous = преры- вистый,
- 10. Исходные компоненты для приготовления ПААГ гото- вят в виде отдельных растворов. В состав включают буфер для
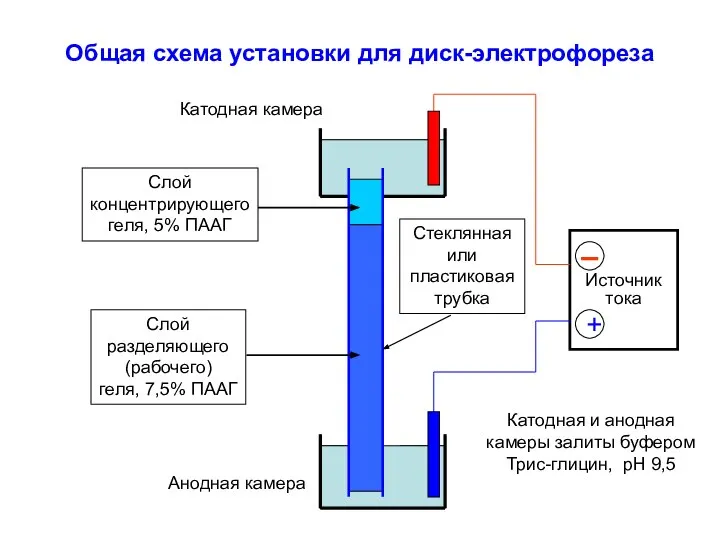
- 11. Общая схема установки для диск-электрофореза Источник тока + Катодная камера Анодная камера Стеклянная или пластиковая трубка
- 12. Преимущества диск-электрофореза в ПААГ: Самая высокая разрешающая способность по сравнению со всеми остальными носителями. Обусловлена возмо-
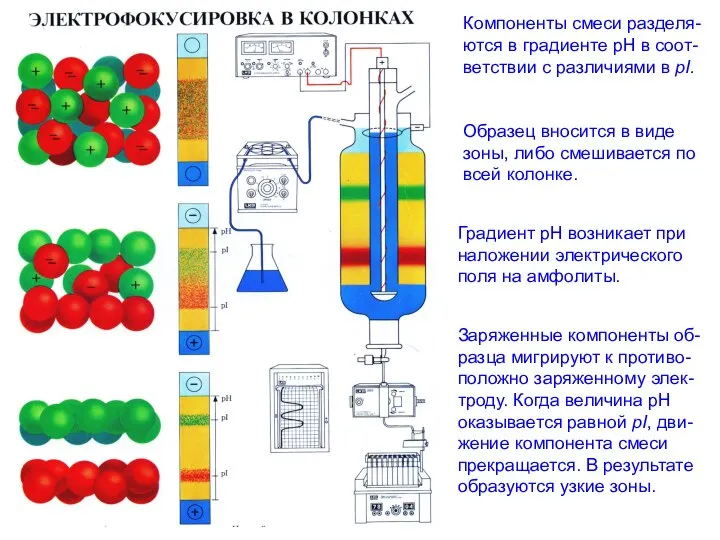
- 13. Изоэлектрическое фокусирование Используется для разделения смеси белков на градиенте рН. Каждая молекула смеси движется по носителю
- 14. Компоненты смеси разделя- ются в градиенте рН в соот- ветствии с различиями в рI. Градиент рН
- 15. Применение изоэлектрического фокусирования: Чаще всего этот вид электрофореза используют для разделения в один прием смесей белков
- 16. Иммуноэлектрофорез Метод сочетает в себе электрофорез и иммунодиф- фузию. Служит для качественного и количественного анали- за
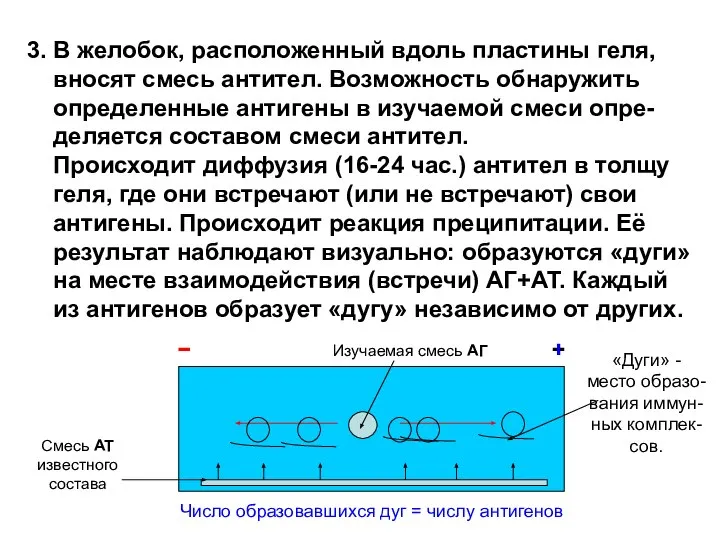
- 17. 3. В желобок, расположенный вдоль пластины геля, вносят смесь антител. Возможность обнаружить определенные антигены в изучаемой
- 19. Скачать презентацию












 Свойства степени с натуральным показателем
Свойства степени с натуральным показателем Чемпионы мира по шахматам. Сильнейшие шахматисты от древности до наших дней
Чемпионы мира по шахматам. Сильнейшие шахматисты от древности до наших дней Землі сільськогосподарського призначення як об'єкт правового регулювання
Землі сільськогосподарського призначення як об'єкт правового регулювання Презентация по английскому языку
Презентация по английскому языку Переговоры и этикет
Переговоры и этикет Бизнес-планирование как инструмент управления бизнесом малых и средних предприятий, необходимый для создания конкурентных пр
Бизнес-планирование как инструмент управления бизнесом малых и средних предприятий, необходимый для создания конкурентных пр Презентация на тему: Культура Индии
Презентация на тему: Культура Индии Тромбоциты, функция,диагностика
Тромбоциты, функция,диагностика Сөйлеу және оның түрлері
Сөйлеу және оның түрлері Краеведческая работа в школе Историческое краеведение раскрывает учащимся связи родного края с Россией, является важным средств
Краеведческая работа в школе Историческое краеведение раскрывает учащимся связи родного края с Россией, является важным средств Диаграмма деятельности
Диаграмма деятельности Программирование циклических алгоритмов. Операции с памятью. Обработка структур данных (массивов)
Программирование циклических алгоритмов. Операции с памятью. Обработка структур данных (массивов) Внесение изменений в ст. 205.1 УК РФ «Содействие террористической деятельности»
Внесение изменений в ст. 205.1 УК РФ «Содействие террористической деятельности» Презентация на тему "Самопрезентация2" - скачать презентации по Педагогике_
Презентация на тему "Самопрезентация2" - скачать презентации по Педагогике_ Конституция Российской Федерации
Конституция Российской Федерации Изучай и охраняй природу родного края - презентация для начальной школы_
Изучай и охраняй природу родного края - презентация для начальной школы_ Молодежный проект «Студенческая инициатива». О спорт, ты мир! (Пьер де Кубертен)
Молодежный проект «Студенческая инициатива». О спорт, ты мир! (Пьер де Кубертен) Система зажигания
Система зажигания Introduce to Petri nets
Introduce to Petri nets Загальна будова додаткового обладнання вантажного автомобіля
Загальна будова додаткового обладнання вантажного автомобіля Карл Теодор Вильгельм Вейерштрасс
Карл Теодор Вильгельм Вейерштрасс Разработка быстродействующего 12-разрядного ЦАП с суммированием токов
Разработка быстродействующего 12-разрядного ЦАП с суммированием токов Субъект преступления. Тема 5
Субъект преступления. Тема 5 Условные операторы
Условные операторы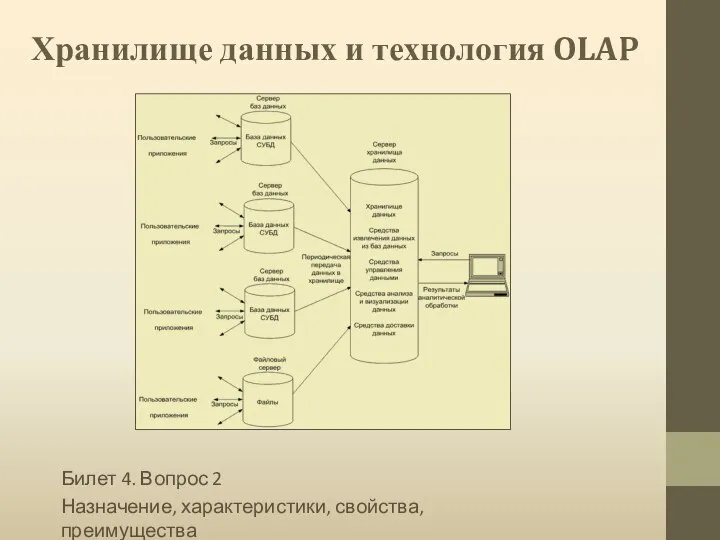 Хранилище данных и технология OLAP
Хранилище данных и технология OLAP Характеристика оздоровительных задач и методика их решения на уроках физкультуры учащихся младшего, среднего и старшего возраста
Характеристика оздоровительных задач и методика их решения на уроках физкультуры учащихся младшего, среднего и старшего возраста Футбол. Без футбола жить нельзя
Футбол. Без футбола жить нельзя О расстановке политических сил перед выборами Президента РФ в Кемеровской области
О расстановке политических сил перед выборами Президента РФ в Кемеровской области