Содержание
- 2. Электрокинетические свойства коллоидно‒дисперсных систем. Строение мицелл Лекция №23 курса «Общая химия» Лектор: проф. Иванова Надежда Семёновна
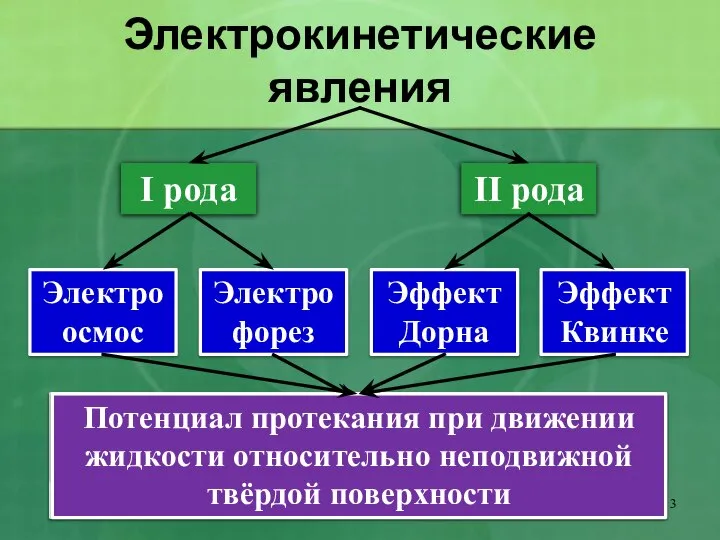
- 3. Электрокинетические явления I рода II рода Электрофорез Электроосмос Эффект Дорна Эффект Квинке Движение частиц ДФ в
- 4. Мицеллярная теория лиофобных золей Мицелла ‒ гетерогенная микросистема, состоящая из микрокристалла ДФ, окружённого сольватированными ионами стабилизатора.
- 5. Мицеллярная теория лиофобных золей – агрегат с адсорбированными на нём потенциалопределяющими ионами (ПОИ). – ионы, сообщающие
- 6. Мицеллярная теория лиофобных золей – ядро с адсорбционным слоем противоионов, являющаяся гигантским многозарядным ионом. Источником ПОИ
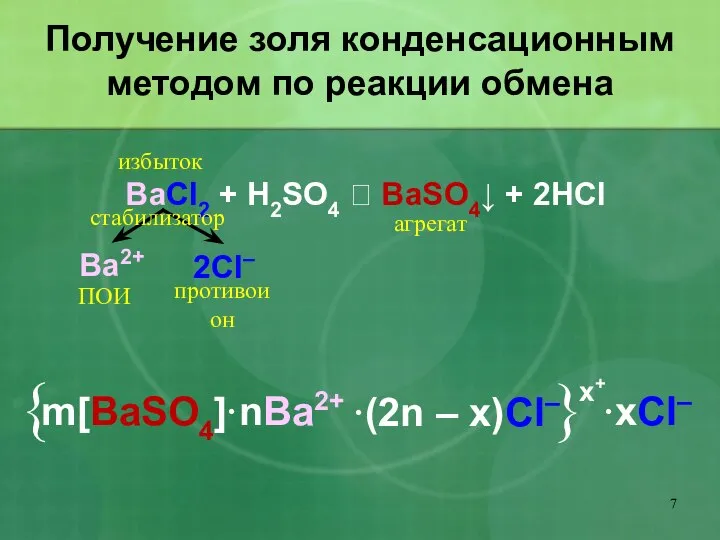
- 7. Получение золя конденсационным методом по реакции обмена BaCl2 + H2SO4 ? BaSO4↓ + 2HCl избыток агрегат
- 8. Мицелла {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl– агрегат адсорбционный слой ядро гранула диффузионный слой
- 9. Факторы агрегативной устойчивости золя Одноимённый заряд коллоидных частиц; Гидратная (сольватная) оболочка, окружающая ионы диффузионного слоя. BaSO4
- 10. Возникновение ДЭС и потенциалов в мицелле {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl– На границе
- 11. Возникновение ДЭС и потенциалов в мицелле По величине 0 ≤ ζ ζкрит. = ±30 мВ. При
- 12. Факторы, влияющие на ζ Концентрация стабилизатора. Состояние ИЭТ золя, ζ = 0. Золь разрушается. Концентрация посторонних
- 13. {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ •xCl– Электрофорез и электроосмос катод анод Электрофорез Электроосмос
- 14. Расчёт ζ Поскольку ζ обнаруживает себя при попадании мицеллы в электрическое поле, для его расчёта используются
- 16. Скачать презентацию




![Мицелла {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl– агрегат адсорбционный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304812/slide-7.jpg)

![Возникновение ДЭС и потенциалов в мицелле {m[BaSO4] • nBa2+ (2n –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304812/slide-9.jpg)


![{m[BaSO4] • nBa2+ (2n – x)Cl–}x+ •xCl– Электрофорез и электроосмос катод анод Электрофорез Электроосмос](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304812/slide-12.jpg)

 Зимний лагерь «ОЛИМП»
Зимний лагерь «ОЛИМП» Основные принципы оценочной деятельности
Основные принципы оценочной деятельности  Процедура получения виз в российско-германском молодежном обмене
Процедура получения виз в российско-германском молодежном обмене Протокол MGCP
Протокол MGCP Наука и искусство
Наука и искусство Инициативное предложение «Капитальный ремонт крыши Дома культуры в пгт.Мирный»
Инициативное предложение «Капитальный ремонт крыши Дома культуры в пгт.Мирный» Основные направления исследований в области искусственного интеллекта
Основные направления исследований в области искусственного интеллекта Предельные теоремы теории вероятностей. Основные понятия математической статистики.
Предельные теоремы теории вероятностей. Основные понятия математической статистики. Тіл қазынасы - мақал-мәтел
Тіл қазынасы - мақал-мәтел Памятка для пациента. Введение инсулина подкожно. Выполнил: Шумаков Артур Проверила: Зайцева М.С.
Памятка для пациента. Введение инсулина подкожно. Выполнил: Шумаков Артур Проверила: Зайцева М.С. Иван Грозный
Иван Грозный Юридический план
Юридический план Исповедь (покаяние)
Исповедь (покаяние) Планировщик заданий
Планировщик заданий Строительство в эпоху Владимиро-Суздальского княжества
Строительство в эпоху Владимиро-Суздальского княжества Эпистемические проблемы управления
Эпистемические проблемы управления МКОУ Сош № 24
МКОУ Сош № 24 Расчет стержневых систем
Расчет стержневых систем Политическая гегография
Политическая гегография ПЕРФОРАТИВНАЯ ЯЗВА (ULCUS PERFORANS)
ПЕРФОРАТИВНАЯ ЯЗВА (ULCUS PERFORANS) Усиление строительных конструкций. Способы усиления конструкций
Усиление строительных конструкций. Способы усиления конструкций Жаңадан шыққан техникалар
Жаңадан шыққан техникалар Назначение PowerShell
Назначение PowerShell Программирование на языке Паскаль. Часть II. Массивы
Программирование на языке Паскаль. Часть II. Массивы Ведучі мости, карданні передачі, коробки відбору потужності та лебідки автомобілів
Ведучі мости, карданні передачі, коробки відбору потужності та лебідки автомобілів Chrystusowi powierzamy siebie
Chrystusowi powierzamy siebie Computer structure pipeline
Computer structure pipeline Герб школы. Геральдика
Герб школы. Геральдика