Содержание
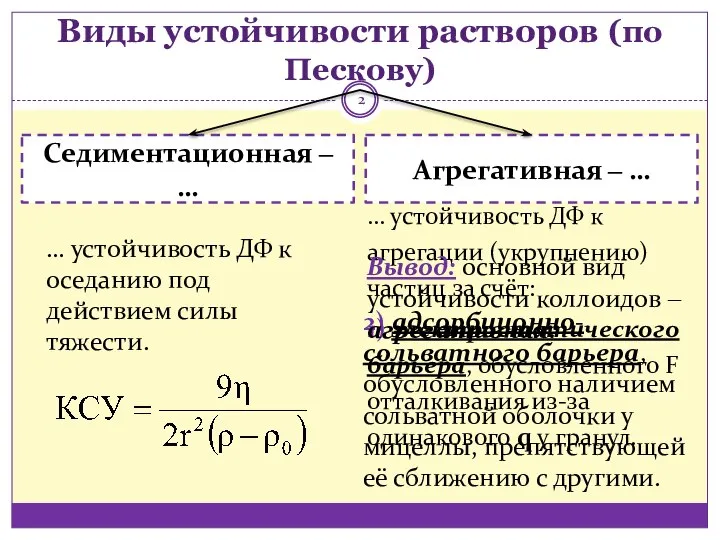
- 2. Виды устойчивости растворов (по Пескову) … устойчивость ДФ к агрегации (укрупнению) частиц за счёт: 1) электростатического
- 3. Коагуляция ‒ … … процесс слипания частиц, образование крупных агрегатов с потерей седиментационной и фазовой устойчивости
- 4. Факторы, вызывающие коагуляцию Увеличение концентрации золя приводит к уменьшению расстояния между частицами, на котором начинают действовать
- 5. Факторы, вызывающие коагуляцию Добавление электролитов наиболее сильное по 2-м причинам: из-за адсорбции ионов электролита на грануле
- 6. При изучении влияния электролитов на коагуляцию следует учитывать: коагуляция начинается при достижении порога коагуляции (сп, ск)
- 7. чем выше заряд коагулирующего иона, тем меньше сп и выше γ электролита. Правило Шульце ‒ Гарди
- 8. Правило Дерягина ‒ Ландау … … устанавливает связь между сп и зарядом коагулирующего иона. Теор.: Эксп.:
- 9. Способность ионов одного заряда к гидратации (лиотропные ряды) Факторы, вызывающие коагуляцию Li+ Na+ K+ Rb+ Cs+
- 10. Факторы, вызывающие коагуляцию «Ионы-партнёры», идущие в паре с коагулирующими ионами, уменьшают их γ в случае адсорбции
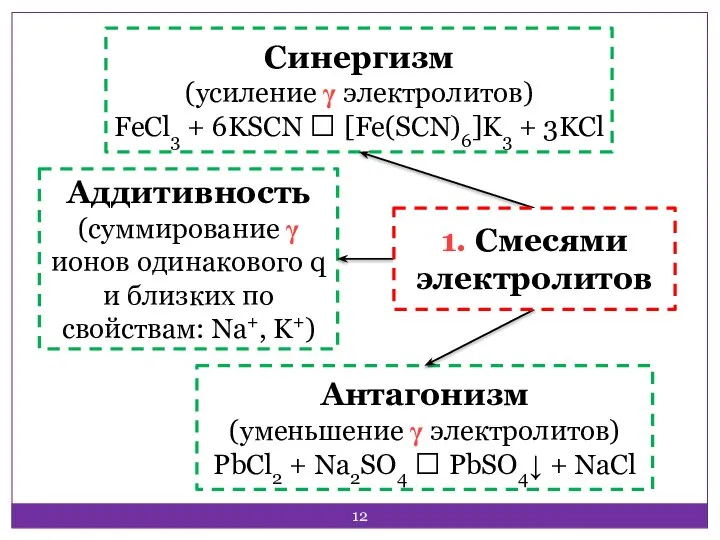
- 11. Смесями электролитов; Многозарядными ионами‒коагуляторами (чередование зон коагуляции); При смешивании коллоидов с гранулами разного по знаку заряда
- 12. Аддитивность (суммирование γ ионов одинакового q и близких по свойствам: Na+, K+) Антагонизм (уменьшение γ электролитов)
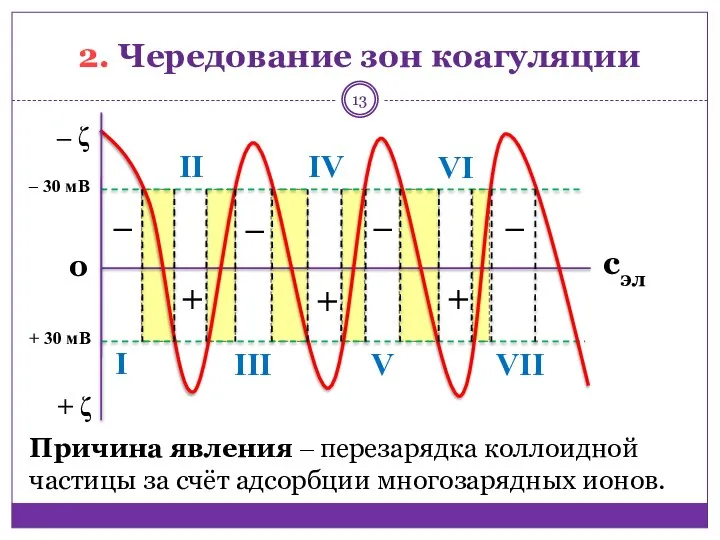
- 13. 2. Чередование зон коагуляции ‒ + + + ‒ ‒ ‒ ‒ ζ + ζ 0
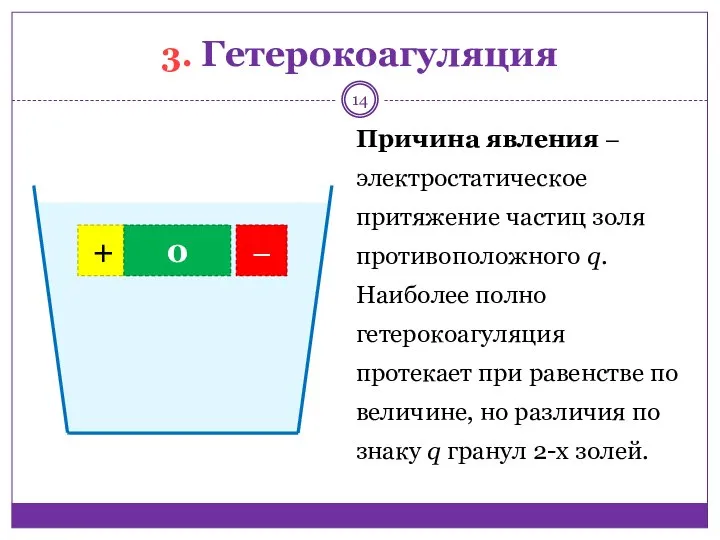
- 14. 3. Гетерокоагуляция + ‒ 0 Причина явления ‒ электростатическое притяжение частиц золя противоположного q. Наиболее полно
- 15. … вызвана добавлением очень малых количеств ВМС и понижает устойчивость коллоидов. … связана с особенностями ВМС:
- 16. Вывод: адсорбционный слой является механическим препятствием для иона ‒ коагулянта. … повышение устойчивости коллоидов добавлением ВМС
- 17. Защитное число … … min масса ВМС (мг), достаточная для предотвращения 10 см3 гидрозоля от коагулирующего
- 18. Процесс перехода свежевыпавшего при коагуляции осадка во взвешенное состояние (золь) под влиянием пептизаторов ‒ б) адсорбция
- 19. - - - Теории коагуляции Адсорбционная (Фрейндлих) Адсорбция ионов – коагулянтов на агрегате и грануле, снижение
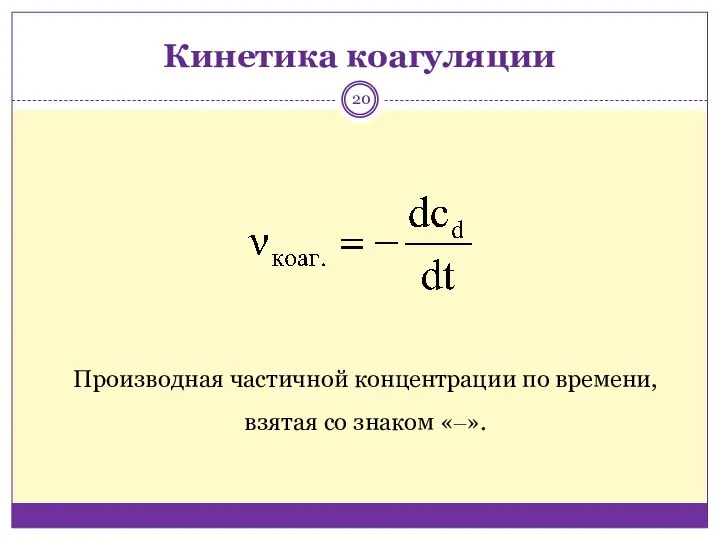
- 20. Кинетика коагуляции Производная частичной концентрации по времени, взятая со знаком «‒».
- 21. Коагуляция по Смолуховскому М. (1906г.) При столкновении 2-х первичных частиц золя появляются более крупные – вторичные
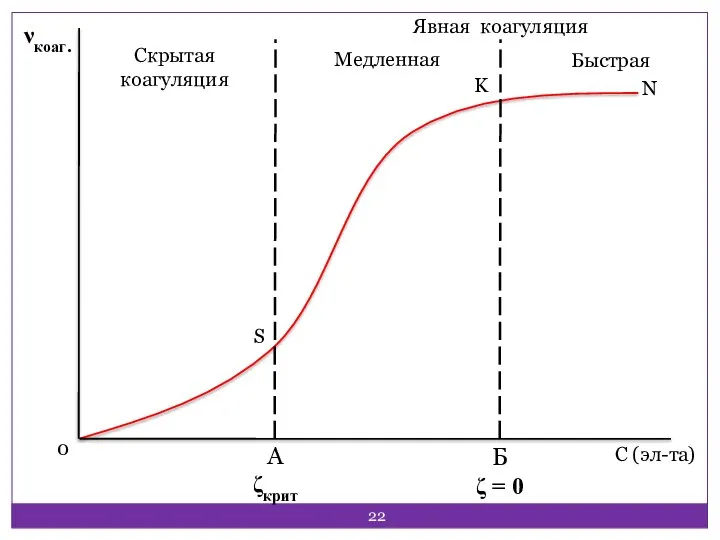
- 22. Скрытая коагуляция Медленная Быстрая Явная коагуляция S A ζкрит Б ζ = 0 С (эл-та) 0
- 23. Коагуляция Скрытая включает образование вторичных, третичных и т.д. частиц. Протекает незаметно и медленно. Явная заметна и
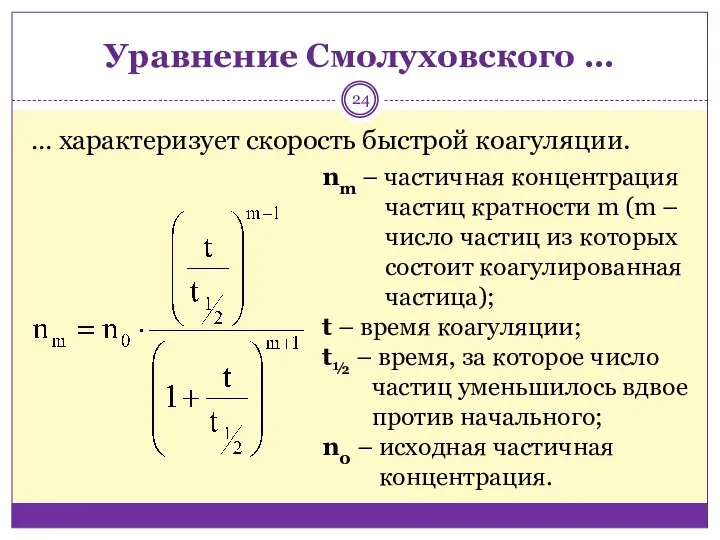
- 24. Уравнение Смолуховского … … характеризует скорость быстрой коагуляции. nm – частичная концентрация частиц кратности m (m
- 26. Скачать презентацию
















 Задача управления развитием института таможенного дела
Задача управления развитием института таможенного дела Технологии и системы коммутации. Основа временного разделения каналов
Технологии и системы коммутации. Основа временного разделения каналов Судебная практика. Качели. Возмещение вреда
Судебная практика. Качели. Возмещение вреда ВАСИЛИЙ СУРИКОВ «Боярыня Морозова» «Степан Разин» «Утро стрелецкой казни» «Меньшиков в Березове» «Покорение Сибири Ермако
ВАСИЛИЙ СУРИКОВ «Боярыня Морозова» «Степан Разин» «Утро стрелецкой казни» «Меньшиков в Березове» «Покорение Сибири Ермако Битое поле
Битое поле Портретный очерк Уроки подготовлены Л.А.Опольской, учителем МОУ СОШ №5 города-курорта Анапы
Портретный очерк Уроки подготовлены Л.А.Опольской, учителем МОУ СОШ №5 города-курорта Анапы Монополия (гр. monоs – жалғыз және poleo– сатамын)
Монополия (гр. monоs – жалғыз және poleo– сатамын) Одноковшовые экскаваторы. Классификация и обозначения. Характеристика и общее устройство. Рабочее оборудование
Одноковшовые экскаваторы. Классификация и обозначения. Характеристика и общее устройство. Рабочее оборудование Робототехника в Японии
Робототехника в Японии Презентация Анализ мяса птицы в России и за рубежом
Презентация Анализ мяса птицы в России и за рубежом  Financial markets and intermediaries Лекция 10 Деятельность банков на финансовом рынке Цель: раскрыть цель, задачи и функции банков на финансовом ры
Financial markets and intermediaries Лекция 10 Деятельность банков на финансовом рынке Цель: раскрыть цель, задачи и функции банков на финансовом ры Художественные системы в проектировании одежды
Художественные системы в проектировании одежды Основные направления исследований в области искусственного интеллекта
Основные направления исследований в области искусственного интеллекта Диагностика, техническое обслуживание и ремонт электрооборудования автомобиля Lada Priora
Диагностика, техническое обслуживание и ремонт электрооборудования автомобиля Lada Priora Договор аренды
Договор аренды НОВИНКИ МЕБЕЛИ С ЦЕНАМИ!
НОВИНКИ МЕБЕЛИ С ЦЕНАМИ! День благодарения в Германии
День благодарения в Германии Хронический гепатит
Хронический гепатит  Расчет усилительного каскада на полевом транзисторе по схеме с общим истоком
Расчет усилительного каскада на полевом транзисторе по схеме с общим истоком Как создают мультфильмы
Как создают мультфильмы Модели Менеджмента Работу выполнили Студенты 22 группы,5 подгруппа Махмудова. Л Скрыпникова. С Полоян. А Жукова. Е
Модели Менеджмента Работу выполнили Студенты 22 группы,5 подгруппа Махмудова. Л Скрыпникова. С Полоян. А Жукова. Е  Язык гипертекстовой разметки HTML
Язык гипертекстовой разметки HTML Обзор библиотеки STL. (Лекция 7)
Обзор библиотеки STL. (Лекция 7) Переменный электрический ток
Переменный электрический ток Программа социально-педагогического развития личности воспитанников спецшколы №8 «Перспектива»
Программа социально-педагогического развития личности воспитанников спецшколы №8 «Перспектива» Презентация «Стратегии выхода предприятия на внешний рынок»
Презентация «Стратегии выхода предприятия на внешний рынок» Обозначение шероховатости поверхностей на чертежах
Обозначение шероховатости поверхностей на чертежах Лекарственные растения.
Лекарственные растения.