Элементы химической кинетики. Основные факторы, влияющие на скорость реакции. Кинетические уравнения реакций 0, I, II порядков
Содержание
- 2. Кинетика − раздел химии, изучающий механизмы химических реакций и скорости их протекания. Скорость − основное понятие
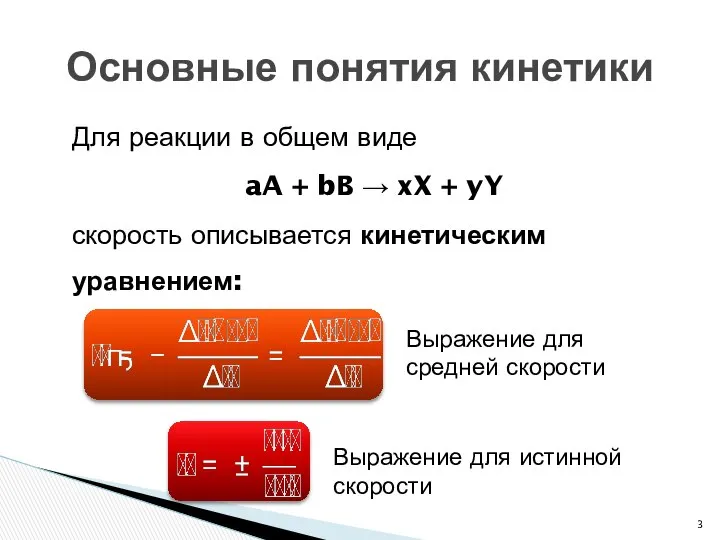
- 3. Для реакции в общем виде aA + bB → xX + yY скорость описывается кинетическим уравнением:
- 4. 1. Природа реагирующих веществ: определяется видом частиц (атомы, молекулы, ионы). 2. Концентрация реагирующих веществ: описывается законом
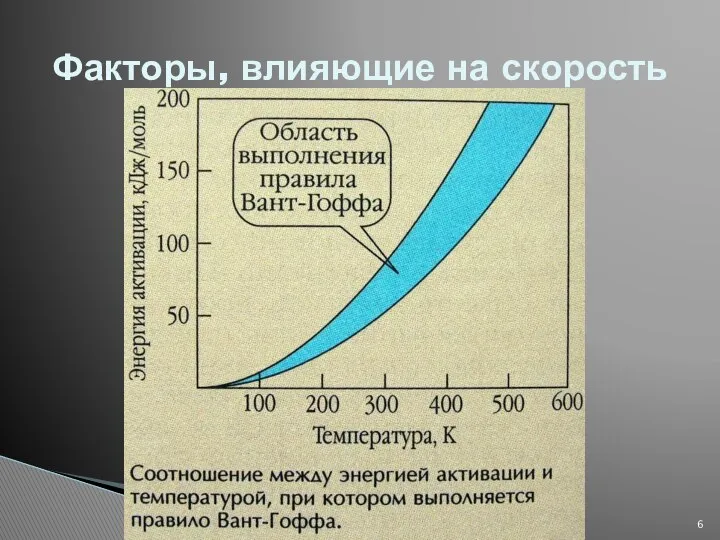
- 5. 3. Температура: описывается правилом Вант-Гоффа Для химических реакций γ = 2-4, для ферментативных γ = 7-9.
- 6. Факторы, влияющие на скорость
- 7. Для эффективного взаимодействия частицы должны: 1. столкнуться; 2. иметь благоприятную ориентацию; 3. обладать достаточной энергией. Основные
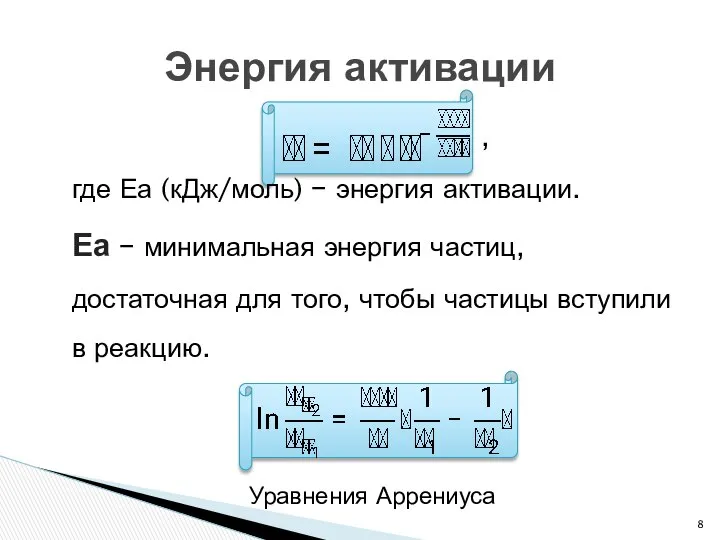
- 8. , где Еа (кДж/моль) − энергия активации. Еа − минимальная энергия частиц, достаточная для того, чтобы
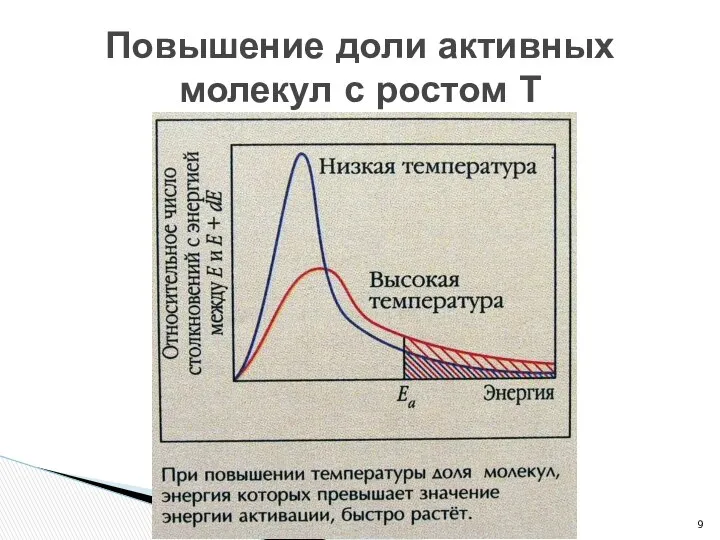
- 9. Повышение доли активных молекул с ростом Т
- 10. 1. По уравнению Аррениуса. 2. Графический Способы расчёта Еа ϕ C A B
- 11. Число молекул реагентов, участвующих в простой одностадийной реакции, состоящей из одного элементарного акта, называется МОЛЕКУЛЯРНОСТЬЮ реакции.
- 12. … ∑ всех показателей степеней концентраций реагирующих веществ в ЗДМ. ; П = a + b
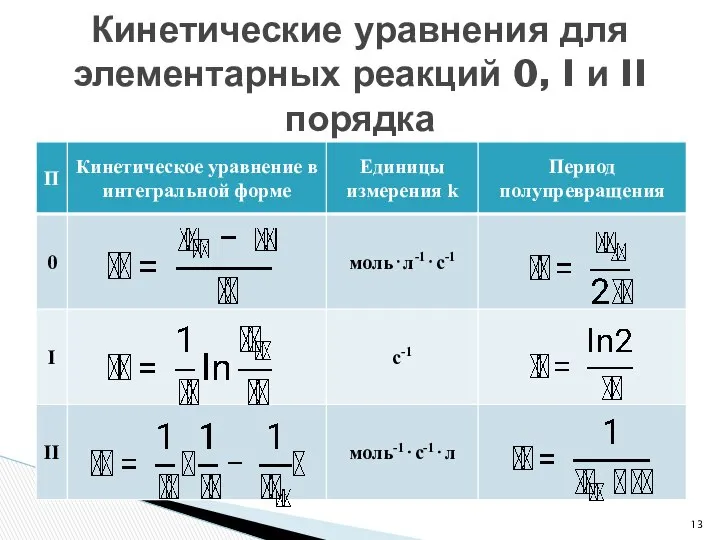
- 13. Кинетические уравнения для элементарных реакций 0, I и II порядка
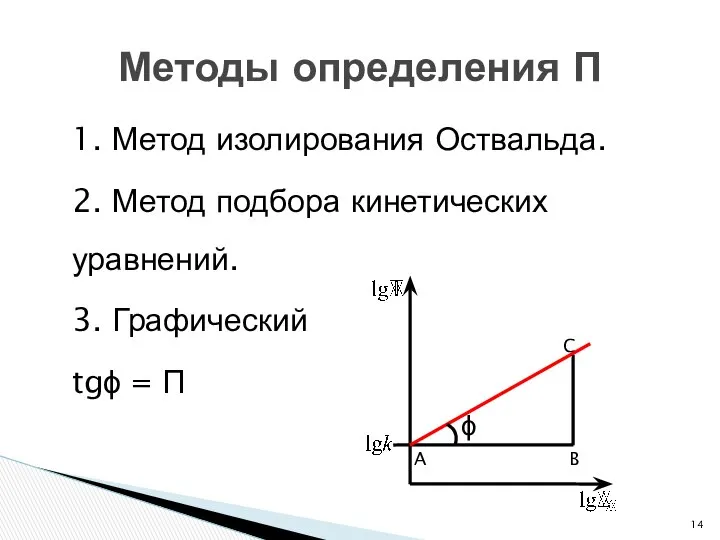
- 14. 1. Метод изолирования Оствальда. 2. Метод подбора кинетических уравнений. 3. Графический tgϕ = П Методы определения
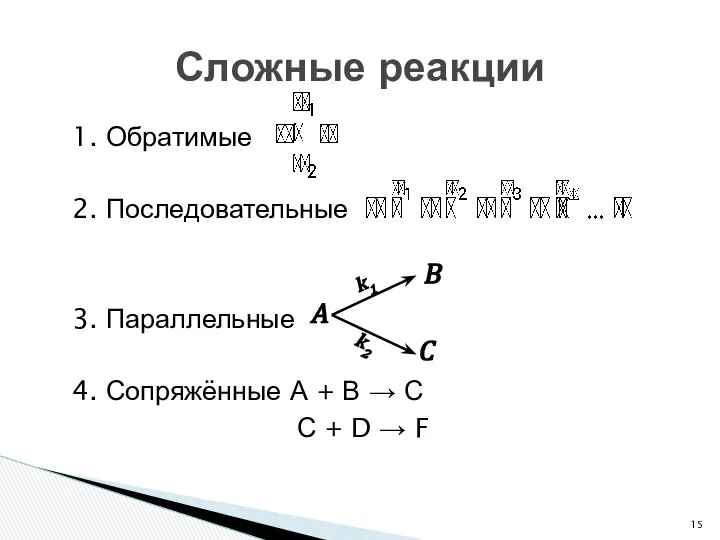
- 15. 1. Обратимые 2. Последовательные 3. Параллельные 4. Сопряжённые А + В → С С + D
- 16. 5. Цепные реакции − следующие друг за другом реакции, в которых участвуют свободные радикалы. Сложные реакции
- 17. Москва 2002
- 18. Пекин 2005 Нью-Йорк 2008 London 2006
- 19. Singapor 2006
- 21. Скачать презентацию











 Принципы построения параллельных вычислительных систем.
Принципы построения параллельных вычислительных систем.  ОБРАЗОВАНИЕ ДЕТЕЙ С ЗАДЕРЖКОЙ ПСИХИЧЕСКОГО РАЗВИТИЯ
ОБРАЗОВАНИЕ ДЕТЕЙ С ЗАДЕРЖКОЙ ПСИХИЧЕСКОГО РАЗВИТИЯ Локальные системы автоматики
Локальные системы автоматики  Действие крайних температур и других физических факторов
Действие крайних температур и других физических факторов Конст право 11.pptx
Конст право 11.pptx Михаи́л Васи́льевич Ломоно́сов
Михаи́л Васи́льевич Ломоно́сов Необходимость реформирования банковской системы Мирзошоев Ш Р Группа т 093
Необходимость реформирования банковской системы Мирзошоев Ш Р Группа т 093  Статья 195 УК РФ. Неправомерные действия при банкротстве Выполнили: Студенты 3-го курса группы Ю-101 Меженько Юлия Шевцова Екатерин
Статья 195 УК РФ. Неправомерные действия при банкротстве Выполнили: Студенты 3-го курса группы Ю-101 Меженько Юлия Шевцова Екатерин Бог є любов. Є. Шарипанова, Ф. Мендельсон-Бертхольд
Бог є любов. Є. Шарипанова, Ф. Мендельсон-Бертхольд Принципиальные схемы установок. Применение метода лазерной дифракции
Принципиальные схемы установок. Применение метода лазерной дифракции Стандартная операционная карта
Стандартная операционная карта Презентация "Истоки архитектуры и монументальных видов искусства (тест)" - скачать презентации по МХК
Презентация "Истоки архитектуры и монументальных видов искусства (тест)" - скачать презентации по МХК Сучасна концепція торгової політики країни
Сучасна концепція торгової політики країни Презентация "Прихватка для горячего" - скачать презентации по МХК
Презентация "Прихватка для горячего" - скачать презентации по МХК 4. Java OOP. 4. Inheritance and Polymorphism
4. Java OOP. 4. Inheritance and Polymorphism Общие сведения о системах автоматики, телемеханики, связи, вычислительной и космической технике
Общие сведения о системах автоматики, телемеханики, связи, вычислительной и космической технике муж пол орг
муж пол орг Ученик ИСККОН. Международное Общество Сознания Кришны
Ученик ИСККОН. Международное Общество Сознания Кришны Словарное слово «ПОНЕДЕЛЬНИК
Словарное слово «ПОНЕДЕЛЬНИК 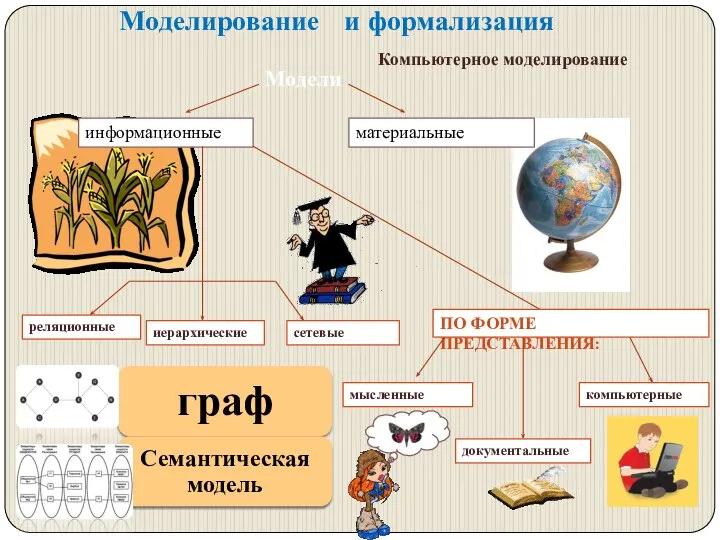 моделтрование - презентация по Алгебре
моделтрование - презентация по Алгебре Как нарисовать? Урок поэтапно. Для детей.
Как нарисовать? Урок поэтапно. Для детей.  Инновационный педагогический опыт МУО Роднодолинская СОШ
Инновационный педагогический опыт МУО Роднодолинская СОШ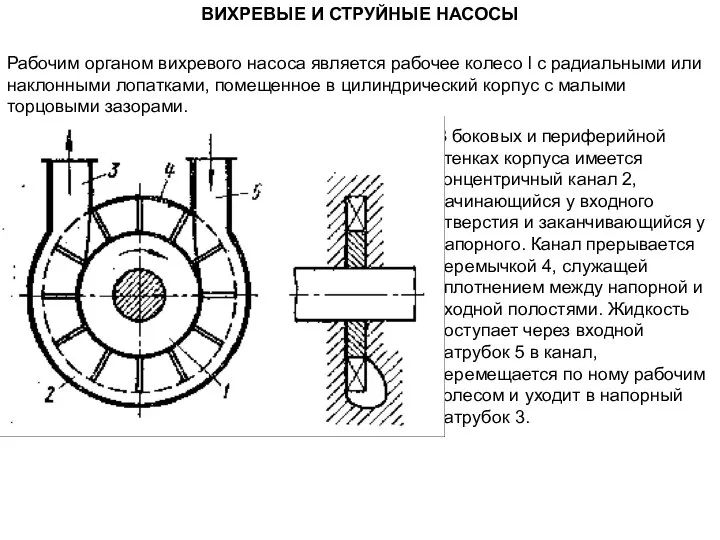 Вихревые насосы
Вихревые насосы Спектральное представление
Спектральное представление  Презентация "Задание к зачету" - скачать презентации по Экономике
Презентация "Задание к зачету" - скачать презентации по Экономике Экспериментальная и инновационная работа с курсом «Проектная дея
Экспериментальная и инновационная работа с курсом «Проектная дея Запам’ятовуючі пристрої СО (Заняття № 7.3)
Запам’ятовуючі пристрої СО (Заняття № 7.3) Заболевания ободочной кишки
Заболевания ободочной кишки