Содержание
- 2. Термодинамика - раздел химии, изучающий свойства макроскопическх систем, находящихся в состоянии термодинамического равновесия и процессы перехода
- 3. Достоинства термодинамики: Экономит средства и время. Не требует сведений о стадиях процесса. Недостатки термодинамики: Отсутствуют сведения
- 4. Система – тело или группа тел, отделенных от окружающей среды реальной или воображаемой поверхностью раздела Классификация
- 5. Классификация по характеру взаимодействия с окружающей средой ΔE ≠ 0, Δm ≠ 0 ΔE ≠ 0,
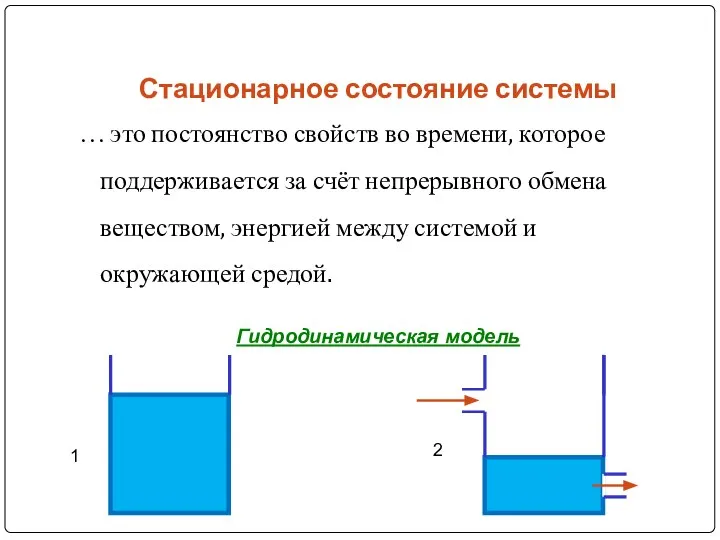
- 6. Стационарное состояние системы … это постоянство свойств во времени, которое поддерживается за счёт непрерывного обмена веществом,
- 7. Термодинамические функции состояния Н − энтальпия − тепловой эффект образования 1 моль вещества из простых веществ
- 8. Первый закон термодинамики – всеобщий закон природы, закон сохранения и превращения энергии Его формулировки: Энергия не
- 9. Первый закон термодинамики Q = ΔU + A, где А – работа A = pΔV, тогда
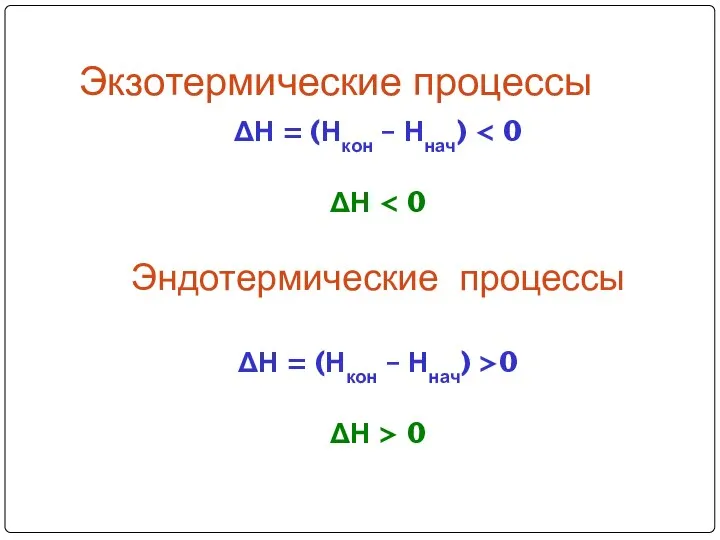
- 10. Экзотермические процессы ΔН = (Нкон – Ннач) ΔН Эндотермические процессы ΔН = (Нкон – Ннач) >0
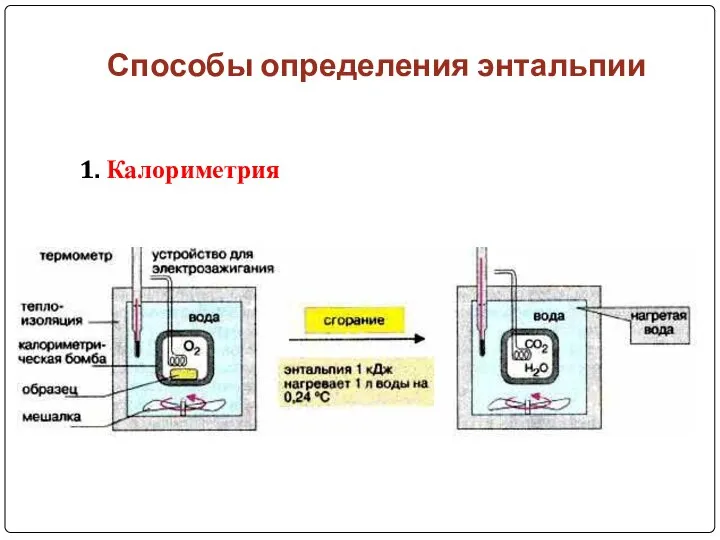
- 11. Способы определения энтальпии 1. Калориметрия
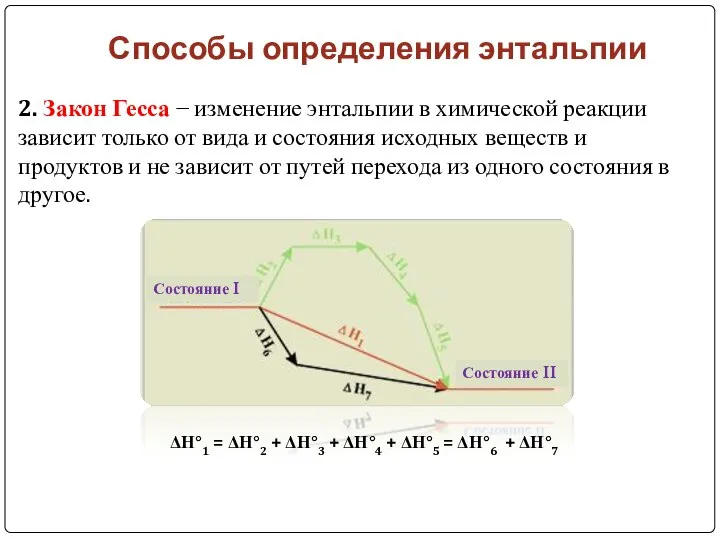
- 12. Способы определения энтальпии 2. Закон Гесса − изменение энтальпии в химической реакции зависит только от вида
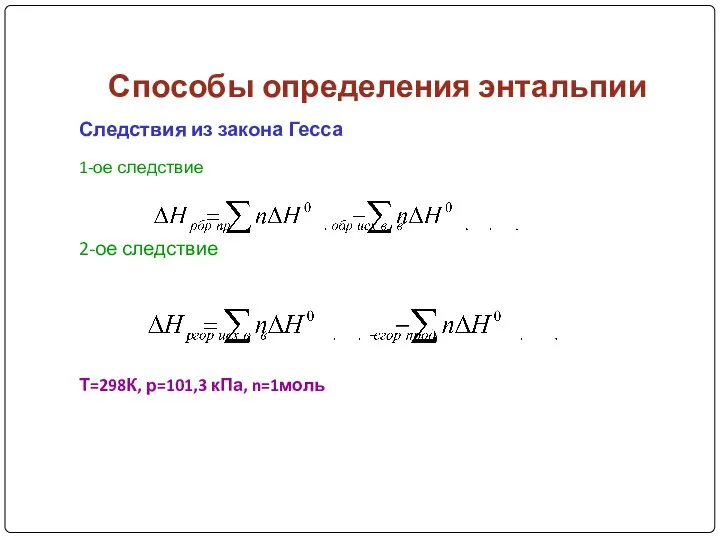
- 13. Способы определения энтальпии Следствия из закона Гесса 1-ое следствие 2-ое следствие Т=298К, р=101,3 кПа, n=1моль
- 14. Задача Многие микроорганизмы, включая дрожжи, получают необходимую энергию в результате сбраживания глюкозы в этанол: С6Н12О6 ?
- 15. Правило нахождения ΔН Энтальпия простых веществ и элементов в стандартных условиях принимается равным 0. Значения энтальпии
- 16. Калорийность питательных веществ… … называется энергия, выделяемая при полном окислении (сгорании) 1грамма питательных веществ. 1кал =
- 17. Задача Вычислите калорийность пищевого продукта массой 350г, содержащего 50% воды, 30% белка, 15% жиров, 5% углеводов.
- 19. Скачать презентацию











 Презентация Тест по таможенному праву
Презентация Тест по таможенному праву Имидж делового человека
Имидж делового человека ОП
ОП Методы повышения энергетической эффективности объектов строительства
Методы повышения энергетической эффективности объектов строительства Технологический процесс приспособления и управляющих программ для изготовления детали «Крышка» в производстве
Технологический процесс приспособления и управляющих программ для изготовления детали «Крышка» в производстве ЯЗВЕННАЯ БОЛЕЗНЬ
ЯЗВЕННАЯ БОЛЕЗНЬ  Ламповый гитарный усилитель “ Всадник ”
Ламповый гитарный усилитель “ Всадник ” Этапы подготовки федерального бюджета в Российской Федерации. Роль Совета Федерации
Этапы подготовки федерального бюджета в Российской Федерации. Роль Совета Федерации Праздничная кухня российских немцев во время празднования праздника урожая (erntedankfest)
Праздничная кухня российских немцев во время празднования праздника урожая (erntedankfest) ТЕМА 10 РИСК И НЕОПРЕДЕЛЕННОСТЬ У истоков каждого успешного предприятия стоит однажды принятое смелое решение Питер Друкер, амер
ТЕМА 10 РИСК И НЕОПРЕДЕЛЕННОСТЬ У истоков каждого успешного предприятия стоит однажды принятое смелое решение Питер Друкер, амер Разработка и принятие Уголовного кодекса 1922 г.
Разработка и принятие Уголовного кодекса 1922 г. Общая характеристика и роль в политике психологии масс. Массовое политическое сознание
Общая характеристика и роль в политике психологии масс. Массовое политическое сознание Отраслевые министерства в структуре управления в сфере физической культуры и спорта
Отраслевые министерства в структуре управления в сфере физической культуры и спорта Определение ОЦТ аналитическим способом
Определение ОЦТ аналитическим способом Особенности производства дознания
Особенности производства дознания Cервисная деятельность в годы великой отечественной войны
Cервисная деятельность в годы великой отечественной войны Чарльз Дарвин
Чарльз Дарвин Цыгане - нация мира. Классный час. (7 класс)
Цыгане - нация мира. Классный час. (7 класс) Липиды
Липиды Тема № 5. Социальная ответственность и этика бизнеса
Тема № 5. Социальная ответственность и этика бизнеса Владимир Иванович Вернадский (1863-1945)
Владимир Иванович Вернадский (1863-1945) Язык программирования Pascal
Язык программирования Pascal Computer. Gliederung definition
Computer. Gliederung definition Тема 12. Оптовая и розничная торговля. Маркетинговая логистика Дисциплина «Основы маркетинга»
Тема 12. Оптовая и розничная торговля. Маркетинговая логистика Дисциплина «Основы маркетинга»  Презентация "Загадки и тайны «светящихся картин» А.И. Куинджи" - скачать презентации по МХК
Презентация "Загадки и тайны «светящихся картин» А.И. Куинджи" - скачать презентации по МХК Преступления против свободы, чести и достоинства личности
Преступления против свободы, чести и достоинства личности Оптичні ілюзії
Оптичні ілюзії  Биография Г.Х.Андерсена. Веб-квест,,В гостях у сказок’’
Биография Г.Х.Андерсена. Веб-квест,,В гостях у сказок’’