Содержание
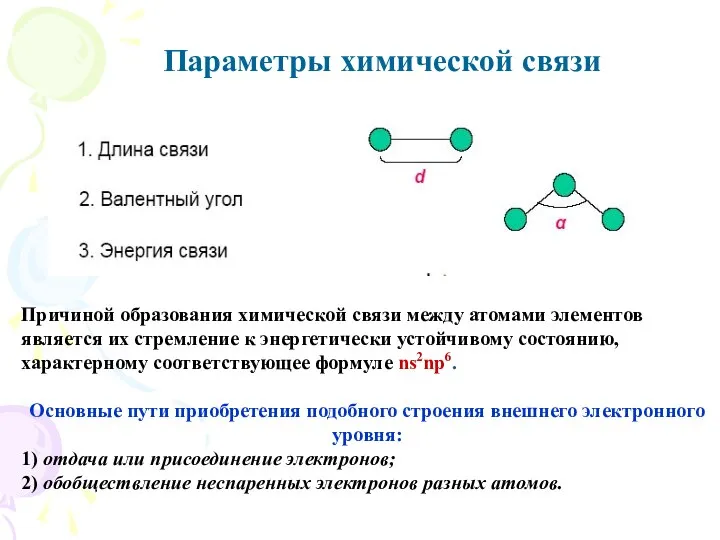
- 2. Параметры химической связи Причиной образования химической связи между атомами элементов является их стремление к энергетически устойчивому
- 4. Типы химической связи ионная ковалентная металлическая водородная
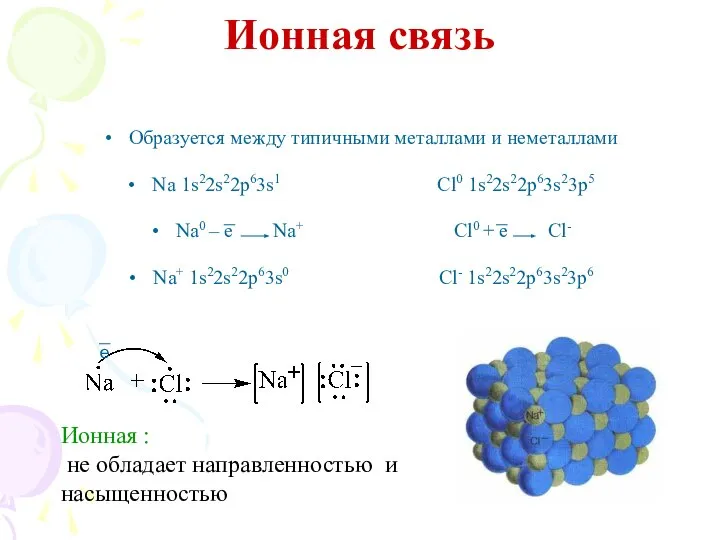
- 5. Ионная связь Образуется между типичными металлами и неметаллами Na 1s22s22p63s1 Cl0 1s22s22p63s23p5 Na0 – e Na+
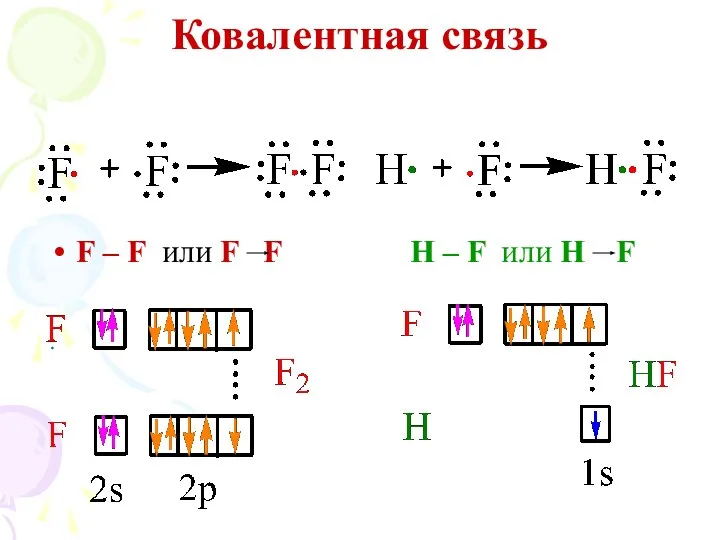
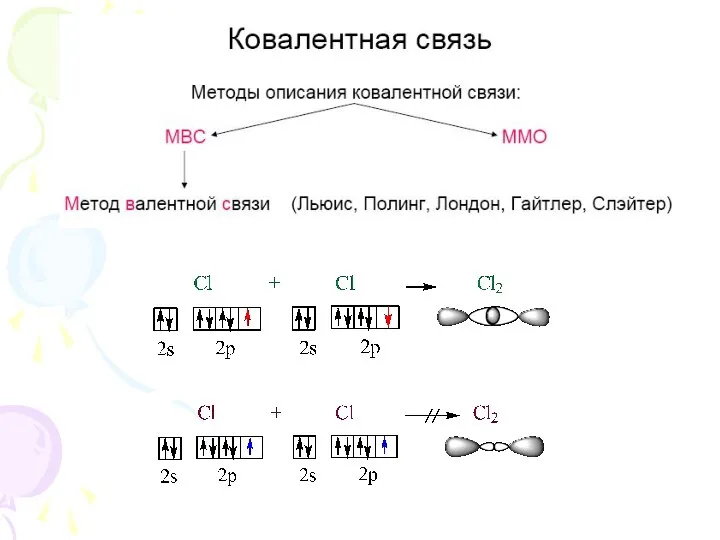
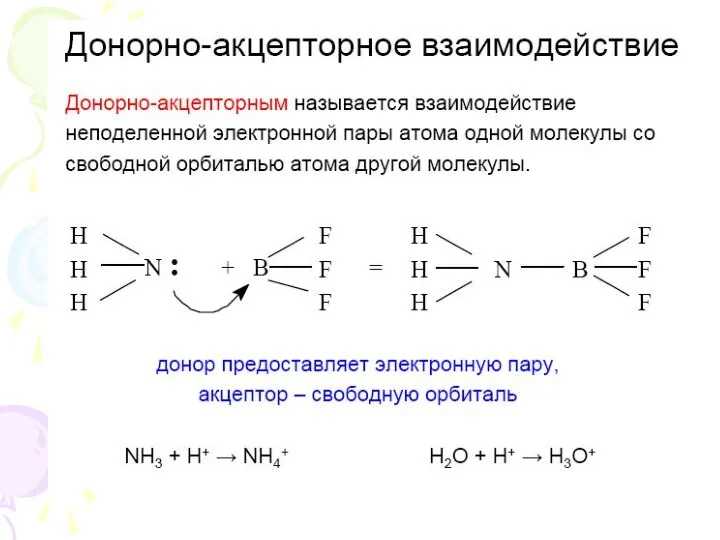
- 6. Ковалентная связь F – F или F F H – F или H F
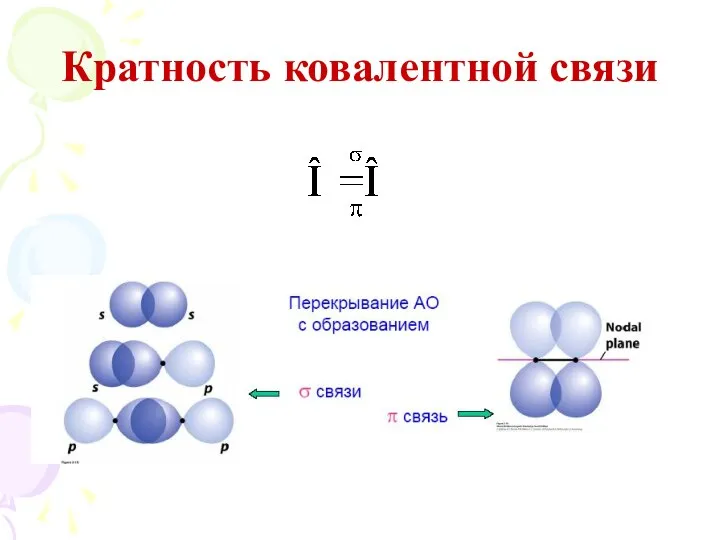
- 9. Кратность ковалентной связи
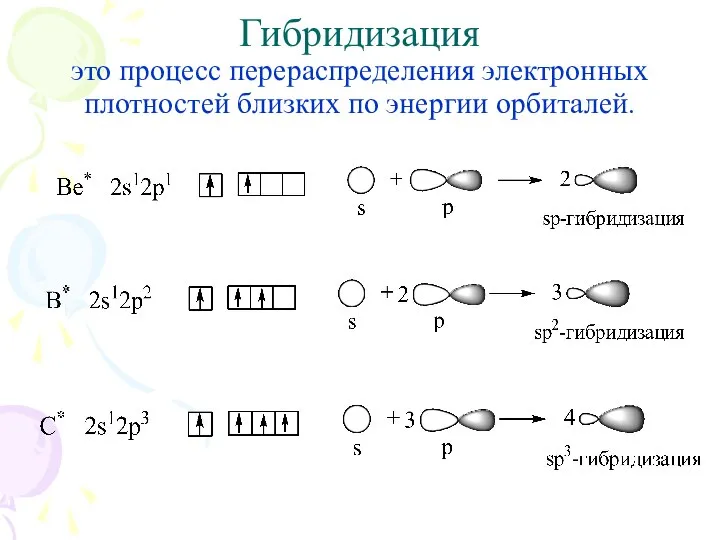
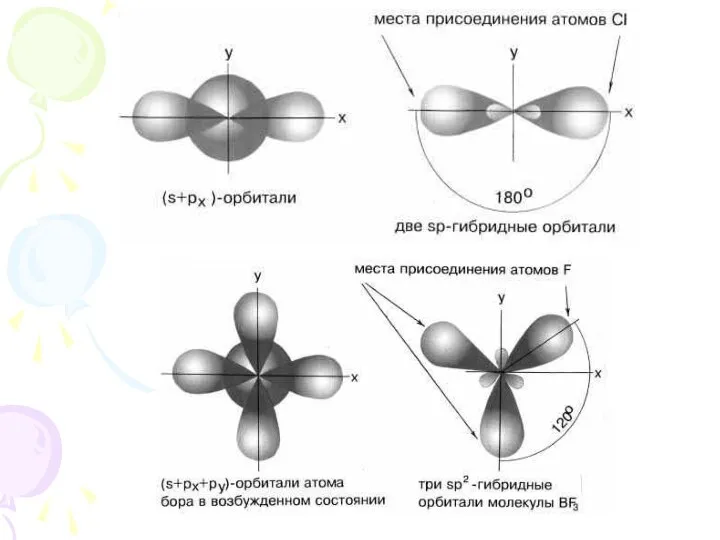
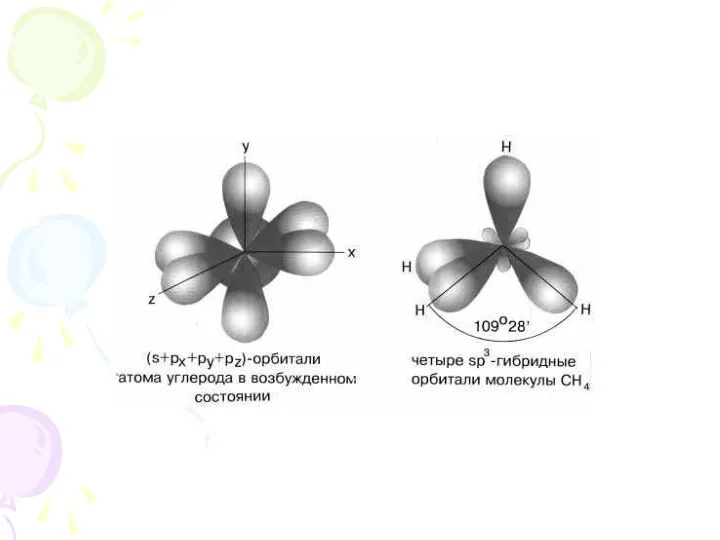
- 10. Гибридизация это процесс перераспределения электронных плотностей близких по энергии орбиталей.
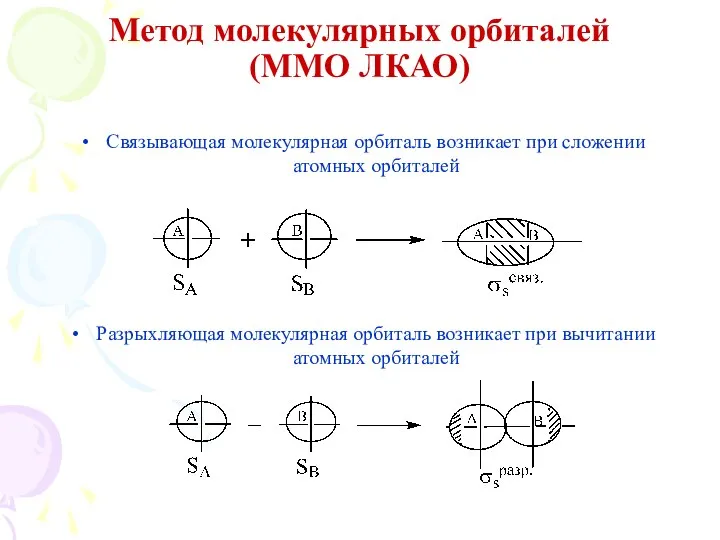
- 14. Метод молекулярных орбиталей (ММО ЛКАО) Связывающая молекулярная орбиталь возникает при сложении атомных орбиталей Разрыхляющая молекулярная орбиталь
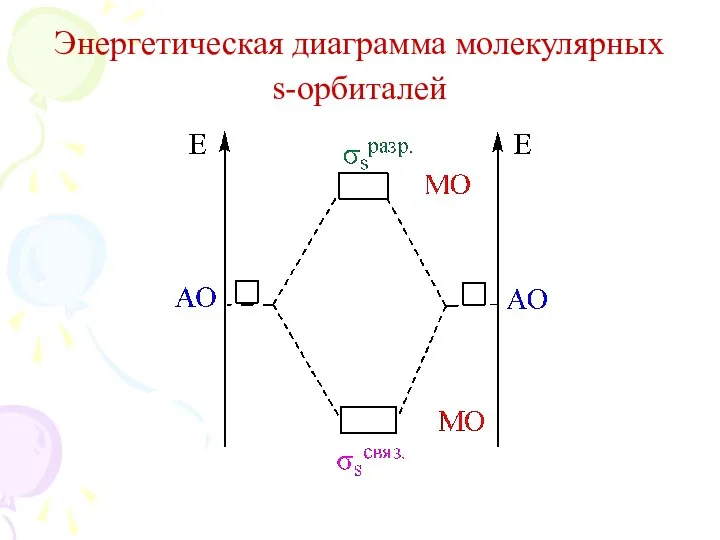
- 15. Энергетическая диаграмма молекулярных s-орбиталей
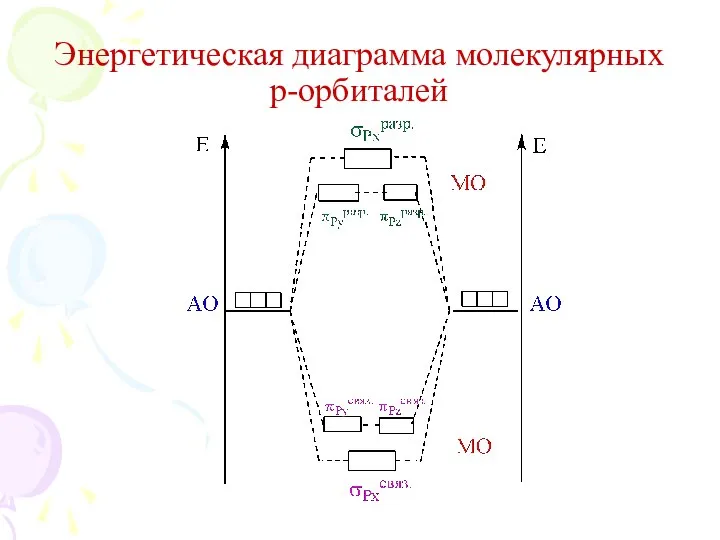
- 16. Энергетическая диаграмма молекулярных р-орбиталей
- 17. Заполнение МО электронами подчиняется всем законам заполнения АО 1. МО заполняются в порядке увеличения их энергии.
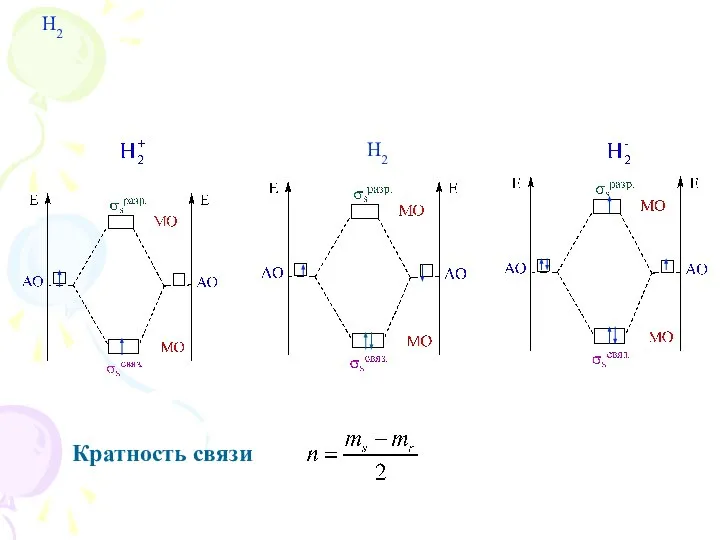
- 18. H2 H2 Кратность связи
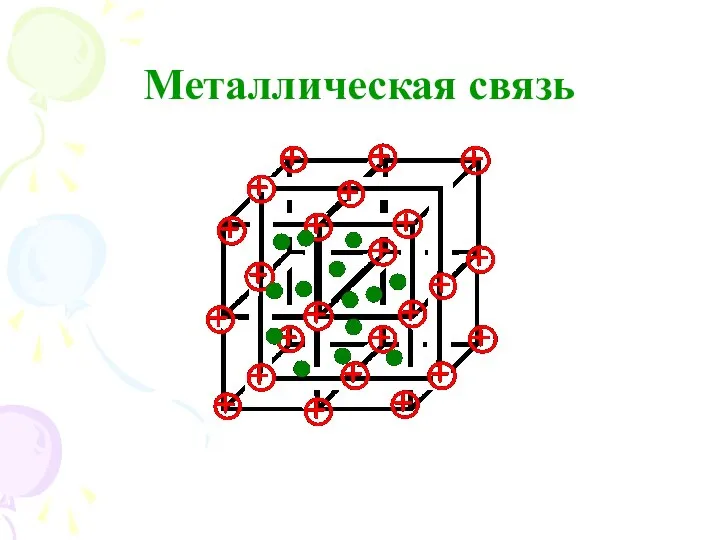
- 19. Металлическая связь
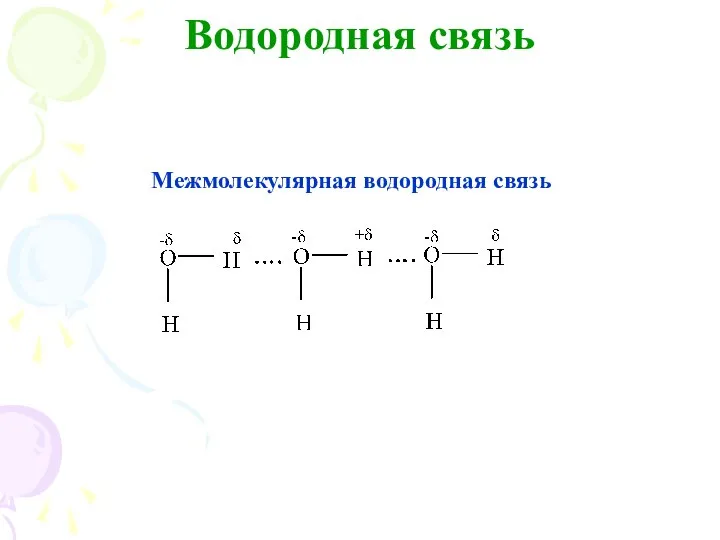
- 20. Водородная связь Межмолекулярная водородная связь
- 22. Скачать презентацию


 Голодомор 1932-1933 років
Голодомор 1932-1933 років  Способы проектирования земельных участков
Способы проектирования земельных участков Характеристика основных ионов, содержащихся в природных растворах Главные ионы
Характеристика основных ионов, содержащихся в природных растворах Главные ионы Азбука весны - презентация для начальной школы
Азбука весны - презентация для начальной школы Современные проблемы профилактики ХНИЗ
Современные проблемы профилактики ХНИЗ Цифровая схемотехника. Память компьютера. Полупроводниковая память
Цифровая схемотехника. Память компьютера. Полупроводниковая память Хищники. Культура и биология
Хищники. Культура и биология Виды квадратных уравнений - презентация по Алгебре
Виды квадратных уравнений - презентация по Алгебре Презентация на тему "Дымковская игрушка"
Презентация на тему "Дымковская игрушка" Строение швейного оверлока
Строение швейного оверлока Портфолио Laser Master Гостиницы и кафе Осень 2009
Портфолио Laser Master Гостиницы и кафе Осень 2009 Презентация на тему "Учебно-методические пособия по патриотическому воспитанию в ДОУ" - скачать презентации по Педагогике
Презентация на тему "Учебно-методические пособия по патриотическому воспитанию в ДОУ" - скачать презентации по Педагогике История развития вычислительной техники
История развития вычислительной техники Искусство в системе культуры
Искусство в системе культуры Художественные системы в проектировании одежды
Художественные системы в проектировании одежды уровень жизни населения
уровень жизни населения  Коттедж на 6-ти сотках, молодой сад, с видом на море и горы, в цокольном этаже два гаража, бойлерная, подсобное помещение
Коттедж на 6-ти сотках, молодой сад, с видом на море и горы, в цокольном этаже два гаража, бойлерная, подсобное помещение Ременная передача
Ременная передача  Восточных вымыслов игра... Наследие Древнего Востока в Петербурге
Восточных вымыслов игра... Наследие Древнего Востока в Петербурге  Порядок определения коэффициента КБМ (коэффициент бонус-малус) в 2019 году. Страхование
Порядок определения коэффициента КБМ (коэффициент бонус-малус) в 2019 году. Страхование Владимир Маяковский. Гений или простой поэт
Владимир Маяковский. Гений или простой поэт Презентация Трансформация Таможенной инфраструктуры под воздействием новых информационных технологий
Презентация Трансформация Таможенной инфраструктуры под воздействием новых информационных технологий Министерство образования Республики Беларусь Учреждение образования «Белорусский государственный университет информатики и
Министерство образования Республики Беларусь Учреждение образования «Белорусский государственный университет информатики и Методические рекомендации_
Методические рекомендации_ Christmas in America
Christmas in America Мастер - класс « Рисование контурами»
Мастер - класс « Рисование контурами»  Интеллектуальные информационные системы
Интеллектуальные информационные системы Силовая схема 45 позиции моторного режима независимого возбуждения ТЭД электровоза 2ЭС6
Силовая схема 45 позиции моторного режима независимого возбуждения ТЭД электровоза 2ЭС6