Содержание
- 2. Ферменты (энзимы) – каталитические белки Первый фермент, выделенный в чистом виде - уреаза бобов, разлагающая мочевину
- 3. Характеристика ферментов Высокая специфичность: 1 фермент – 1 реакция и чаще всего 1 субстрат Мягкие (физиологические)
- 4. Общие принципы строения ферментов Все ферменты – глобулярные белки Все ферменты имеют активный центр (АЦ), в
- 5. Виды ферментов по строению Изостерические ферменты – имеют только активный центр Аллостерические ферменты кроме АЦ, имеют
- 7. Условия максимальной активности ферментов рН – оптимум Температурный оптимум Физиологическая осмолярность среды Доступность субстрата Для некоторых
- 8. Кофакторы и коферменты Ионы металлов Могут связываться с АЦ фермента на время катализа (в присутствии субстрата)
- 9. Простетическая группа (ПГ) Это особая разновидность кофактора ферментов. ПГ ковалентно связывается с активным центром фермента. ПГ
- 10. Строение ферментов, использующих кофакторы (коферменты) Апофермент - белковая глобула, не связанная с кофактором или коферментом Холофермент
- 11. Регуляция активности ферментов 1. Контроль транскрипции гена (генов), кодирующих фермент с помощью факторов транскрипции или гормонов
- 12. Регуляция активности ферментов 2. Активация фермента путем ограниченного протеолиза: исходная глобула фермента неактивна, т.к. содержит дополнительную
- 13. Регуляция активности ферментов 3.Модуляция лигандами, характерными для данного фермента Концентрацией субстрата Доступностью кофермента или кофактора Накоплением
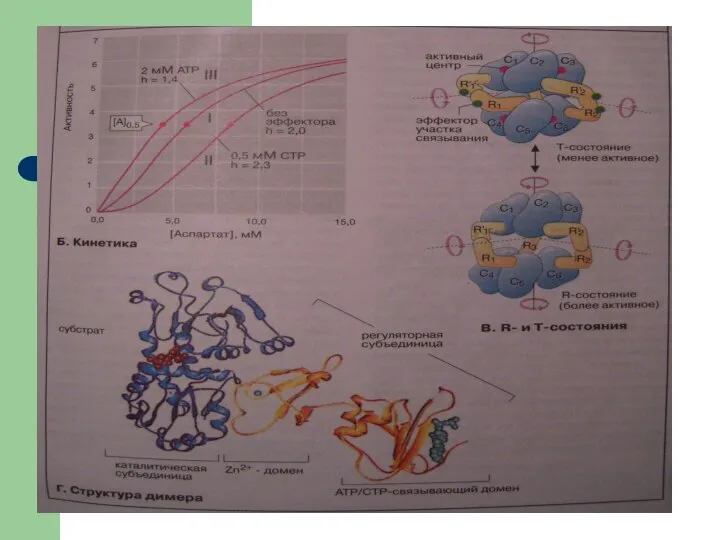
- 14. Регуляция активности ферментов 4. Аллостеризм как принцип регуляции активности ферментов Связывание в одном участке поверхности белка
- 15. Аллостерическая регуляция лежит в основе изменения активности некоторых ферментов в присутствии АДФ, цАМФ, цитрата и др.
- 16. Регуляция активности ферментов 5. Каскадные механизмы активации (инактивации) ключевого фермента Эти механизмы характерны для реализации быстрой
- 17. Принцип каскадной регуляции А. Гормон связывается с рецептором на клеточной мембране, активируя синтез вторичного посредника. Б.
- 18. Принцип каскадной регуляции Г. Вторичный посредник быстро уничтожается внутри клетки с помощью специального фермента, поэтому избыточного
- 19. СЛЕДУЕТ ЗНАТЬ К ЗАНЯТИЮ: 1. Строение аллостерических и изостерических ферментов 2. Свойства ферментов 3. Способы быстрой
- 22. Скачать презентацию

















 Усиление сжатой зоны строительных конструкций
Усиление сжатой зоны строительных конструкций Прибор управления COR
Прибор управления COR Координационные способности и методики развития координации
Координационные способности и методики развития координации Китайская игра «Го»
Китайская игра «Го» ОРГАНИЗАЦИЯ ДОКУМЕНТООБОРОТА
ОРГАНИЗАЦИЯ ДОКУМЕНТООБОРОТА Новые подходы к организации самостоятельной работы на уроках биологии
Новые подходы к организации самостоятельной работы на уроках биологии  Практикум по налогам
Практикум по налогам  Летучка
Летучка Ценовая политика компании
Ценовая политика компании Римское частное право
Римское частное право  ОГЭ. Немецкий язык
ОГЭ. Немецкий язык Трудовые времена на Русской земле
Трудовые времена на Русской земле Лидерство и руководство Техники эффективного влияния
Лидерство и руководство Техники эффективного влияния  Глобальные проблемы человечества
Глобальные проблемы человечества Проектирование отделения асбестообогатительной фабрики для ведения технологического процесса
Проектирование отделения асбестообогатительной фабрики для ведения технологического процесса Те, кому предсказано умереть, живут долго
Те, кому предсказано умереть, живут долго Автомобили III
Автомобили III Разработка дизайна арт объекта для IT-организации
Разработка дизайна арт объекта для IT-организации «Практика успешного управления персоналом в условиях дефицита кадрового ресурса» Мастер-класс
«Практика успешного управления персоналом в условиях дефицита кадрового ресурса» Мастер-класс ШКОЛА ЧЕЛОВЕЧЕСКИХ ОТНОШЕНИЙ Выполнили студентки 1 курса экономического факультета группы М 111 Б Русакова Ксения и Федорова
ШКОЛА ЧЕЛОВЕЧЕСКИХ ОТНОШЕНИЙ Выполнили студентки 1 курса экономического факультета группы М 111 Б Русакова Ксения и Федорова  1_Sily_BMM.ppt
1_Sily_BMM.ppt 01.05 Тело и его части
01.05 Тело и его части Плоскость
Плоскость Выполнение аксонометрических схем по канализации
Выполнение аксонометрических схем по канализации Презентация ОСНОВНЫЕ ПАРАДИГМЫ ПОЛИТОЛОГИИ
Презентация ОСНОВНЫЕ ПАРАДИГМЫ ПОЛИТОЛОГИИ Комитет по образованию Администрации МО «Ярцевский район» Смоленской области Районный методический кабинет
Комитет по образованию Администрации МО «Ярцевский район» Смоленской области Районный методический кабинет Детско-юношеская спортивная школа №1 города Невинномысска, Ставропольского края
Детско-юношеская спортивная школа №1 города Невинномысска, Ставропольского края Мотивация деятельности в менеджменте
Мотивация деятельности в менеджменте