Содержание
- 2. ПРЕДМЕТ МОЛЕКУЛЯРНОЙ БИОФИЗИКИ РАСКРЫТЬ ПРИРОДУ ВЗАИМОДЕЙСТВИЯ АТОМАРНЫХ ГРУПП, ОПРЕДЕЛЯЮЩИХ КОНФОРМАЦИИ БИОМАКРОМОЛЕКУЛ, ВЫЯВИТЬ МЕХАНИЗМЫ ЭЛЕКТРОННЫХ И КОНФОРМАЦИОННЫХ
- 3. СПЕЦИФИКА БИОМАКРОМОЛЕКУЛ СТАТИСТИЧЕСКИЙ ХАРАКТЕР ПОВЕДЕНИЯ, Т.К. БИОМАКРОМОЛЕКУЛЫ СОСТОЯТ ИЗ БОЛЬШОГО ЧИСЛА ОДНОТИПНЫХ ЗВЕНЬЕВ – МОНОМЕРОВ. НАЛИЧИЕ
- 4. МЕТОДЫ ИССЛЕДОВАНИЯ БИОМАКРОМОЛЕКУЛ (обзор)
- 5. В 1953 Дж. Уотсон и Ф.Крик предложили модель молекулы ДНК, которая хорошо согласовалась с результатами рентгенографических
- 6. РЕНТГЕНОГРАММА ДНК, ПОЛУЧЕННАЯ РОЗАЛИНДОЙ ФРАНКЛИН Розалинда Франклин (1920–1958)
- 7. Первые рентгенограммы белков получены еще в 30-х годах (У.Астбюри, Л.Полинг, Р.Кори). Л.Полинг 1901 - 1994
- 8. РЕНТГЕНОСТРУКТУРНЫЙ АНАЛИЗ ПРЯМОЙ МЕТОД ИССЛЕДОВАНИЯ ПОЗВОЛЯЕТ ОПРЕДЕЛИТЬ РАСПОЛОЖЕНИЕ ВСЕХ АТОМОВ В ТРЕХМЕРНОМ ПРОСТРАНСТВЕ ИМЕЕТ ОГРАНИЧЕНИЯ МЕТОДЫ
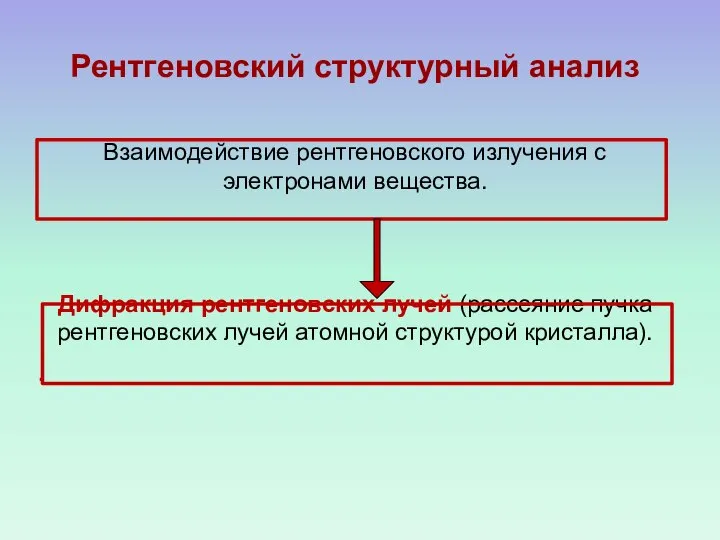
- 9. Рентгеновский структурный анализ Взаимодействие рентгеновского излучения с электронами вещества. Дифракция рентгеновских лучей (рассеяние пучка рентгеновских лучей
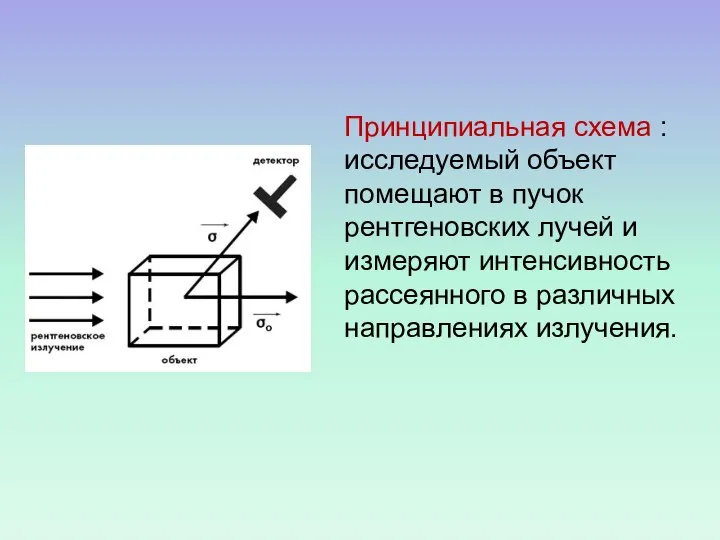
- 10. Принципиальная схема : исследуемый объект помещают в пучок рентгеновских лучей и измеряют интенсивность рассеянного в различных
- 11. Основные положения 1. Пучок рентгеновских лучей является плоской монохроматической электромагнитной волной. 2. Под воздействием этой электромагнитной
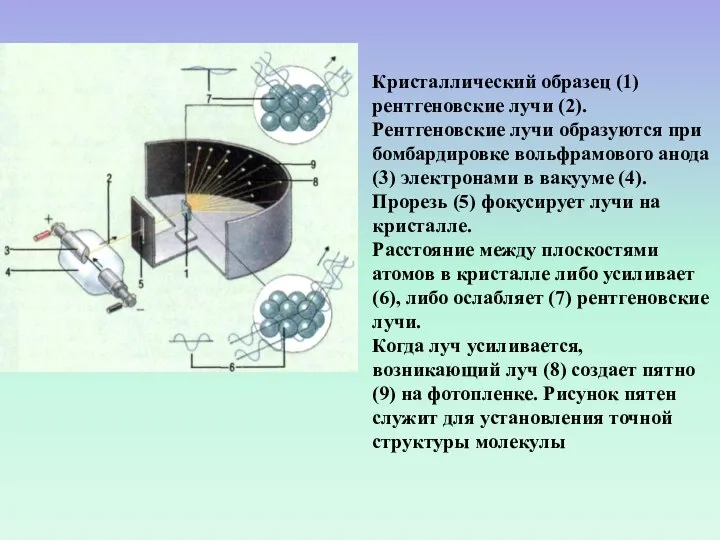
- 12. Кристаллический образец (1) рентгеновские лучи (2). Рентгеновские лучи образуются при бомбардировке вольфрамового анода (3) электронами в
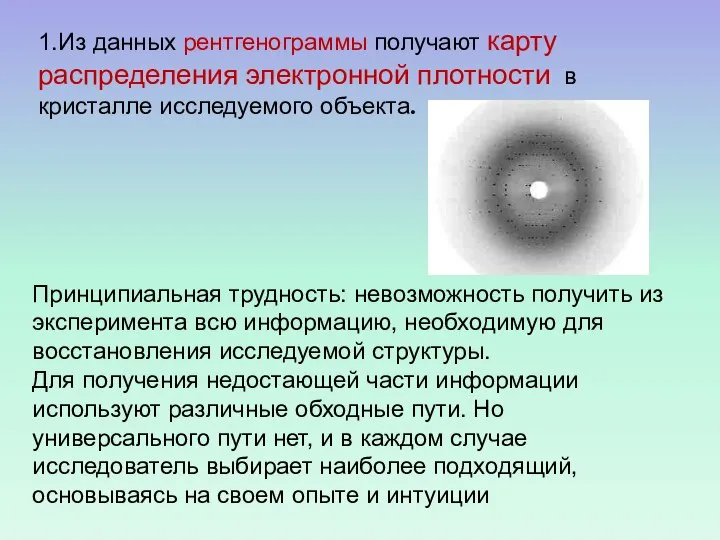
- 13. 1.Из данных рентгенограммы получают карту распределения электронной плотности в кристалле исследуемого объекта. Принципиальная трудность: невозможность получить
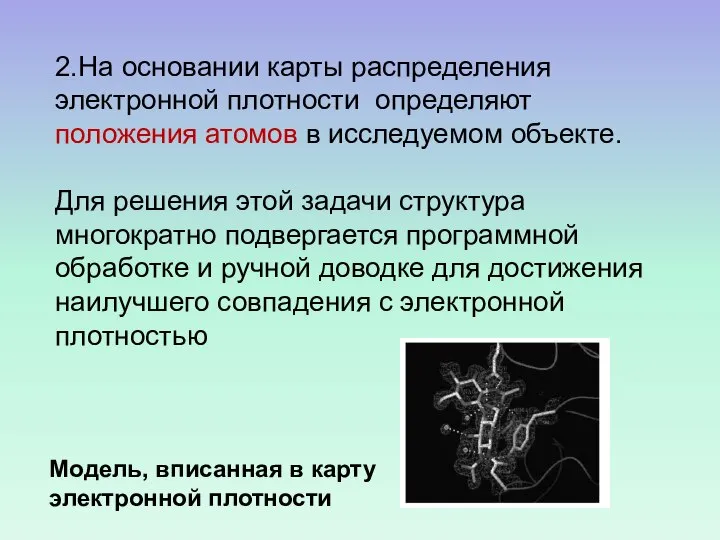
- 14. 2.На основании карты распределения электронной плотности определяют положения атомов в исследуемом объекте. Для решения этой задачи
- 15. Основные этапы определения структуры белка Выделение, очистка Кристаллизация Рентгеновский эксперимент, обработка результатов
- 16. РЕНТГЕНОГРАММА БАКТЕРИАЛЬНОГО БЕЛКА
- 17. Схематичная модель молекулы гемоглобина (М.Ф.Перутц, 1960 г.) Структура фермента дуоденазы с молекулой субстрата
- 18. Рентгеноструктурный анализ белковой молекулы позволяет установить Последовательность аминокислотных остатков в цепи Закономерности конфигурации белковой молекулы
- 19. ОГРАНИЧЕНИЕ МЕТОДА: С ПОМОЩЬЮ РЕНГГЕНОВСКИХ ЛУЧЕЙ МОЖНО ИССЛЕДОВАТЬ ТОЛЬКО ТЕ БЕЛКИ, КОТОРЫЕ КРИСТАЛЛИЗУЮТСЯ. ЭТО СУЖАЕТ ОБЛАСТЬ
- 20. МЕТОДЫ ИССЛЕДОВАНИЯ БИОМАКРОМОЛЕКУЛ ДЛЯ ОПРЕДЕЛЕНИЯ МАССЫ, РАЗМЕРОВ, ГИБКОСТИ БИОМАКРОМОЛЕКУЛ ИСПОЛЬЗУЮТСЯ ЭЛЕКТРОФОРЕЗ ВИСКОЗИМЕТРИЯ СЕДИМЕНТАЦИОННЫЙ АНАЛИЗ КВАЗИУПРУГОЕ РАССЕЯНИЕ
- 21. МЕТОДЫ ИССЛЕДОВАНИЯ БИОМАКРОМОЛЕКУЛ ДЛЯ ИЗУЧЕНИЯ ВТОРИЧНОЙ СТРУКТУРЫ ИСПОЛЬЗУЮТСЯ СПЕКТРОФОТОМЕТРИЯ ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ КРУГОВОЙ ДИХРОИЗМ ДИСПЕРСИЯ ОПТИЧЕСКОГО ВРАЩЕНИЯ
- 22. ДЛЯ ИССЛЕДОВАНИЯ ДИНАМИКИ БИОМАКРОМОЛЕКУЛ ИСПОЛЬЗУЮТСЯ ФЛУОРЕСЦЕНТНАЯ СПЕКТРОСКОПИЯ ЯМР ЭПР МЕТОДЫ ИССЛЕДОВАНИЯ БИОМАКРОМОЛЕКУЛ
- 23. КОНФОРМАЦИИ БИОМАКРОМОЛЕКУЛ
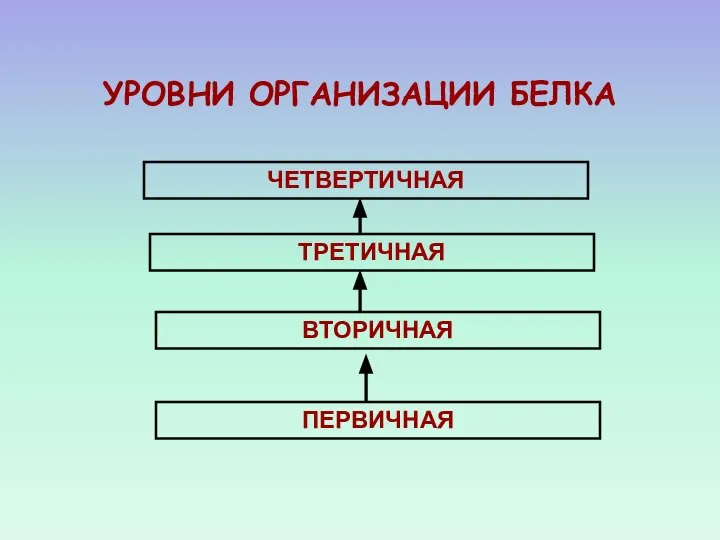
- 24. УРОВНИ ОРГАНИЗАЦИИ БЕЛКА ЧЕТВЕРТИЧНАЯ ТРЕТИЧНАЯ ВТОРИЧНАЯ ПЕРВИЧНАЯ
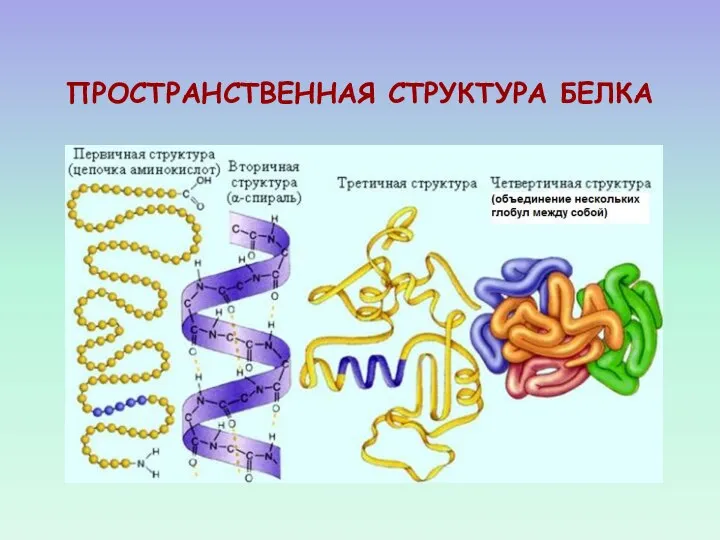
- 25. ПРОСТРАНСТВЕННАЯ СТРУКТУРА БЕЛКА
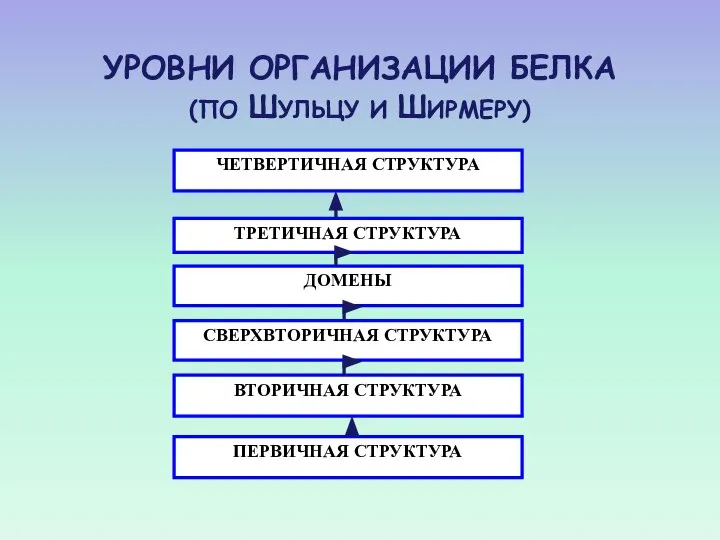
- 26. УРОВНИ ОРГАНИЗАЦИИ БЕЛКА (ПО ШУЛЬЦУ И ШИРМЕРУ)
- 27. СИЛЫ, СТАБИЛИЗИРУЮШИЕ СТРУКТУРУ БИОМАКРОМОЛЕКУЛ
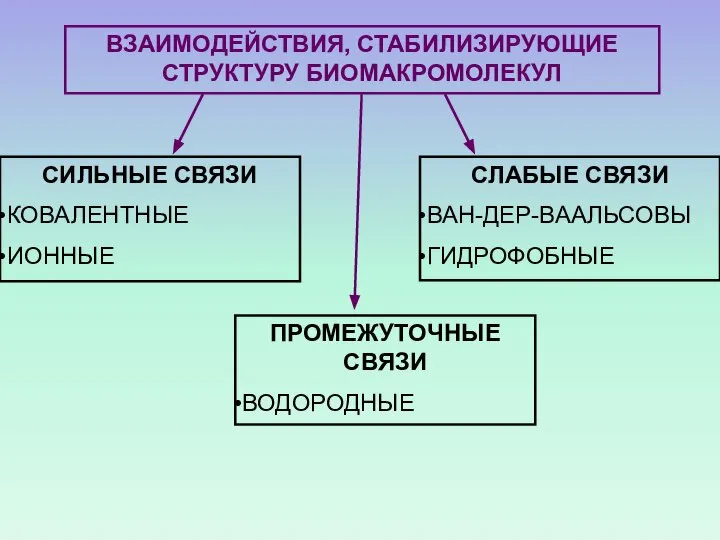
- 28. ВЗАИМОДЕЙСТВИЯ, СТАБИЛИЗИРУЮЩИЕ СТРУКТУРУ БИОМАКРОМОЛЕКУЛ СИЛЬНЫЕ СВЯЗИ КОВАЛЕНТНЫЕ ИОННЫЕ СЛАБЫЕ СВЯЗИ ВАН-ДЕР-ВААЛЬСОВЫ ГИДРОФОБНЫЕ ПРОМЕЖУТОЧНЫЕ СВЯЗИ ВОДОРОДНЫЕ
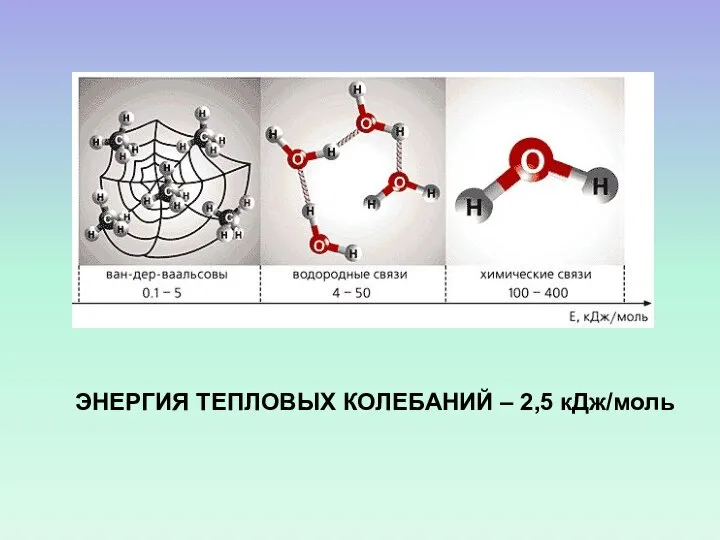
- 29. ЭНЕРГИЯ ТЕПЛОВЫХ КОЛЕБАНИЙ – 2,5 кДж/моль
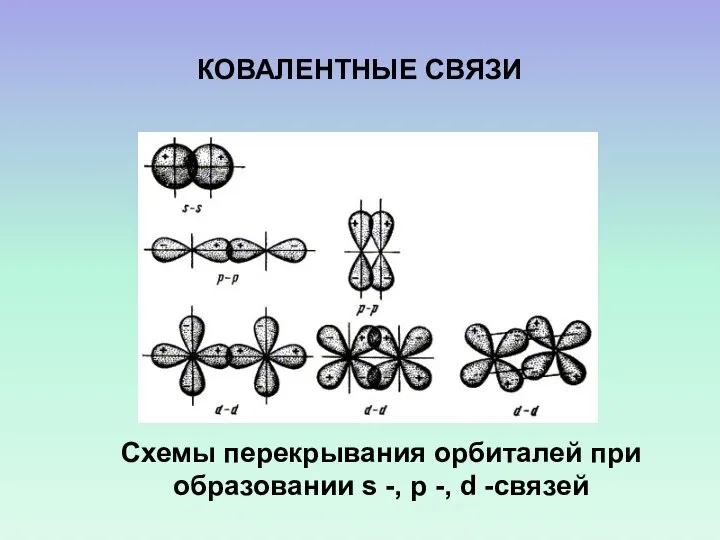
- 30. Схемы перекрывания орбиталей при образовании s -, p -, d -связей КОВАЛЕНТНЫЕ СВЯЗИ
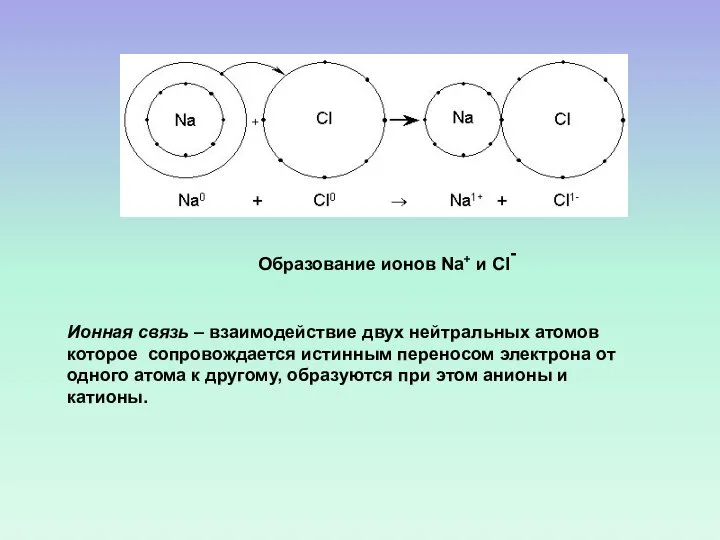
- 31. Ионная связь – взаимодействие двух нейтральных атомов которое сопровождается истинным переносом электрона от одного атома к
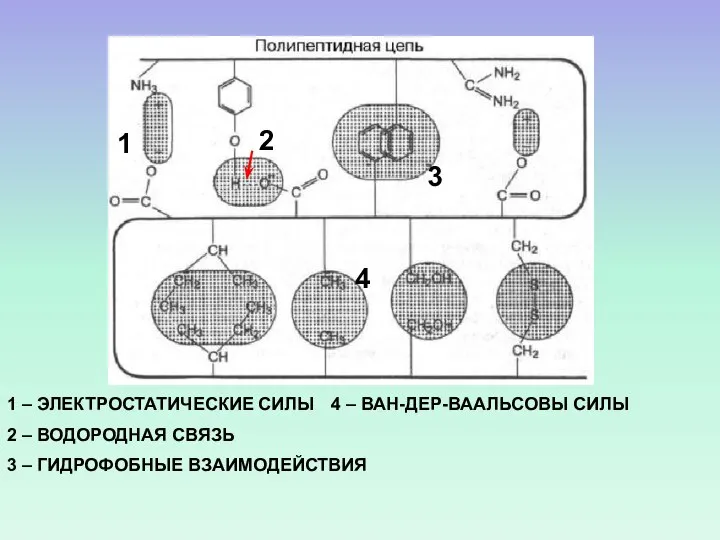
- 32. 1 2 3 1 – ЭЛЕКТРОСТАТИЧЕСКИЕ СИЛЫ 4 – ВАН-ДЕР-ВААЛЬСОВЫ СИЛЫ 2 – ВОДОРОДНАЯ СВЯЗЬ 3
- 33. ЭНЕРГИЯ ЭЛЕКТРОСТАТИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ ЗАВИСИТ ОТ ВЕЛИЧИНЫ ЗАРЯДОВ ЧАСТИЦ И РАССТОЯНИЯ МЕЖДУ НИМИ q1 и q2 –
- 34. ВАН-ДЕР-ВААЛЬСОВЫ ВЗАИМОДЕЙСТВИЯ Ян-Дидерик ВАН-ДЕР-ВААЛЬС (1837 - 1923)
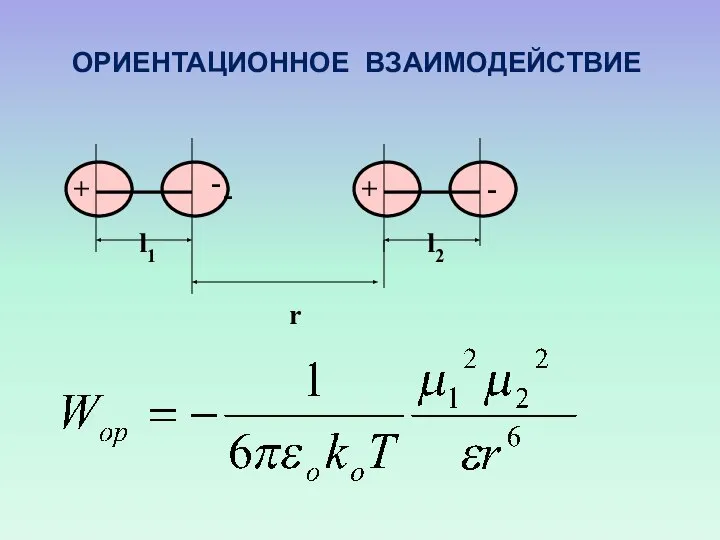
- 35. l1 l2 r - + - - + ОРИЕНТАЦИОННОЕ ВЗАИМОДЕЙСТВИЕ
- 36. Схема взаимодействия между полярными молекулами
- 37. ИНДУКЦИОННОЕ ВЗАИМОДЕЙСТВИЕ - поляризуемость, μ - дипольный момент
- 38. ДИСПЕРСИОННОЕ ВЗАИМОДЕЙСТВИЕ I1 I2 - потенциалы ионизации α1 и α2 – поляризуемость групп
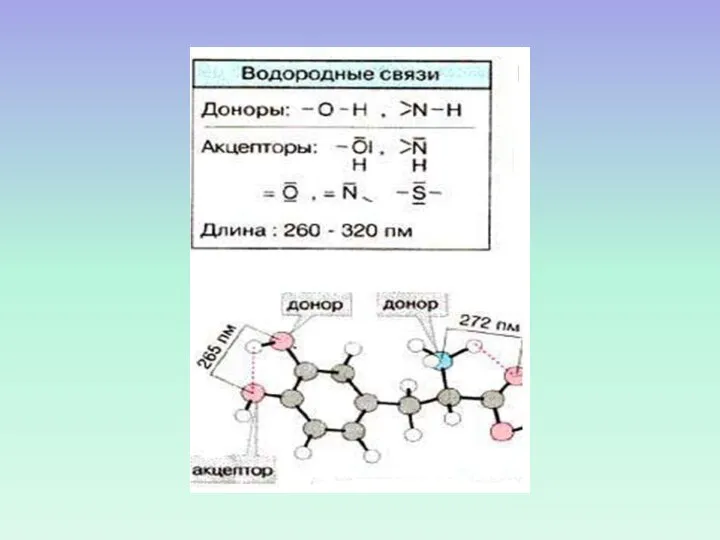
- 39. ВОДОРОДНАЯ СВЯЗЬ
- 40. ВОДОРОДНЫЕ СВЯЗИ ВОДОРОД ХИМИЧЕСКИ СВЯЗАН С ОДНИМ ЭЛЕКТРООТРИЦАТЕЛЬНЫМ АТОМОМ И ПРИ ЭТОМ ПРИБЛИЖАЕТСЯ К ДРУГОМУ ЭЛЕКТРООТРИЦАТЕЛЬНОМУ
- 41. АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ: ВЫСОКАЯ ТЕМПЕРАТУРА КИПЕНИЯ (373К) И ТЕМПЕРАТУРА ЗАМЕРЗАНИЯ (273К) ДЛЯ ЕЕ МАЛОГО МОЛЕКУЛЯРНОГО ВЕСА.
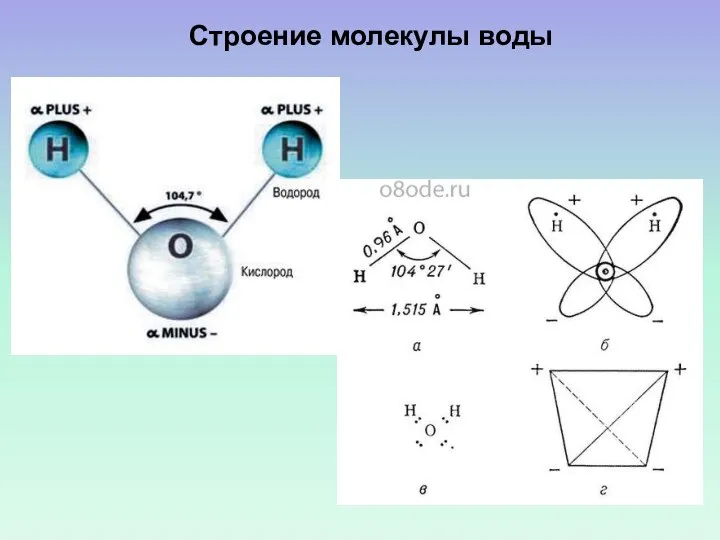
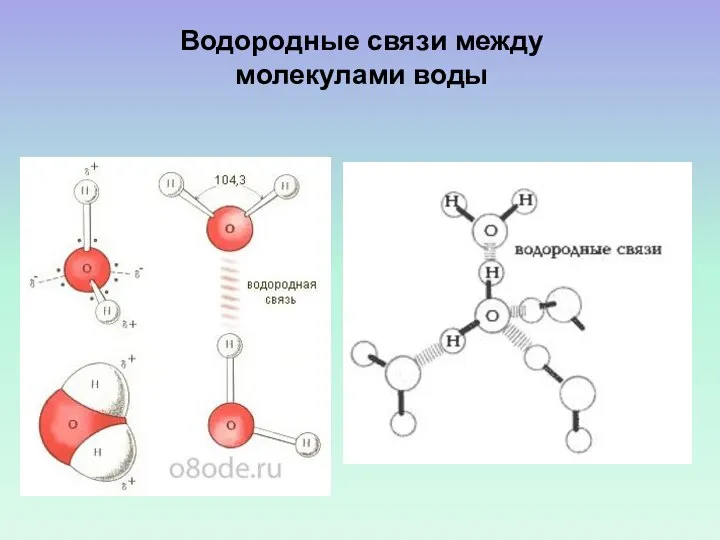
- 42. Строение молекулы воды
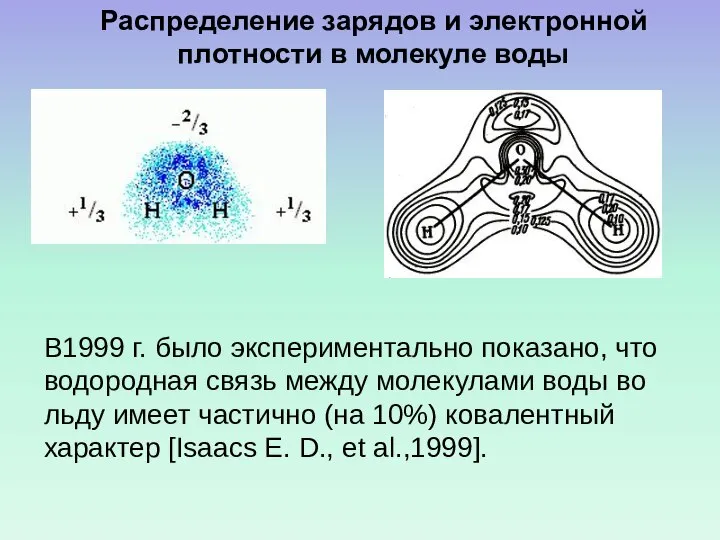
- 43. Распределение зарядов и электронной плотности в молекуле воды В1999 г. было экспериментально показано, что водородная связь
- 45. Водородные связи между молекулами воды
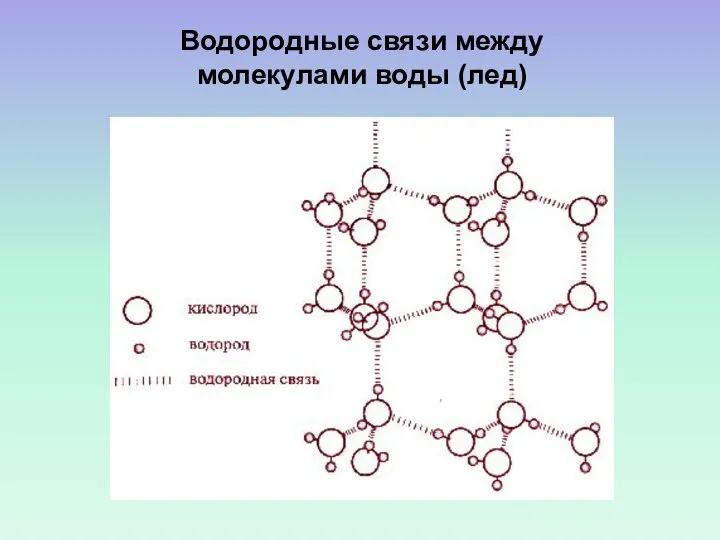
- 46. Водородные связи между молекулами воды (лед)
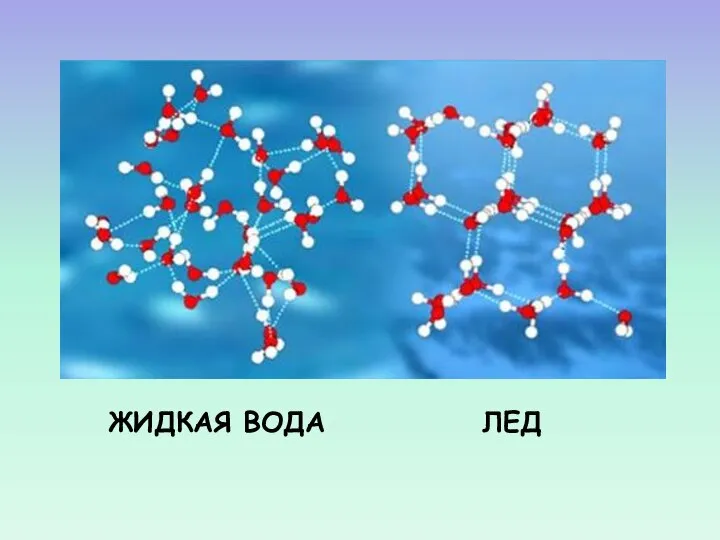
- 47. ЖИДКАЯ ВОДА ЛЕД
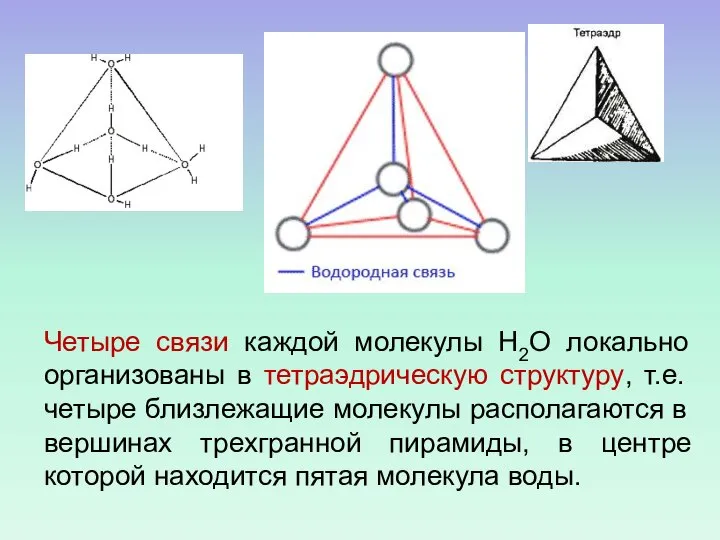
- 48. Четыре связи каждой молекулы Н2О локально организованы в тетраэдрическую структуру, т.е. четыре близлежащие молекулы располагаются в
- 49. ТЕОРИИ СТРУКТУРЫ ВОДЫ Впервые идея о том, что вода имеет сложную структуру появилась в конце XIX
- 50. Модель непрерывной структуры воды (континуальная модель).
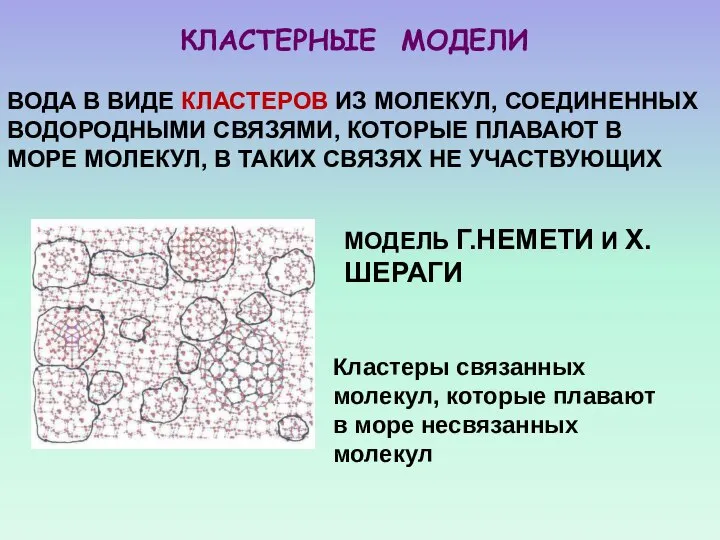
- 51. КЛАСТЕРНЫЕ МОДЕЛИ ВОДА В ВИДЕ КЛАСТЕРОВ ИЗ МОЛЕКУЛ, СОЕДИНЕННЫХ ВОДОРОДНЫМИ СВЯЗЯМИ, КОТОРЫЕ ПЛАВАЮТ В МОРЕ МОЛЕКУЛ,
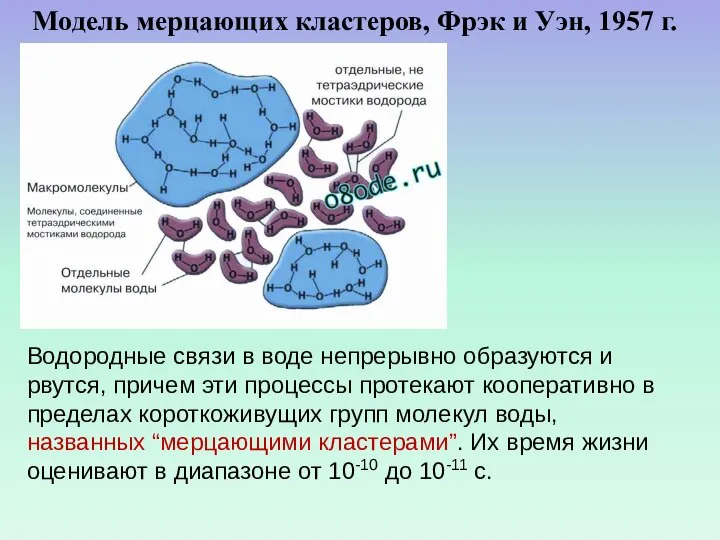
- 52. Модель мерцающих кластеров, Фрэк и Уэн, 1957 г. Водородные связи в воде непрерывно образуются и рвутся,
- 53. КЛАТРАТНАЯ МОДЕЛЬ ВОДЫ ВОДА ОБРАЗУЕТ НЕПРЕРЫВНУЮ СЕТКУ (КАРКАС) БЛАГОДАРЯ ВОДОРОДНЫМ СВЯЗЯМ, НО СОДЕРЖИТ ПУСТОТЫ. В НИХ
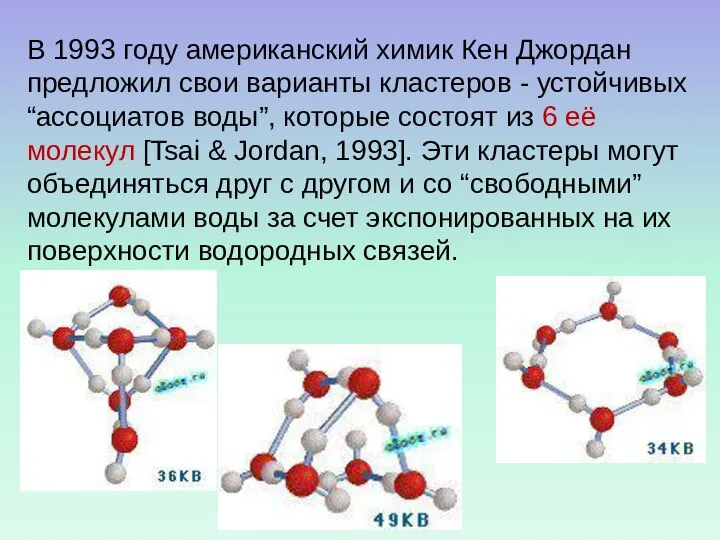
- 54. В 1993 году американский химик Кен Джордан предложил свои варианты кластеров - устойчивых “ассоциатов воды”, которые
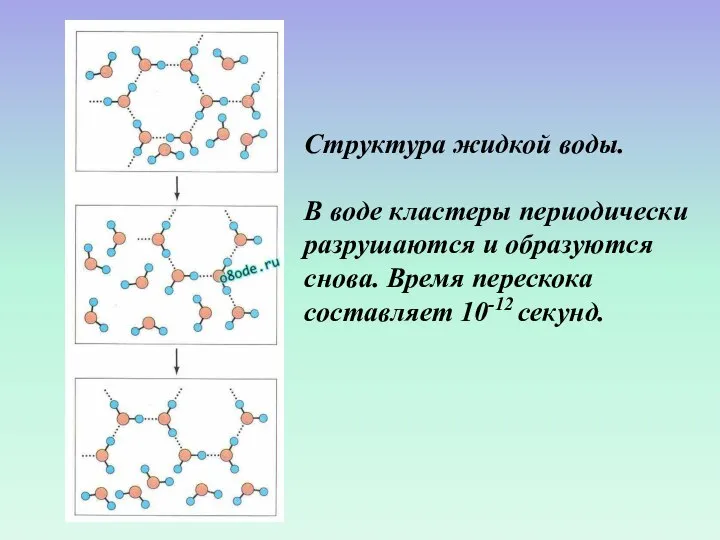
- 55. Структура жидкой воды. В воде кластеры периодически разрушаются и образуются снова. Время перескока составляет 10-12 секунд.
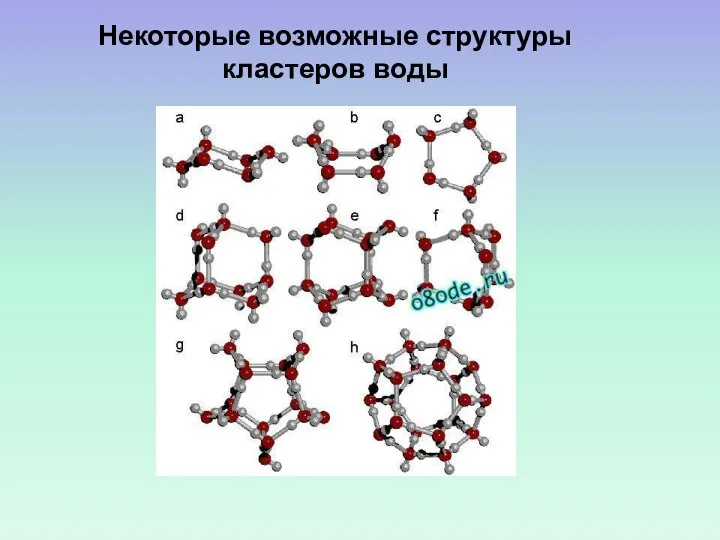
- 56. Некоторые возможные структуры кластеров воды
- 57. Формирование отдельного кластера воды (компьютерное моделирование)
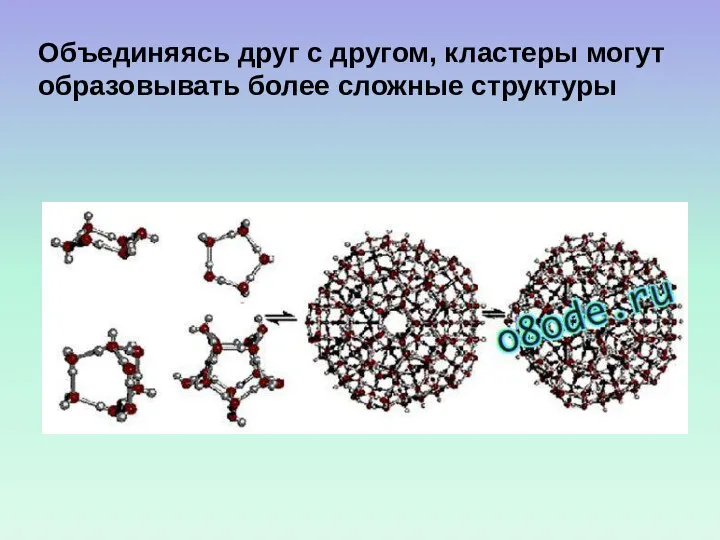
- 58. Объединяясь друг с другом, кластеры могут образовывать более сложные структуры
- 59. ГИДРОФОБНЫЕ ВЗАИМОДЕЙСТВИЯ
- 60. ЭНТРОПИЙНАЯ ПРИРОДА ГИДРОФОБНЫХ ВЗАИМОДЕЙСТВИЙ СНИЖЕНИЕ ЭНТРОПИИ ВЫЗЫВАЕТ УВЕЛИЧЕНИЕ СВОБОДНОЙ ЭНЕРГИИ, НО ЭТО КОМПЕНСИРУЕТСЯ СНИЖЕНИЕМ ЭНТАЛЬПИИ
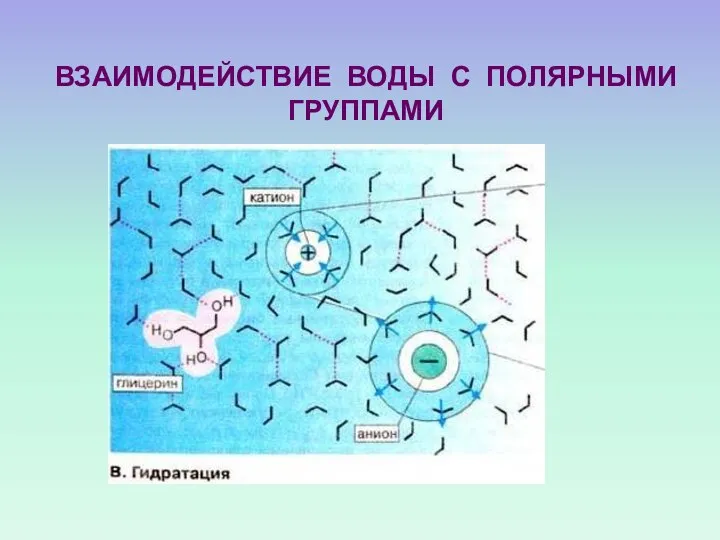
- 61. ВЗАИМОДЕЙСТВИЕ ВОДЫ С ПОЛЯРНЫМИ ГРУППАМИ
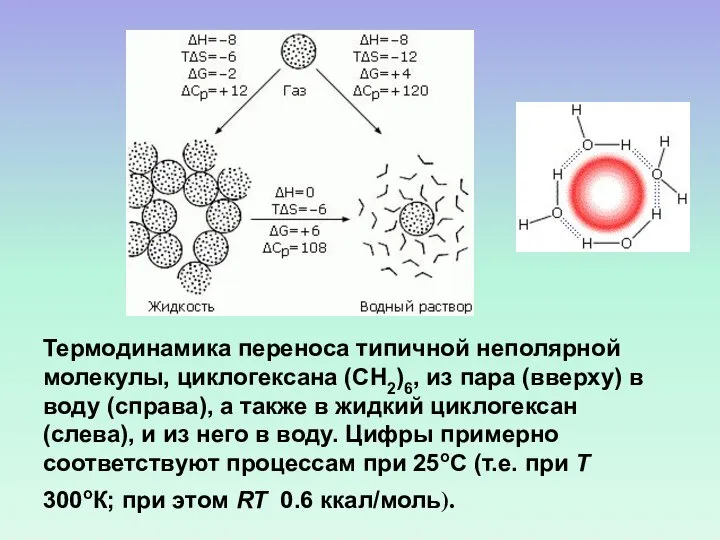
- 62. Термодинамика переноса типичной неполярной молекулы, циклогексана (СН2)6, из пара (вверху) в воду (справа), а также в
- 63. ИЗМЕНЕНИЕ СВОБОДНОЙ ЭНЕРГИИ ПРИ РАСТВОРЕНИИ НЕПОЛЯРНЫХ ВЕЩЕСТВ РЕЗУЛЬТАТ: ОТТАЛКИВАНИЕ ВОДОЙ НЕПОЛЯРНЫХ ВЕЩЕСТВ, КОТОРЫМ ТЕРМОДИНАМИЧЕСКИ ВЫГОДНЕЕ ВЗАИМОДЕЙСТВОВАТЬ
- 65. Скачать презентацию

































 роль государственных финансов в социально-экономическом развитии общества Выполнила: Галибина Любовь Студентка 2 курса ФТД гр
роль государственных финансов в социально-экономическом развитии общества Выполнила: Галибина Любовь Студентка 2 курса ФТД гр ПРОИЗВОДСТВО ИНУЛИНА
ПРОИЗВОДСТВО ИНУЛИНА Масленица
Масленица Прилади спін-хвильової електроніки
Прилади спін-хвильової електроніки Jasnogórska Pani
Jasnogórska Pani Современная предпринимательсткая среда
Современная предпринимательсткая среда Перкуссия сердца
Перкуссия сердца Оценка потенциальных возможностей компании по освоению внешнего рынка
Оценка потенциальных возможностей компании по освоению внешнего рынка Культура и быт России в XVII веке
Культура и быт России в XVII веке Педагогический совет «Новые образовательные стандарты: программа духовно-нравственного развития» Использование социально-обра
Педагогический совет «Новые образовательные стандарты: программа духовно-нравственного развития» Использование социально-обра Проблемы связанные с оценкой и реализацией ИННОВАЦИОННЫХ ПРОЕКТОВ
Проблемы связанные с оценкой и реализацией ИННОВАЦИОННЫХ ПРОЕКТОВ  Венчурные инновационные предприятия
Венчурные инновационные предприятия  Презентация ИСТОРИЯ КОСТЮМА
Презентация ИСТОРИЯ КОСТЮМА  Презентация Пушно-меховые товары
Презентация Пушно-меховые товары Витамин А – Ретинол; 2. Витамин Е – Токоферол; 3. Витамин Д – Эргокальциферол
Витамин А – Ретинол; 2. Витамин Е – Токоферол; 3. Витамин Д – Эргокальциферол Що або хто це?
Що або хто це? Международные отношения на ближнем и среднем Востоке. Роль НАТО и её трансформация
Международные отношения на ближнем и среднем Востоке. Роль НАТО и её трансформация Классификация стен
Классификация стен Поздние гестозы
Поздние гестозы Антифизика в супергеройских фильмах
Антифизика в супергеройских фильмах Обувь с самоподтягивающимися шнурками. Бизнес-план
Обувь с самоподтягивающимися шнурками. Бизнес-план Тема: Платежный баланс как отражение международных валютно-кредитных операций страны
Тема: Платежный баланс как отражение международных валютно-кредитных операций страны  Принципы проектирования машин
Принципы проектирования машин Числовые последовательности Устинова Н.Г., лицей №1.
Числовые последовательности Устинова Н.Г., лицей №1. Особенности работы с объемными объектами дизайна
Особенности работы с объемными объектами дизайна Библиотека UTIL.LIB. Программный и аппаратный ШИМ регуляторы (на примере пакета CoDeSys)
Библиотека UTIL.LIB. Программный и аппаратный ШИМ регуляторы (на примере пакета CoDeSys) Залог в вузовских учебниках
Залог в вузовских учебниках Создание нового поколения перестраиваемых рентгеновских источников на основе мультичастотной рентгеновской трубки
Создание нового поколения перестраиваемых рентгеновских источников на основе мультичастотной рентгеновской трубки