Содержание
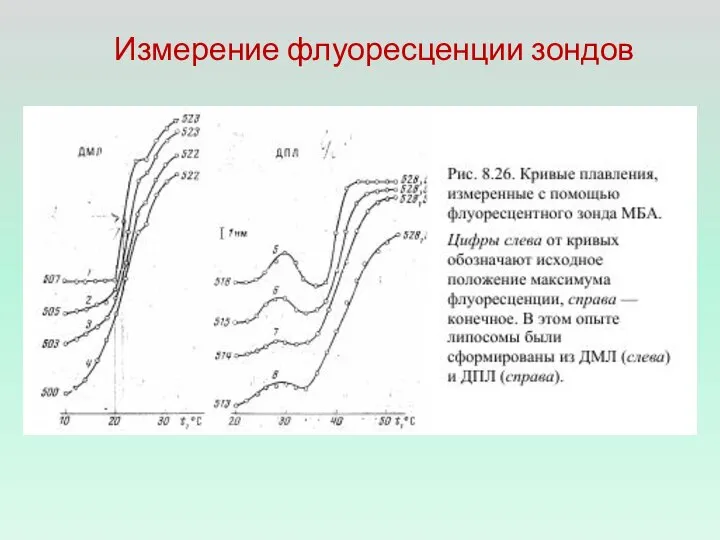
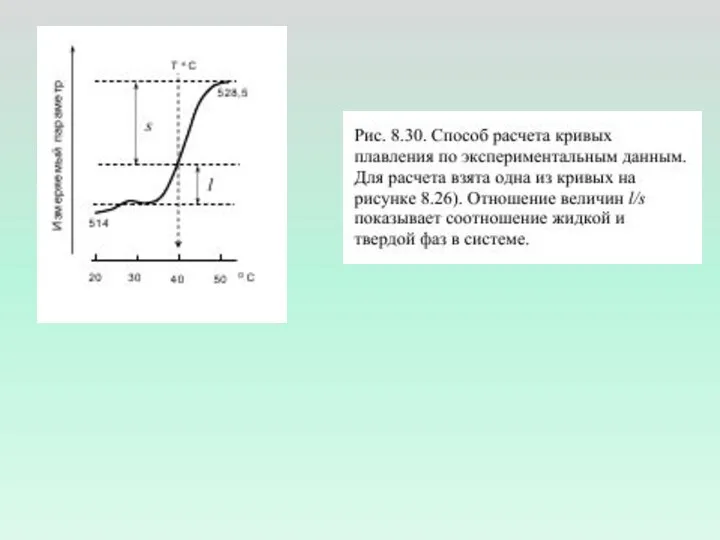
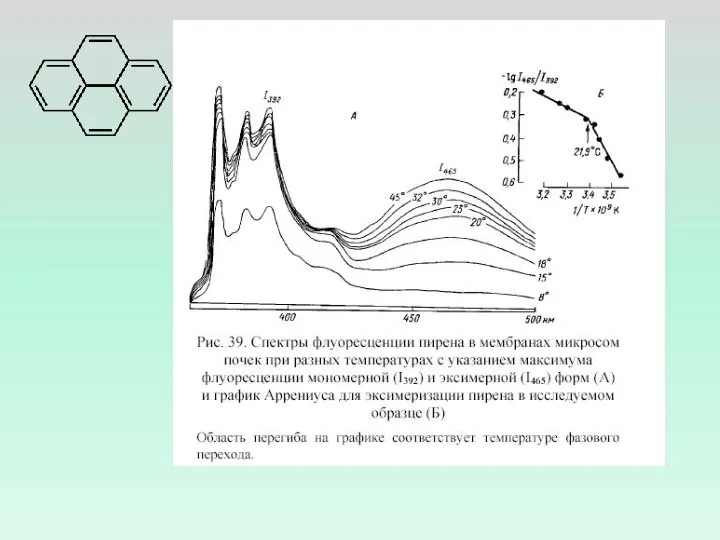
- 2. Измерение флуоресценции зондов
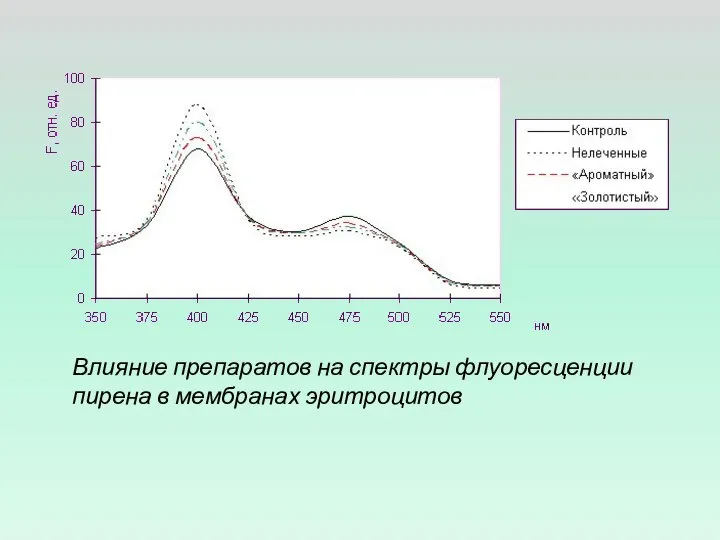
- 5. Влияние препаратов на спектры флуоресценции пирена в мембранах эритроцитов
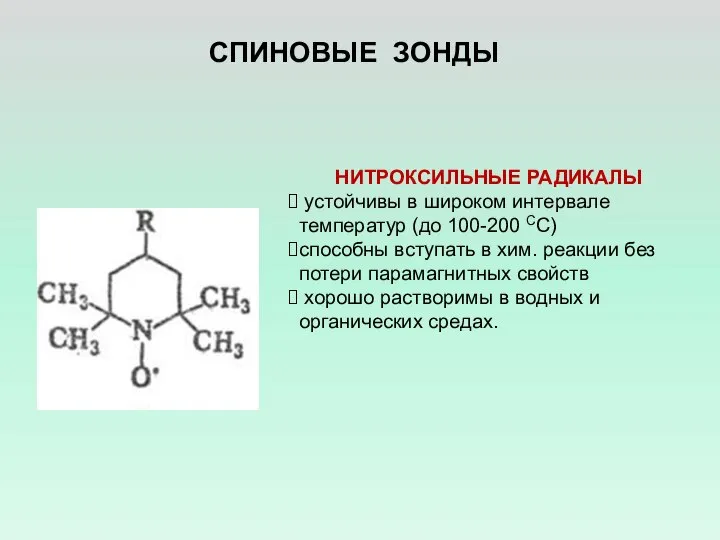
- 6. СПИНОВЫЕ ЗОНДЫ НИТРОКСИЛЬНЫЕ РАДИКАЛЫ устойчивы в широком интервале температур (до 100-200 СС) способны вступать в хим.
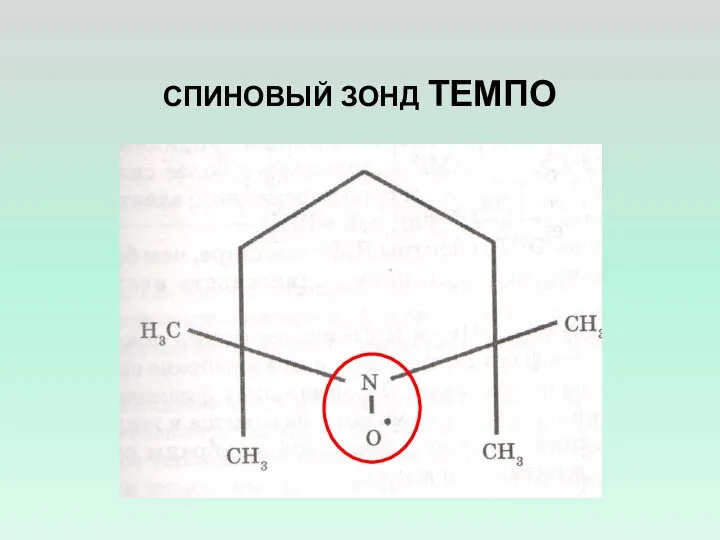
- 7. СПИНОВЫЙ ЗОНД ТЕМПО
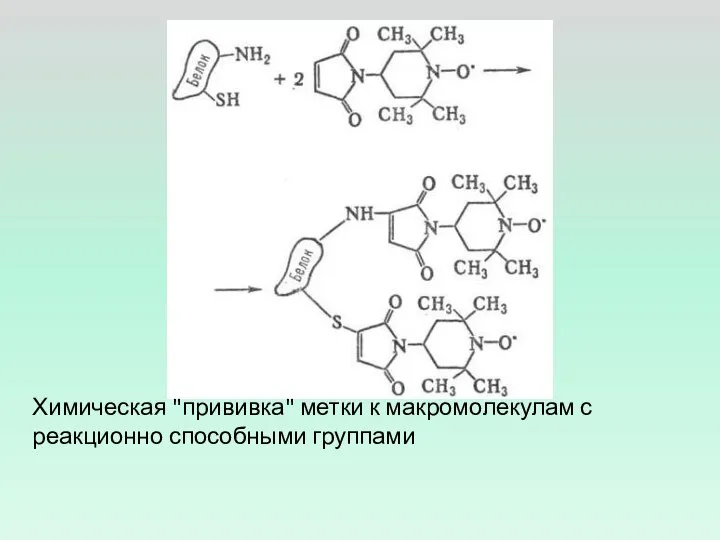
- 8. Химическая "прививка" метки к макромолекулам с реакционно способными группами
- 9. Реакции макромолекул с бирадикалами и спиновыми ловушками. Спиновая ловушка - соединение, образующее стабильные радикалы при взаимодействии
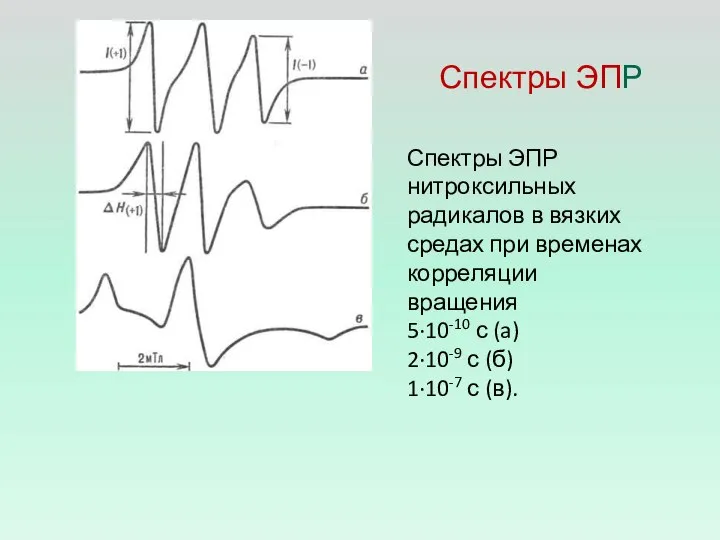
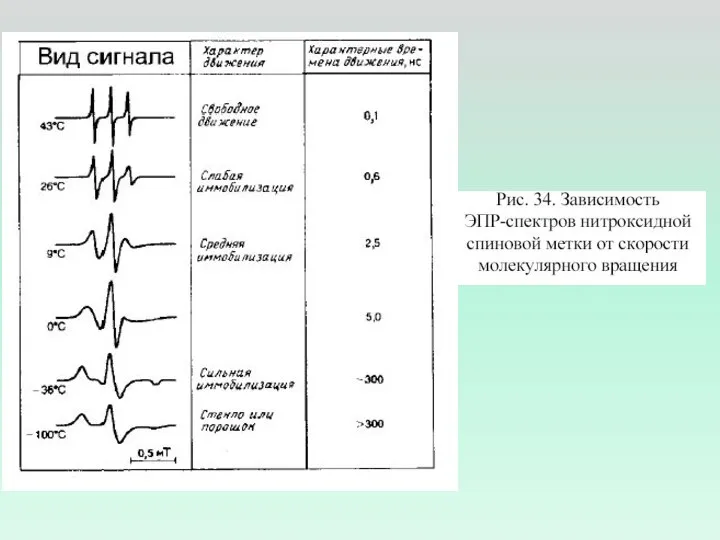
- 10. Спектры ЭПР Спектры ЭПР нитроксильных радикалов в вязких средах при временах корреляции вращения 5·10-10 с (a)
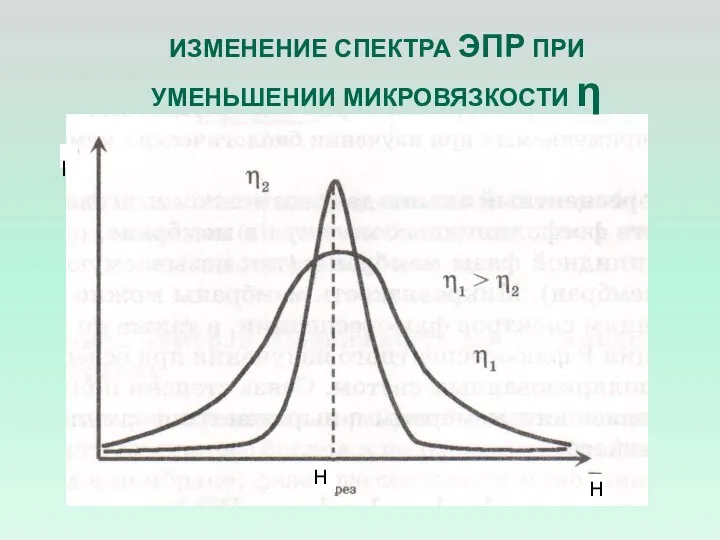
- 12. ИЗМЕНЕНИЕ СПЕКТРА ЭПР ПРИ УМЕНЬШЕНИИ МИКРОВЯЗКОСТИ η Н Н I
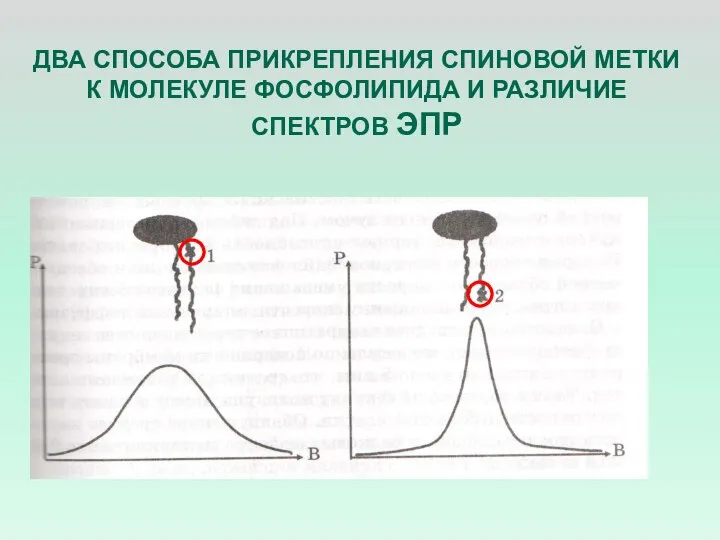
- 13. ДВА СПОСОБА ПРИКРЕПЛЕНИЯ СПИНОВОЙ МЕТКИ К МОЛЕКУЛЕ ФОСФОЛИПИДА И РАЗЛИЧИЕ СПЕКТРОВ ЭПР
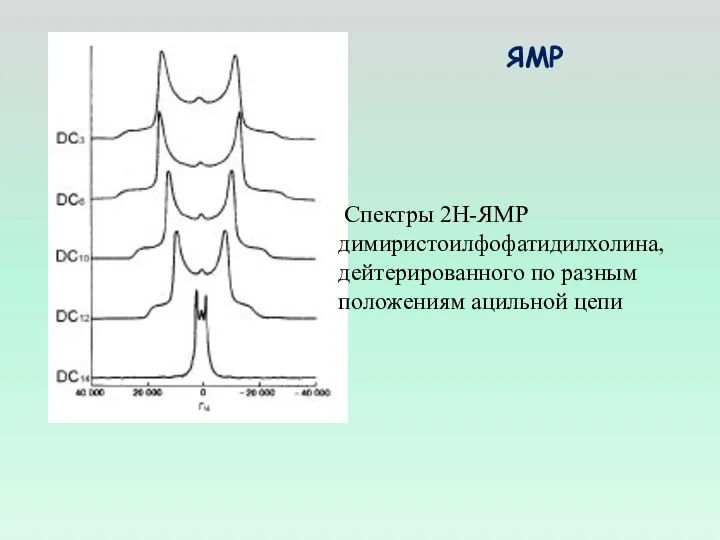
- 14. Спектры 2Н-ЯМР димиристоилфофатидилхолина, дейтерированного по разным положениям ацильной цепи ЯМР
- 15. Величины подвижности Т1 для различных атомов углерода в молекуле фосфатидилхолина в составе мембраны при температуре выше
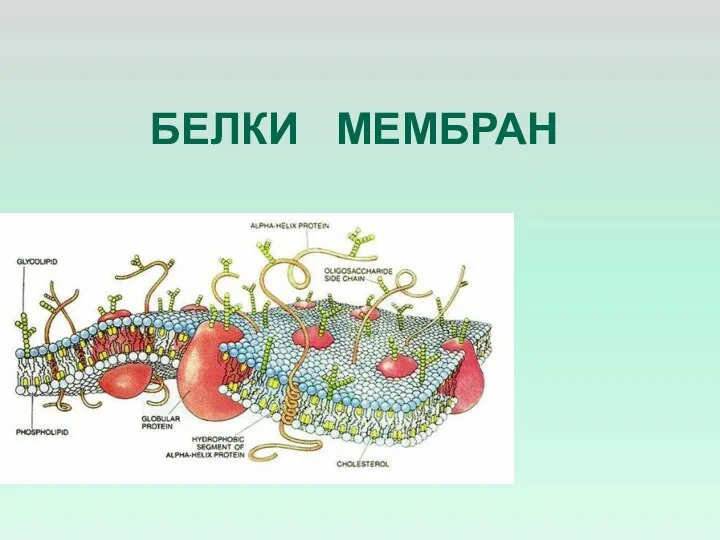
- 16. БЕЛКИ МЕМБРАН
- 17. 1.СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНЕ 2. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ 3. ПОДВИЖНОСТЬ БЕЛКОВ В МЕМБРАНЕ 4. БЕЛОК –
- 18. СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНАХ МЕМБРАНЫ СОДЕРЖАТ ОТ 20 ДО 80% БЕЛКА ПО ВЕСУ. В РАЗНЫХ МЕМБРАНАХ
- 19. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ основана на прочности взаимодействия белка с мембраной Топологическая классификация Биохимическая классификация основана на
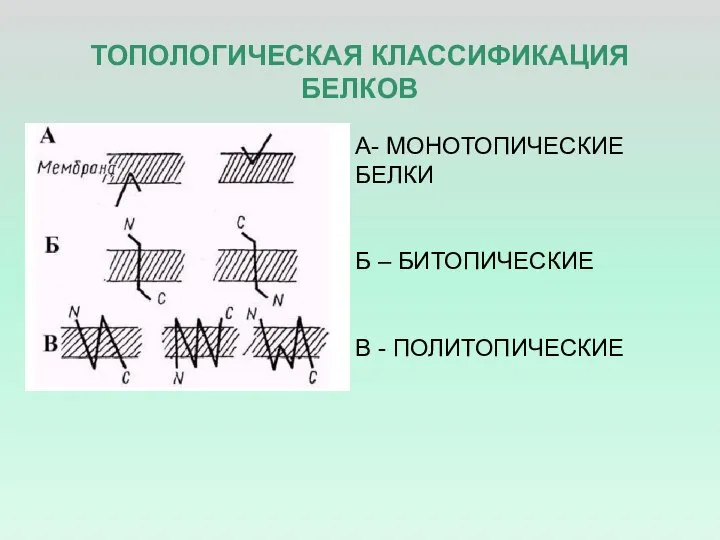
- 20. ТОПОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ БЕЛКОВ А- МОНОТОПИЧЕСКИЕ БЕЛКИ Б – БИТОПИЧЕСКИЕ В - ПОЛИТОПИЧЕСКИЕ
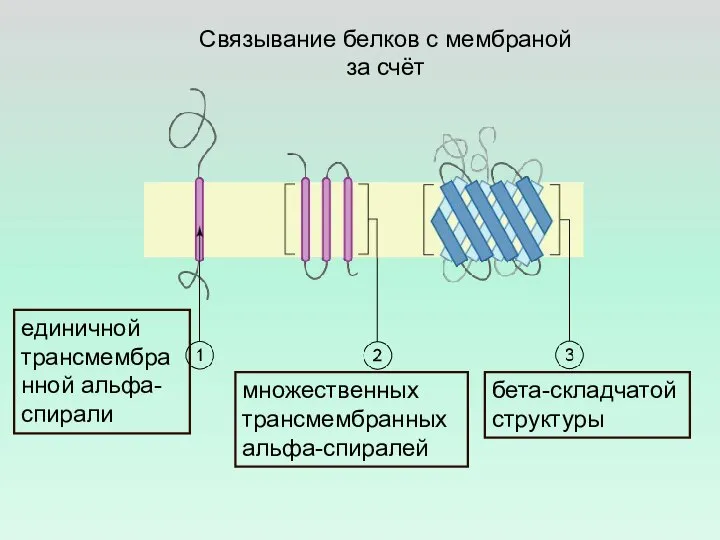
- 21. Связывание белков с мембраной за счёт единичной трансмембранной альфа-спирали множественных трансмембранных альфа-спиралей бета-складчатой структуры
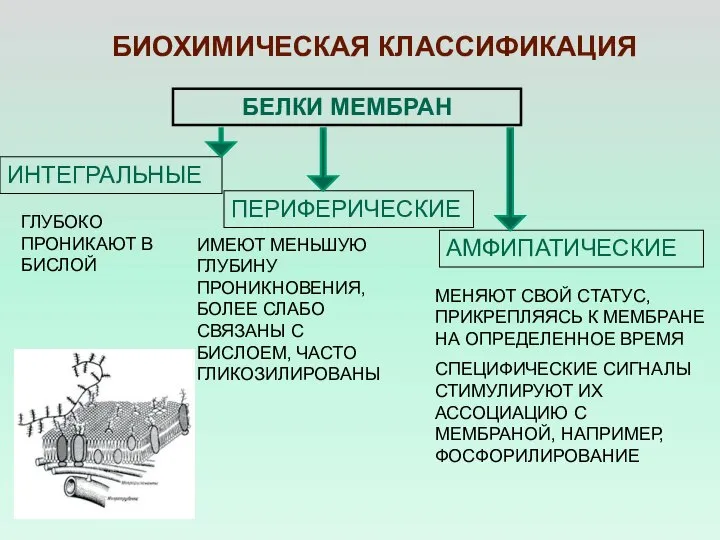
- 22. БЕЛКИ МЕМБРАН ИНТЕГРАЛЬНЫЕ ПЕРИФЕРИЧЕСКИЕ БИОХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ МЕНЯЮТ СВОЙ СТАТУС, ПРИКРЕПЛЯЯСЬ К МЕМБРАНЕ НА ОПРЕДЕЛЕННОЕ ВРЕМЯ СПЕЦИФИЧЕСКИЕ
- 23. ДЕЛЕНИЕ БЕЛКОВ НА ИНТЕГРАЛЬНЫЕ И ПЕРИФЕРИЧЕСКИЕ ОПРЕДЕЛЯЕТСЯ СТРУКТУРОЙ КОЛИЧЕСТВОМ И РАСПОЛОЖЕНИЕ ГИДРОФОБНЫХ ОСТАТКОВ
- 24. МЕМБРАННЫЕ БЕЛКИ СОСТОЯТ ИЗ ДВУХ ЧАСТЕЙ: УЧАСТКИ, БОГАТЫЕ ПОЛЯРНЫМИ АМИНОКИСЛОТНЫМИ ОСТАТКАМИ, ОБРАЩЕННЫЕ ВО ВНЕКЛЕТОЧНУЮ СРЕДУ ЧАСТО
- 25. ИНТЕГРАЛЬНЫЕ БЕЛКИ 1- ГЛИКОФОРИН, 2 – РЕЦЕПТОР АДРЕНАЛИНА
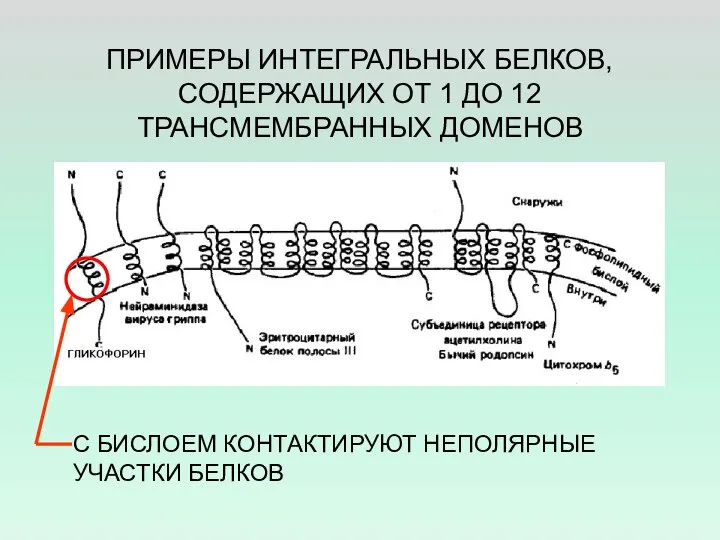
- 26. ПРИМЕРЫ ИНТЕГРАЛЬНЫХ БЕЛКОВ, СОДЕРЖАЩИХ ОТ 1 ДО 12 ТРАНСМЕМБРАННЫХ ДОМЕНОВ С БИСЛОЕМ КОНТАКТИРУЮТ НЕПОЛЯРНЫЕ УЧАСТКИ БЕЛКОВ
- 27. 1. КОЛИЧЕСТВО ГИДРОФИЛЬНЫХ АМИНОКИСЛОТ ПРИМЕРНО ТАКОЕ ЖЕ, КАК И В ОБЫЧНЫХ ВОДОРАСТВОРИМЫХ БЕЛКАХ, НО В ВОДЕ
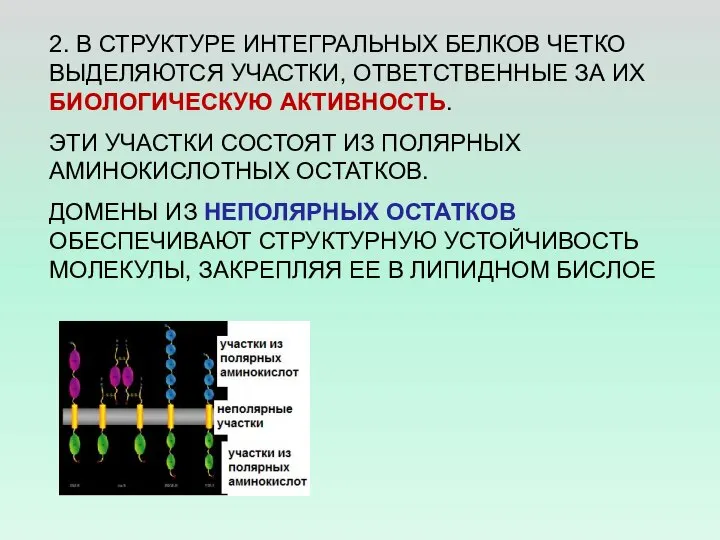
- 28. 2. В СТРУКТУРЕ ИНТЕГРАЛЬНЫХ БЕЛКОВ ЧЕТКО ВЫДЕЛЯЮТСЯ УЧАСТКИ, ОТВЕТСТВЕННЫЕ ЗА ИХ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ. ЭТИ УЧАСТКИ СОСТОЯТ
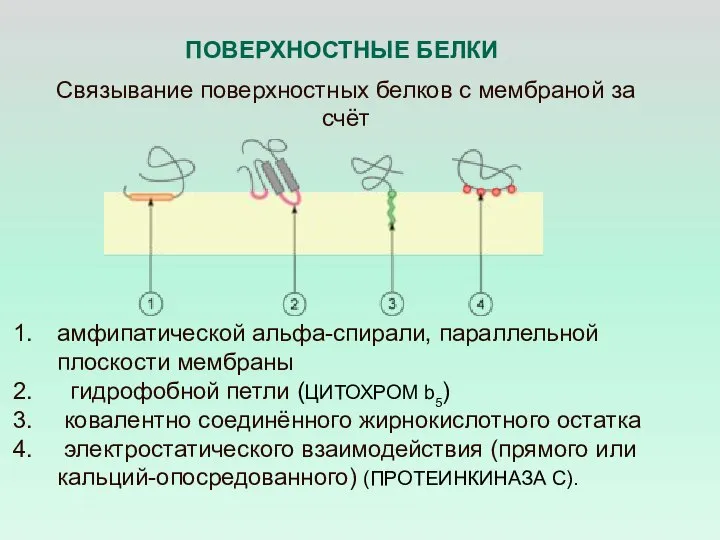
- 29. амфипатической альфа-спирали, параллельной плоскости мембраны гидрофобной петли (ЦИТОХРОМ b5) ковалентно соединённого жирнокислотного остатка электростатического взаимодействия (прямого
- 30. 5 – БЕЛКИ, СВЯЗАННЫЕ С ИНТЕГРАЛЬНЫМИ БЕЛКАМИ,
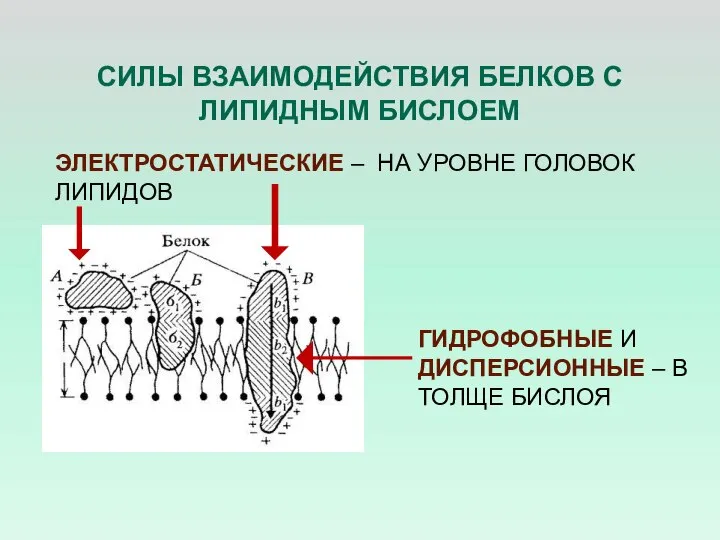
- 32. СИЛЫ ВЗАИМОДЕЙСТВИЯ БЕЛКОВ С ЛИПИДНЫМ БИСЛОЕМ ЭЛЕКТРОСТАТИЧЕСКИЕ – НА УРОВНЕ ГОЛОВОК ЛИПИДОВ ГИДРОФОБНЫЕ И ДИСПЕРСИОННЫЕ –
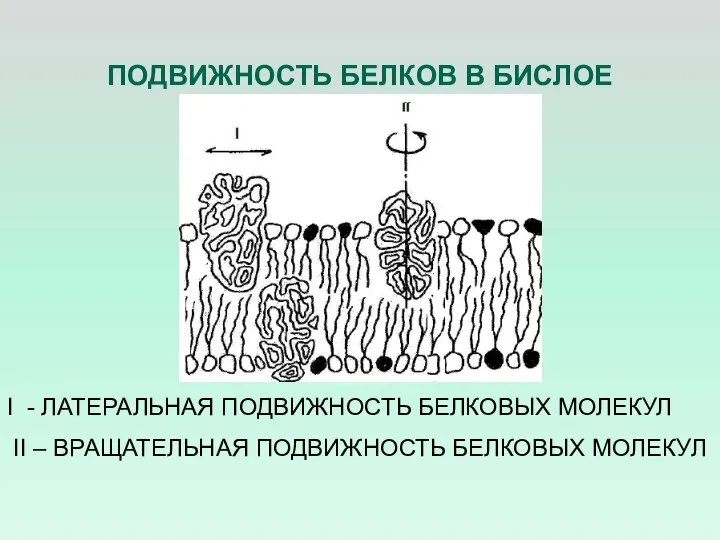
- 33. ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ I - ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ II – ВРАЩАТЕЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ
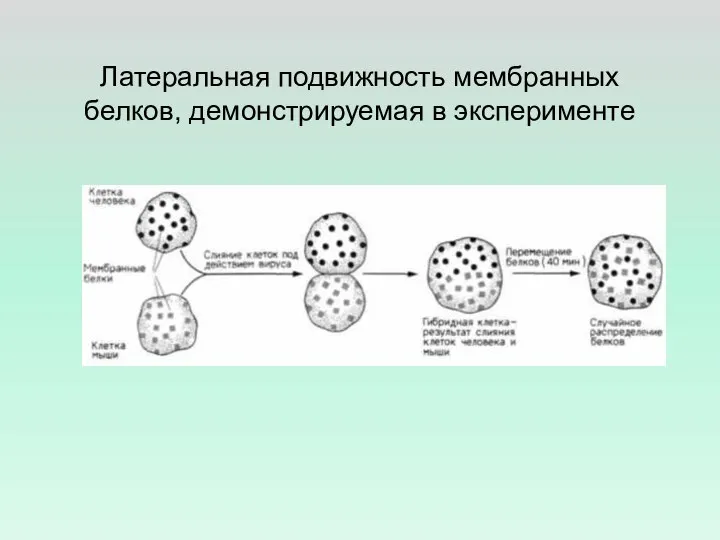
- 34. Латеральная подвижность мембранных белков, демонстрируемая в эксперименте
- 35. ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ И ИХ ВЛИЯНИЕ НА ЛИПИДЫ МЕМБРАН БОЛЕЕ ПОДВИЖНЫМИ ОКАЗЫВАЮТСЯ ПЕРИФЕРИЧЕСКИЕ БЕЛКИ. ОНИ
- 36. ЛАТЕРАЛЬНАЯ ДИФФУЗИЯ ИНТЕГРАЛЬНЫХ БЕЛКОВ ОГРАНИЧЕНА ИХ РАЗМЕРАМИ, ВЗАИМОДЕЙСТВИЕМ С ДРУГИМИ БЕЛКАМИ И ЭЛЕМЕНТАМИ ЦИТОСКЕЛЕТА Времена вращательной
- 37. ИНТЕГРАЛЬНЫЕ БЕЛКИ СИЛЬНО ОГРАНИЧИВАЮТ ПОДВИЖНОСТЬ АННУЛЯРНЫХ ЛИПИДОВ. ПО СВОЕЙ ПОДВИЖНОСТИ ОНИ ОТЛИЧАЮТСЯ ОТ ОБЩИХ ЛИПИДОВ: АННУЛЯРНЫЕ
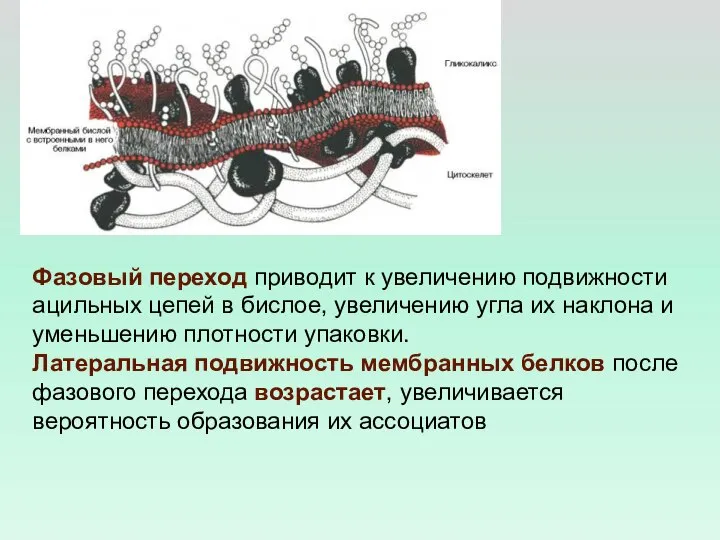
- 38. Фазовый переход приводит к увеличению подвижности ацильных цепей в бислое, увеличению угла их наклона и уменьшению
- 39. МОДИФИКАЦИЯ БИСЛОЯ БЕЛКАМИ ВЫДЕЛЯЮТ 4 ОСНОВНЫХ ТИПА БЕЛОК-ЛИПИДНЫХ КОНТАКТОВ
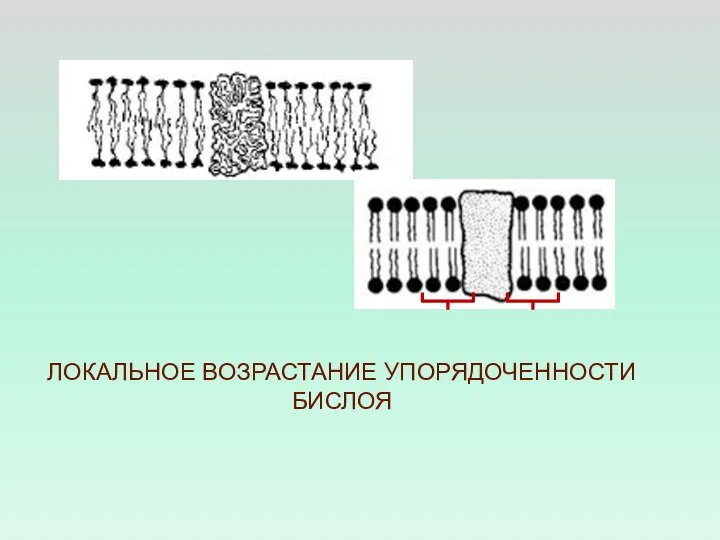
- 40. ЛОКАЛЬНОЕ ВОЗРАСТАНИЕ УПОРЯДОЧЕННОСТИ БИСЛОЯ
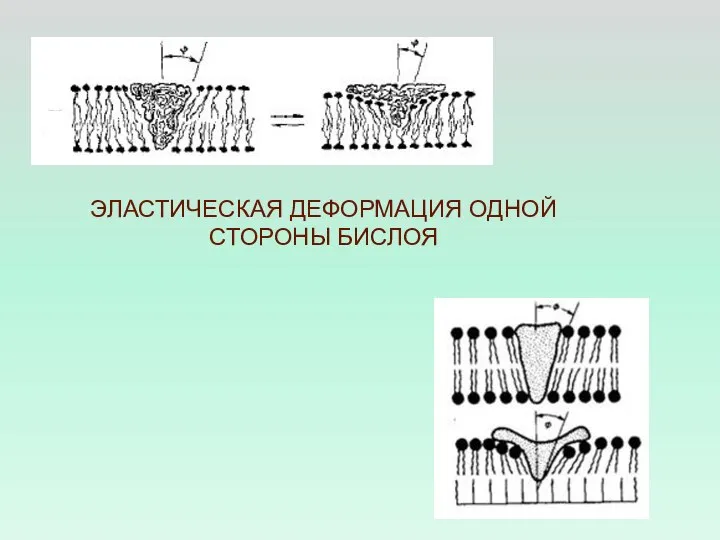
- 41. ЭЛАСТИЧЕСКАЯ ДЕФОРМАЦИЯ ОДНОЙ СТОРОНЫ БИСЛОЯ
- 42. РЕЗКОЕ ИЗМЕНЕНИЕ ГРАДИЕНТА КРИВИЗНЫ И ДЕФОРМАЦИЯ БИСЛОЯ
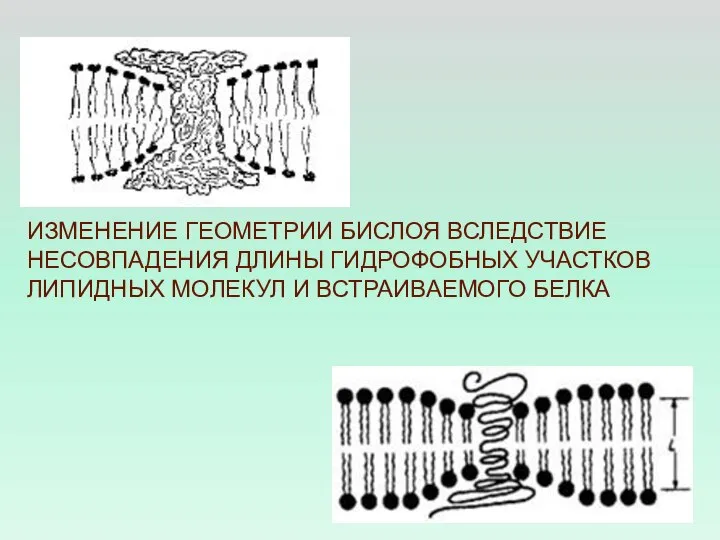
- 43. ИЗМЕНЕНИЕ ГЕОМЕТРИИ БИСЛОЯ ВСЛЕДСТВИЕ НЕСОВПАДЕНИЯ ДЛИНЫ ГИДРОФОБНЫХ УЧАСТКОВ ЛИПИДНЫХ МОЛЕКУЛ И ВСТРАИВАЕМОГО БЕЛКА
- 45. Скачать презентацию















 Karate. Taekwondo
Karate. Taekwondo Новорожденность и младенчество
Новорожденность и младенчество Резьбовые соединения (РС)
Резьбовые соединения (РС) Строительство и эксплуатация объектов ландшафтного строительства
Строительство и эксплуатация объектов ландшафтного строительства  Авдашева Светлана Борисовна, профессор ГУ-ВШЭ, avdash@hse.ru
Авдашева Светлана Борисовна, профессор ГУ-ВШЭ, avdash@hse.ru Перегородки. Виды перегородок
Перегородки. Виды перегородок Достопримечательности
Достопримечательности Многоэтажные дроби
Многоэтажные дроби  Схемо- и системотехника электронных средств
Схемо- и системотехника электронных средств Выборы в Украине
Выборы в Украине Телесериал «Мастер и Маргарита»
Телесериал «Мастер и Маргарита» Трехуровневая архитектура БД, модель взаимодействия
Трехуровневая архитектура БД, модель взаимодействия Java RMI
Java RMI Экспертиза Рыбных консервов
Экспертиза Рыбных консервов Культура Древней Индии
Культура Древней Индии Разновидности и особенности полупроводниковых диодов
Разновидности и особенности полупроводниковых диодов Сказка о морском царе и Настасье Премудрой - презентация для начальной школы
Сказка о морском царе и Настасье Премудрой - презентация для начальной школы Фиалковская Н.В. учитель начальных классов
Фиалковская Н.В. учитель начальных классов  Консервация политического режима в СССР
Консервация политического режима в СССР Аускультация сердца. Тоны сердца. Сердечные шумы
Аускультация сердца. Тоны сердца. Сердечные шумы Магия музыки
Магия музыки  Функция (7 класс) - презентация по Алгебре
Функция (7 класс) - презентация по Алгебре Название конкурса: Рождественская открытка Номинация: Мультимедийная презентация Название работы: Традиции Рождества
Название конкурса: Рождественская открытка Номинация: Мультимедийная презентация Название работы: Традиции Рождества Національно-визвольний рух "Правий сектор"
Національно-визвольний рух "Правий сектор" Презентация 1 1
Презентация 1 1 Золотая Хохлома
Золотая Хохлома Северо-Западный федеральный округ. Отраслевая структура промышленности
Северо-Западный федеральный округ. Отраслевая структура промышленности Производственное обучение
Производственное обучение