Содержание
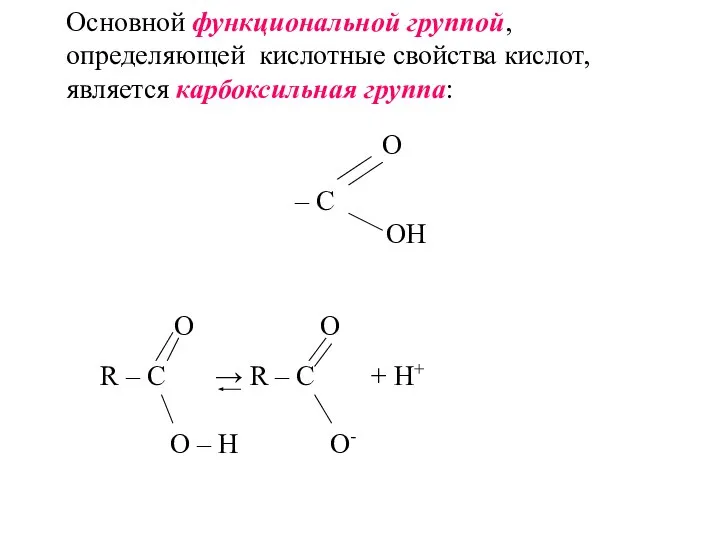
- 2. Основной функциональной группой, определяющей кислотные свойства кислот, является карбоксильная группа: О – С ОН О О
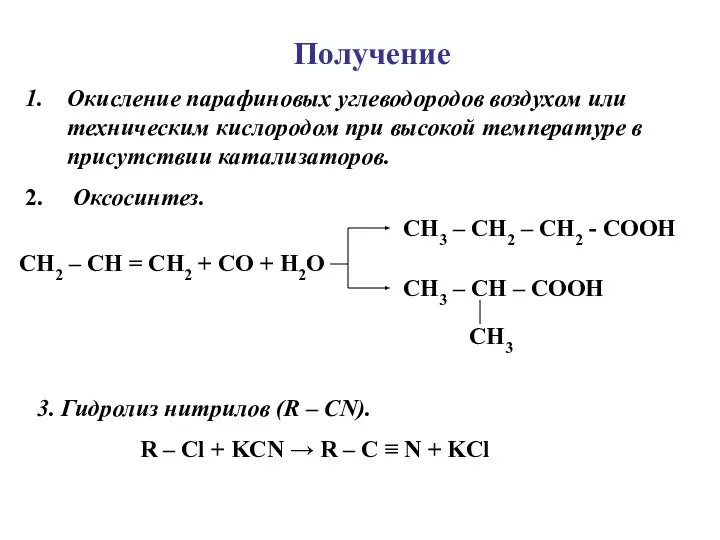
- 3. Получение Окисление парафиновых углеводородов воздухом или техническим кислородом при высокой температуре в присутствии катализаторов. Оксосинтез. СН3
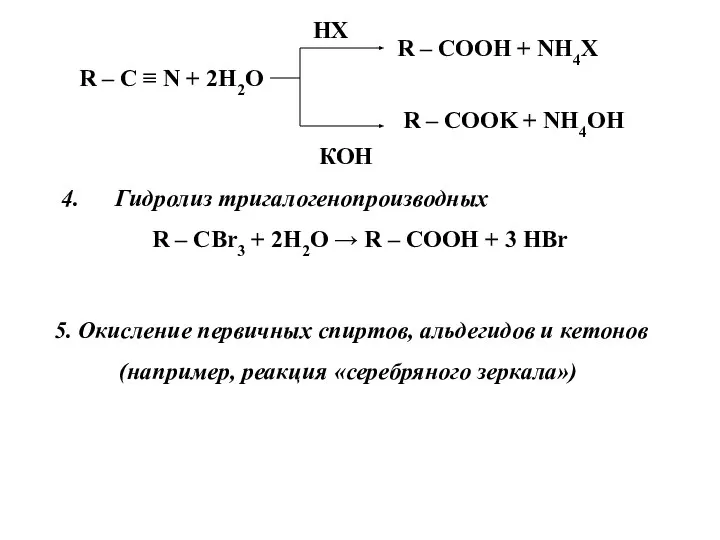
- 4. R – COOH + NH4X R – COOK + NH4OH R – C ≡ N +
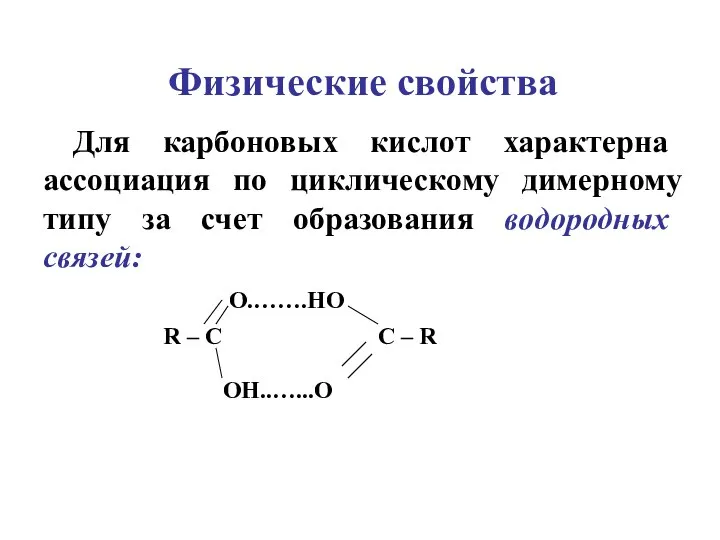
- 5. Физические свойства Для карбоновых кислот характерна ассоциация по циклическому димерному типу за счет образования водородных связей:
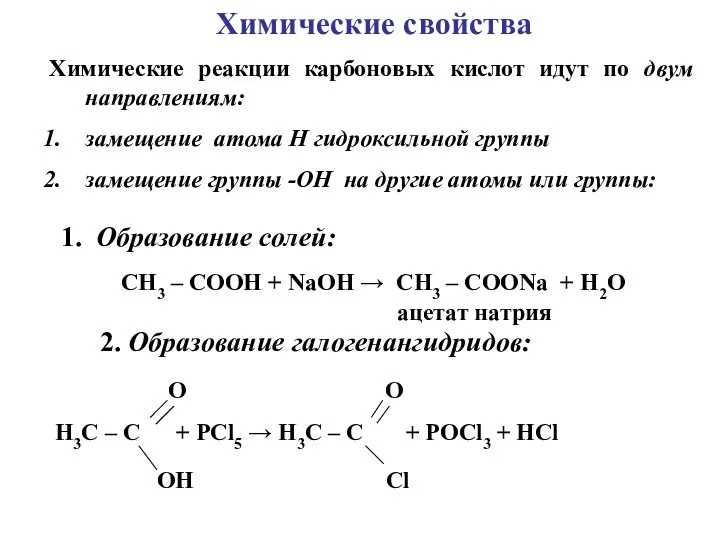
- 6. Химические свойства Химические реакции карбоновых кислот идут по двум направлениям: замещение атома H гидроксильной группы замещение
- 7. Одновалентный остаток R – C называется кислотным радикалом или ацилом О 3. Образование ангидридов. СН3 –
- 8. 5. Образование сложных эфиров (реакция этерификации). R – COOH + HO – R/ R – COOR/
- 9. 2. При нагревании с концентрированной H2SO4 разлагается: НСООН → H2O + СО Этот способ используют для
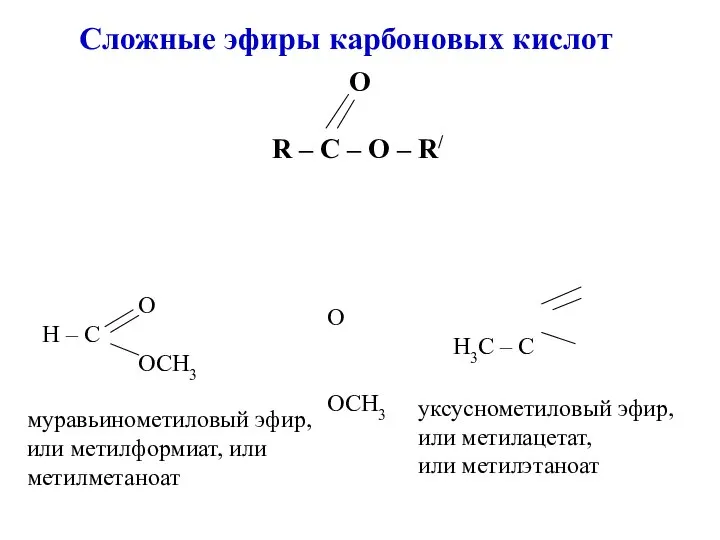
- 10. Сложные эфиры карбоновых кислот О R – C – O – R/ муравьинометиловый эфир, или метилформиат,
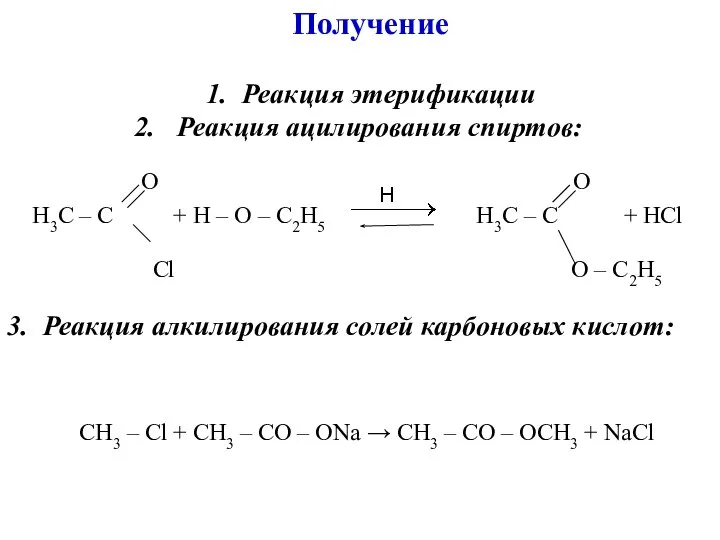
- 11. Получение 1. Реакция этерификации 2. Реакция ацилирования спиртов: 3. Реакция алкилирования солей карбоновых кислот: О О
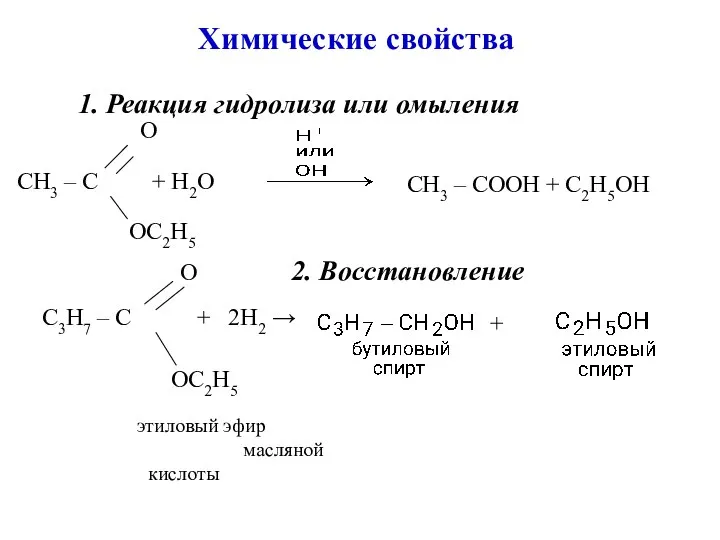
- 12. Химические свойства 1. Реакция гидролиза или омыления О СН3 – С + Н2О СН3 – СООН
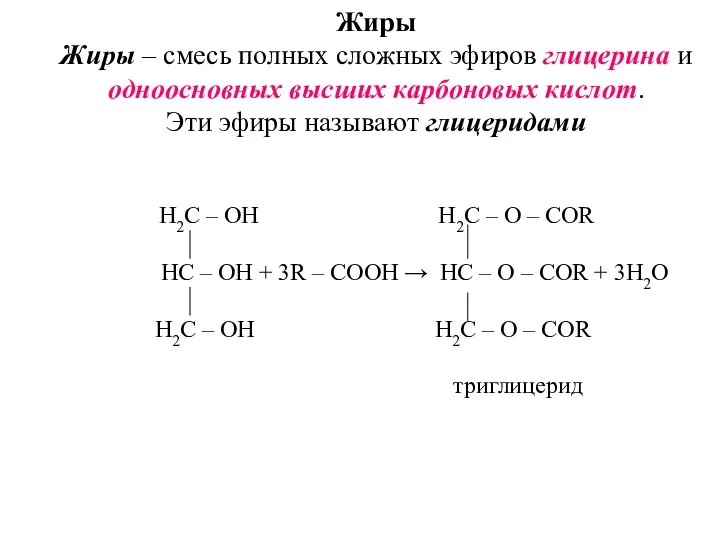
- 13. Жиры Жиры – смесь полных сложных эфиров глицерина и одноосновных высших карбоновых кислот. Эти эфиры называют
- 15. Скачать презентацию



 Основные средства гимнастики
Основные средства гимнастики BCG-матрица для цифрового маркетинга. Коровы и звезды в интернете-2011 Алина Фролова R.A.M. Advertising Group
BCG-матрица для цифрового маркетинга. Коровы и звезды в интернете-2011 Алина Фролова R.A.M. Advertising Group Державні символи України
Державні символи України УПРАВЛЕНИЕ ОБЪЕКТАМИ браузера и WEB-страницы на основе языка JavaScript
УПРАВЛЕНИЕ ОБЪЕКТАМИ браузера и WEB-страницы на основе языка JavaScript Жанр невольничьего повествования в литературе и на экране
Жанр невольничьего повествования в литературе и на экране Презентация Правовое регулирование перемещения через таможенную границу товаров и транспортных средств
Презентация Правовое регулирование перемещения через таможенную границу товаров и транспортных средств  Эволюция обучения
Эволюция обучения  сахар
сахар Воскресная школа при храме в честь апостола и евангелиста Иоанна Богослова
Воскресная школа при храме в честь апостола и евангелиста Иоанна Богослова Чертежная грамота
Чертежная грамота Политическая идеология. Сущность и структура. Подготовили Ерченко А и Гордеева К.
Политическая идеология. Сущность и структура. Подготовили Ерченко А и Гордеева К. Мовні норми у власних назвах та рекламних текстах
Мовні норми у власних назвах та рекламних текстах Програма соціально-фінансової освіти дітей у віці від 3-х до 18-ти років “АФЛАТУН”
Програма соціально-фінансової освіти дітей у віці від 3-х до 18-ти років “АФЛАТУН”  Мониторинг и экспертная оценка реализации Национального плана противодействия коррупции и антикоррупционных планов федеральных
Мониторинг и экспертная оценка реализации Национального плана противодействия коррупции и антикоррупционных планов федеральных Was ist das?
Was ist das? Сыры
Сыры Индейцы
Индейцы Презентация "Красота в разные эпохи (1)" - скачать презентации по МХК
Презентация "Красота в разные эпохи (1)" - скачать презентации по МХК Условные расчеты на прочность
Условные расчеты на прочность Патристика IV - VIII веков. Греческая патристика
Патристика IV - VIII веков. Греческая патристика Категории эстетического «Увы, земной недолог путь, И все ж во власти человека – Великое, творя, шагнуть За рамки собственного век
Категории эстетического «Увы, земной недолог путь, И все ж во власти человека – Великое, творя, шагнуть За рамки собственного век П.И.Чайковский. (биография) - презентация для начальной школы
П.И.Чайковский. (биография) - презентация для начальной школы Асинхронды қозғалтқыш
Асинхронды қозғалтқыш Детская лесная республика «Гамаюния»
Детская лесная республика «Гамаюния» Отвес и строительный уровень
Отвес и строительный уровень Презентация "Охрана труда в России" - скачать презентации по Экономике
Презентация "Охрана труда в России" - скачать презентации по Экономике Творчество Леонардо да Винчи
Творчество Леонардо да Винчи Kazakhstan war berühmt mit alten Kultur foods
Kazakhstan war berühmt mit alten Kultur foods