Содержание
- 2. Учебные вопросы 1. Понятие об алканолах. Номенклатура. Изомерия. Способы получения алканолов. Физические свойства, реакционная способность. 2.
- 3. Литература Артеменко А. И. Органическая химия: Учебное пособие. – М.: Высш. шк., 2003. – С. 193-271.
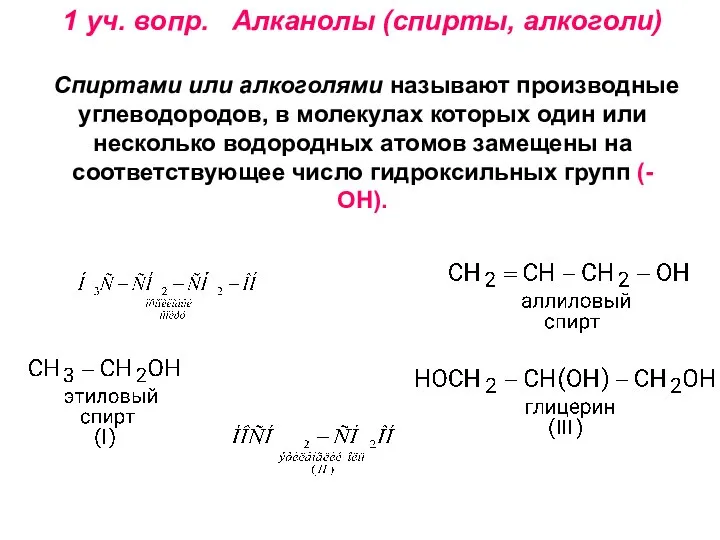
- 4. 1 уч. вопр. Алканолы (спирты, алкоголи) Спиртами или алкоголями называют производные углеводородов, в молекулах которых один
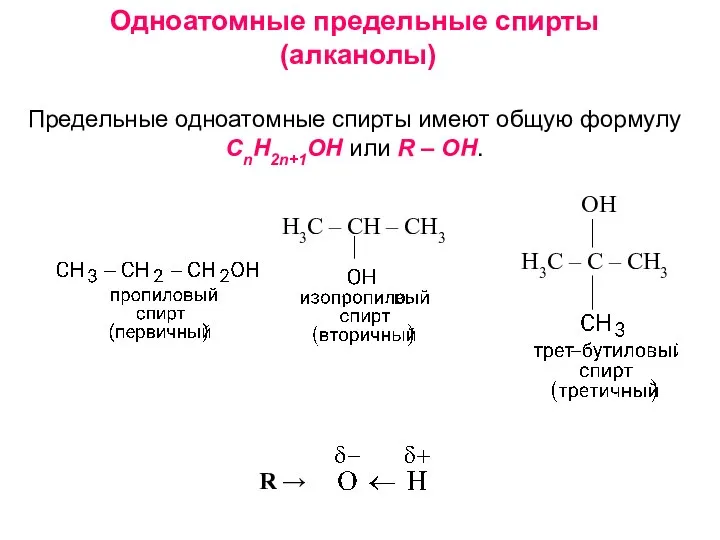
- 5. Одноатомные предельные спирты (алканолы) Предельные одноатомные спирты имеют общую формулу CnH2n+1OH или R – OH. Н3С
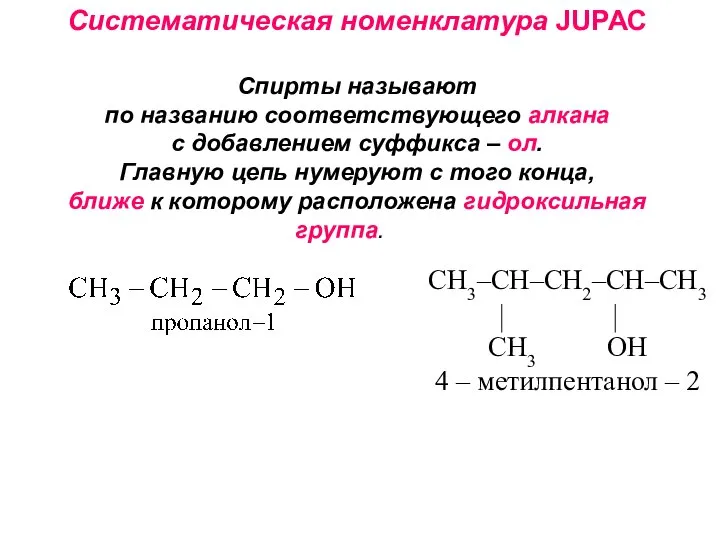
- 6. Систематическая номенклатура JUРАС Cпирты называют по названию соответствующего алкана с добавлением суффикса – ол. Главную цепь
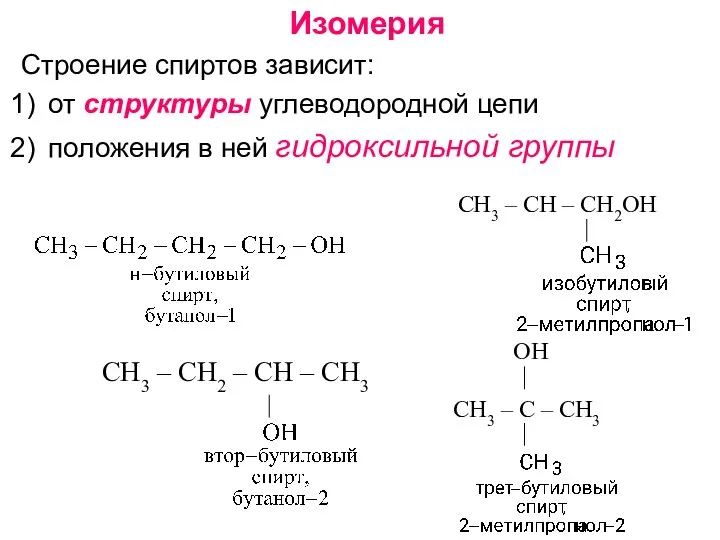
- 7. Изомерия Строение спиртов зависит: от структуры углеводородной цепи положения в ней гидроксильной группы СН3 – СН2
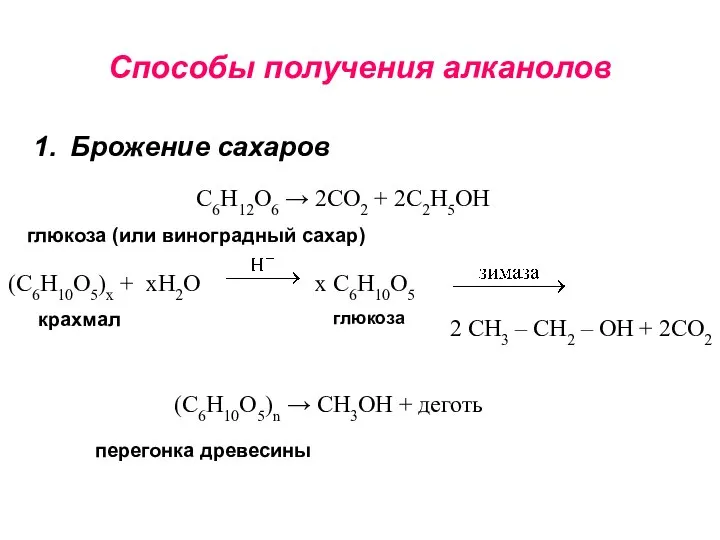
- 8. Способы получения алканолов Брожение сахаров С6Н12О6 → 2СО2 + 2С2Н5ОН (С6Н10О5)х + хН2О х С6Н10О5 2
- 9. Промышленные способы получения алканолов 1. Гидрирование оксида углерода (II) – синтез по Фишеру – Тропшу. СО
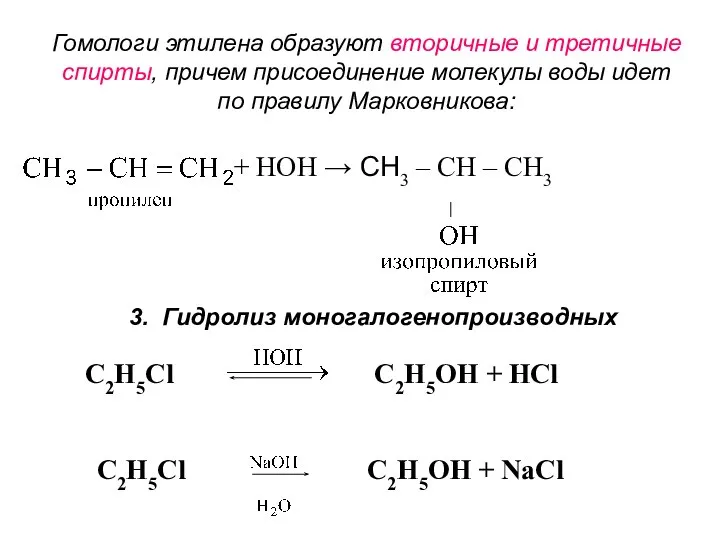
- 10. Гомологи этилена образуют вторичные и третичные спирты, причем присоединение молекулы воды идет по правилу Марковникова: +
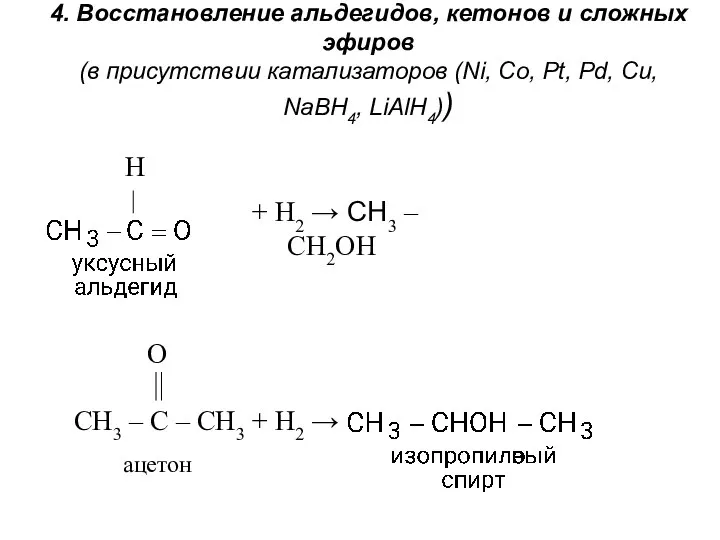
- 11. 4. Восстановление альдегидов, кетонов и сложных эфиров (в присутствии катализаторов (Ni, Co, Pt, Pd, Cu, NaBH4,
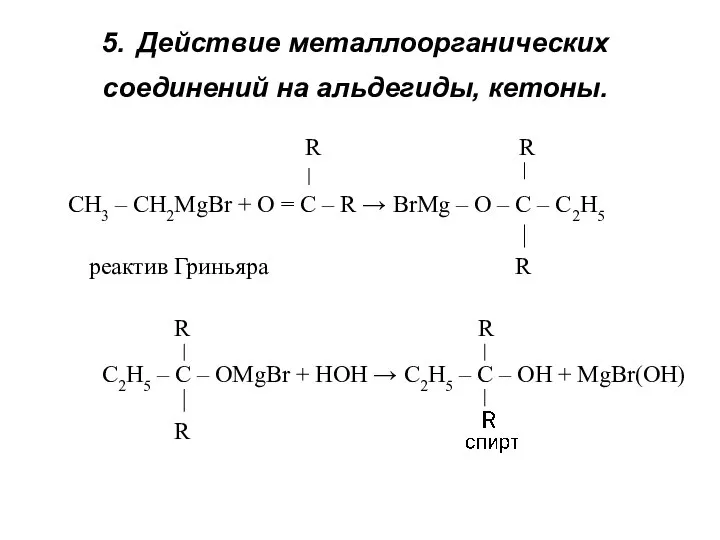
- 12. 5. Действие металлоорганических соединений на альдегиды, кетоны. R R CH3 – CH2MgBr + O = C
- 13. Физические свойства Предельные одноатомные спирты от С1 до С12 – жидкости. Высшие спирты – мазеобразные вещества,
- 14. Химические свойства Реакции гидроксильного водорода Взаимодействие спиртов со щелочными металлами (образование алкоголятов) 2C2H5OH + 2Na →
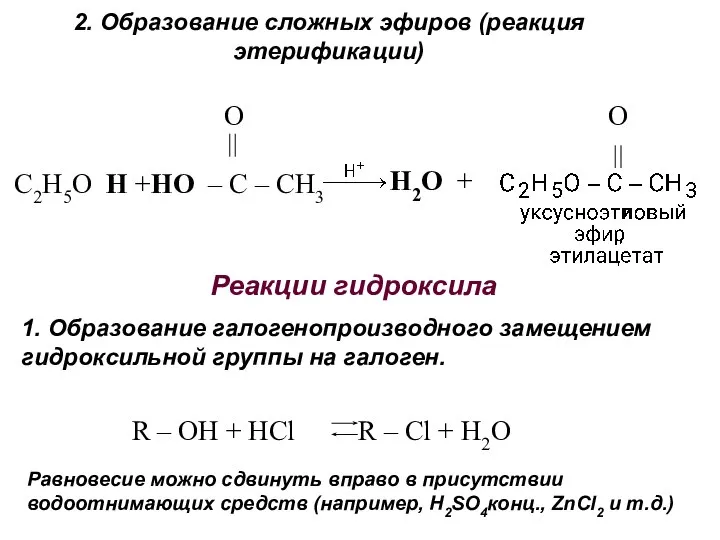
- 15. 2. Образование сложных эфиров (реакция этерификации) O O C2H5O H +HO – C – CH3 H2O
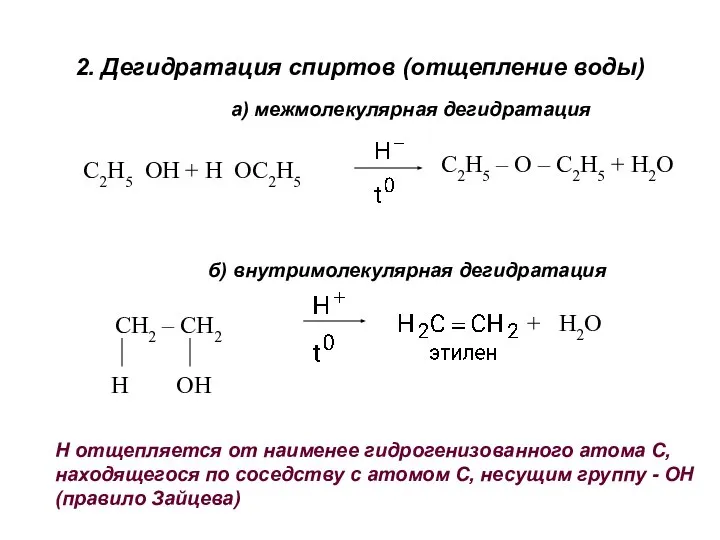
- 16. 2. Дегидратация спиртов (отщепление воды) С2Н5 ОН + Н ОС2Н5 С2Н5 – О – С2Н5 +
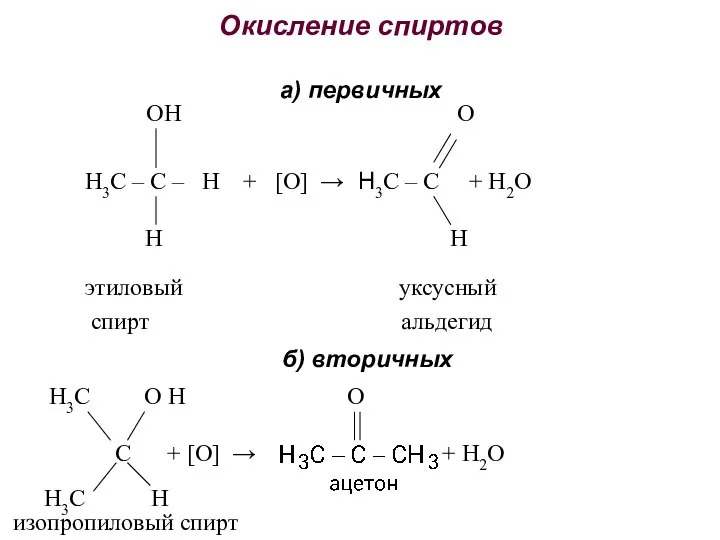
- 17. Окисление спиртов а) первичных ОН О Н3С – С – Н + [О] → Н3С –
- 18. Третичные спирты окисляются очень трудно с разрывом углеродного скелета и образованием смеси кислот и кетонов: ОН
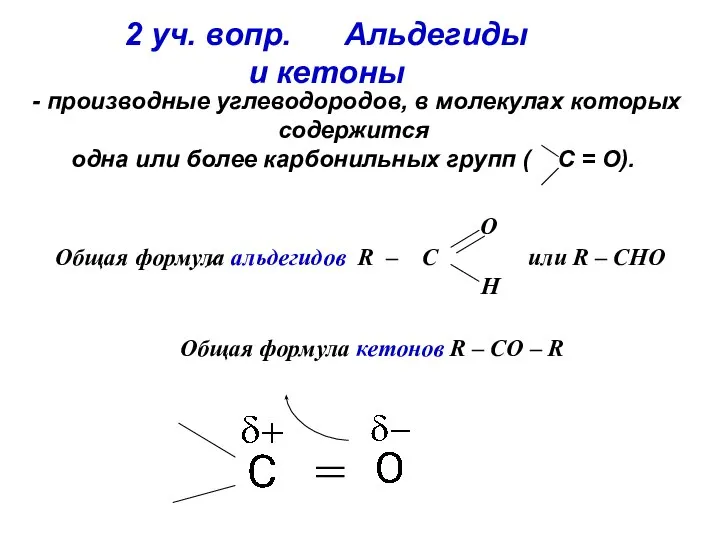
- 19. 2 уч. вопр. Альдегиды и кетоны - производные углеводородов, в молекулах которых содержится одна или более
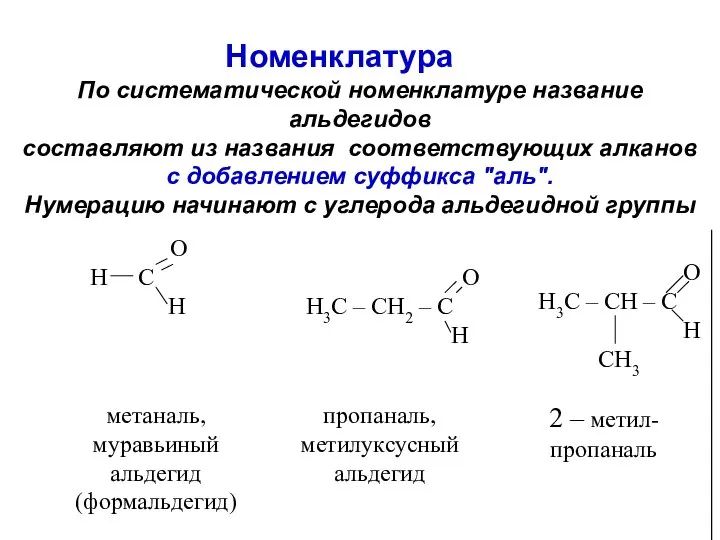
- 20. Номенклатура По систематической номенклатуре название альдегидов составляют из названия соответствующих алканов с добавлением суффикса "аль". Нумерацию
- 21. Названия кетонов по систематической номенклатуре составляют из названия соответствующих алканов, добавляя суффикс – он и указывая
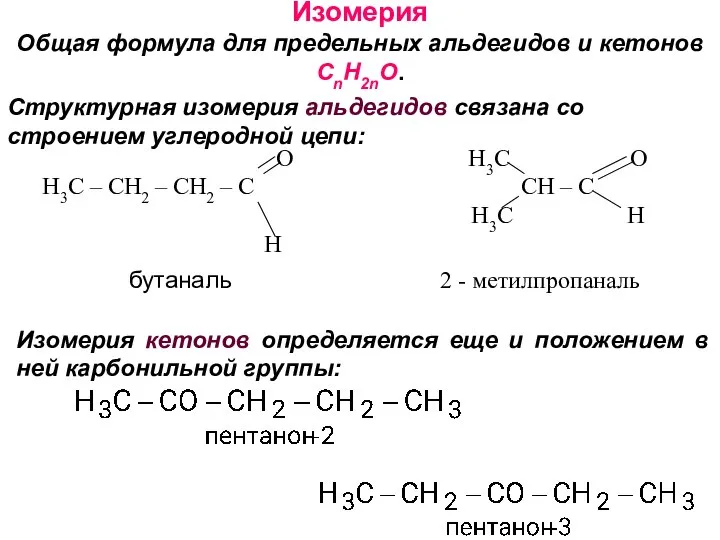
- 22. Изомерия Общая формула для предельных альдегидов и кетонов CnH2nO. Структурная изомерия альдегидов связана со строением углеродной
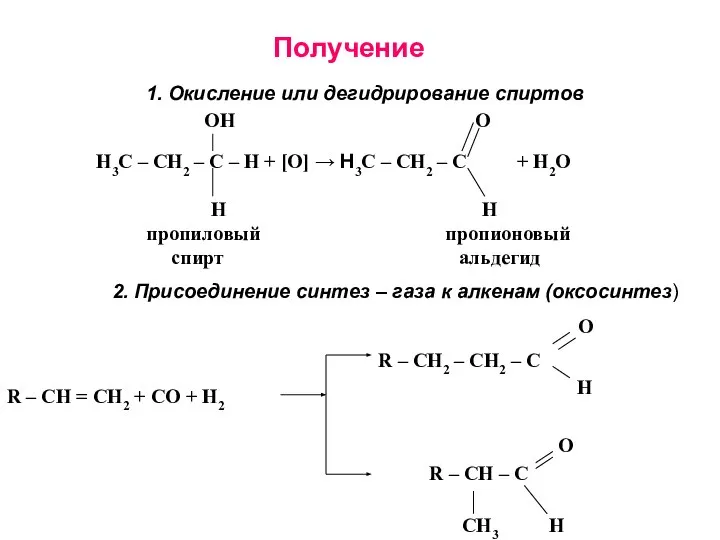
- 23. Получение 1. Окисление или дегидрирование спиртов 2. Присоединение синтез – газа к алкенам (оксосинтез) ОН О
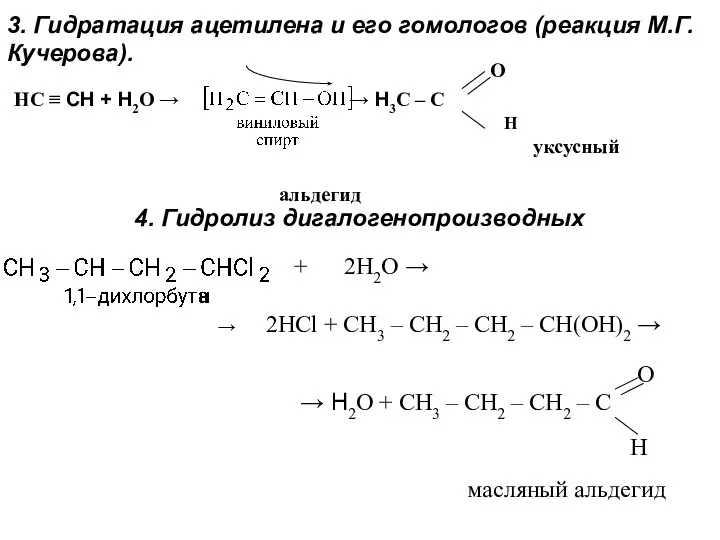
- 24. 3. Гидратация ацетилена и его гомологов (реакция М.Г. Кучерова). 4. Гидролиз дигалогенопроизводных НС ≡ СН +
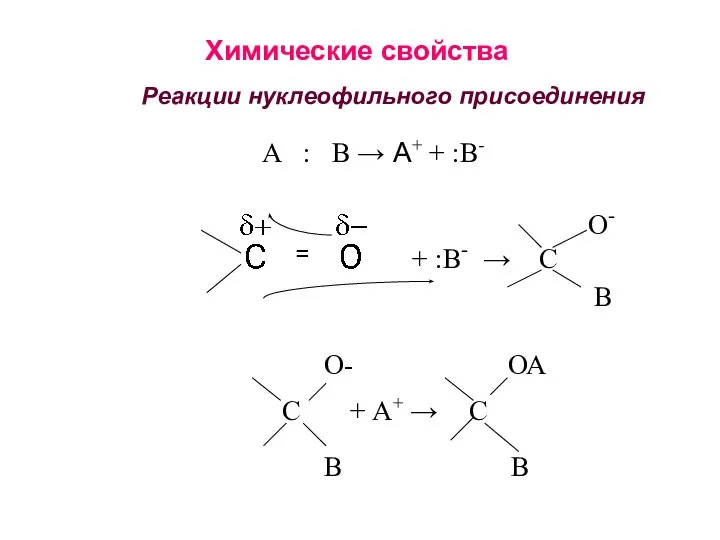
- 25. Химические свойства Реакции нуклеофильного присоединения = + :В- → С О- В А : В →
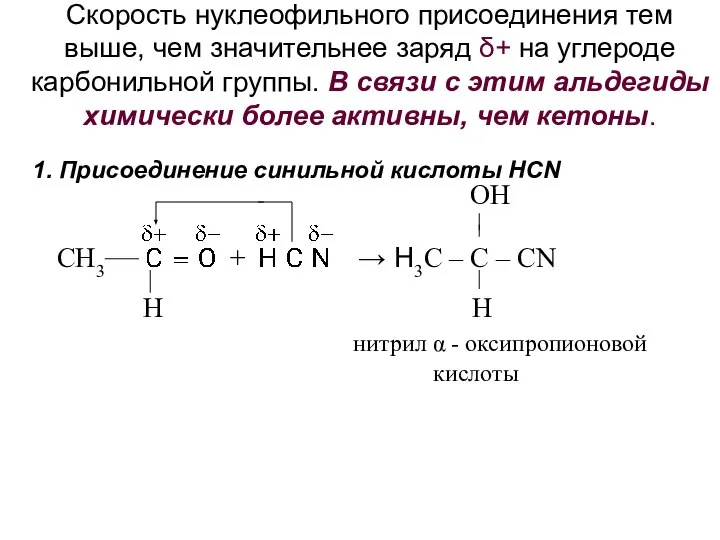
- 26. Скорость нуклеофильного присоединения тем выше, чем значительнее заряд δ+ на углероде карбонильной группы. В связи с
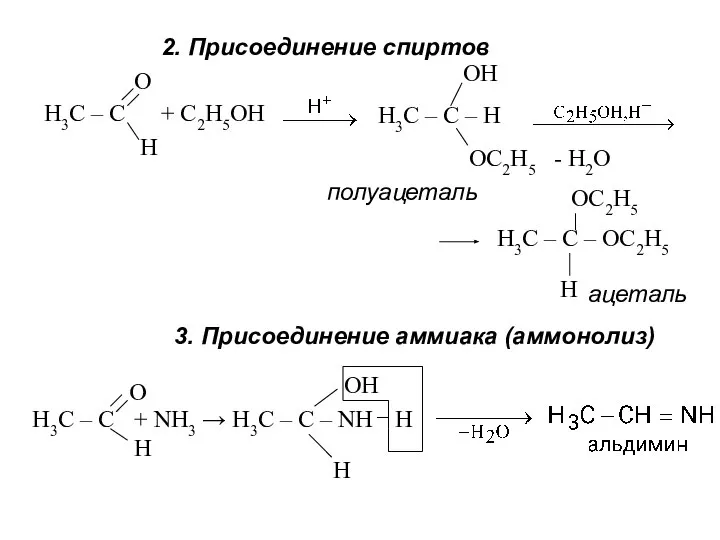
- 27. 2. Присоединение спиртов Н3С – С + С2Н5ОН Н3С – С – Н О Н ОН
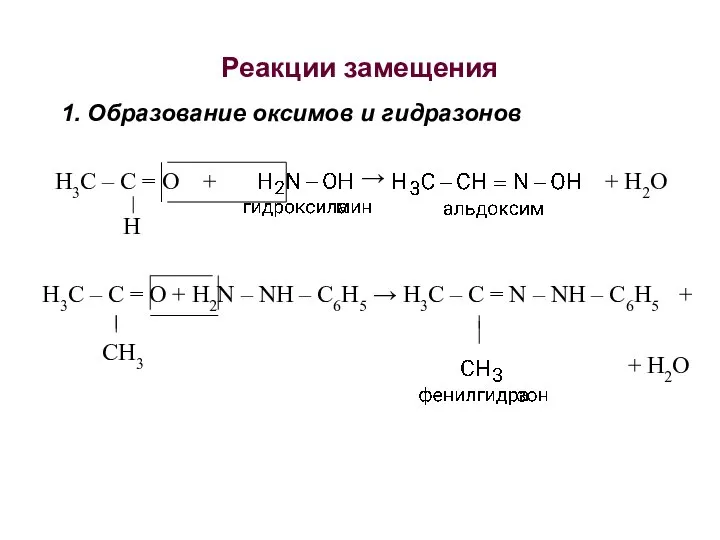
- 28. Реакции замещения 1. Образование оксимов и гидразонов H3C – C = O + + H2O →
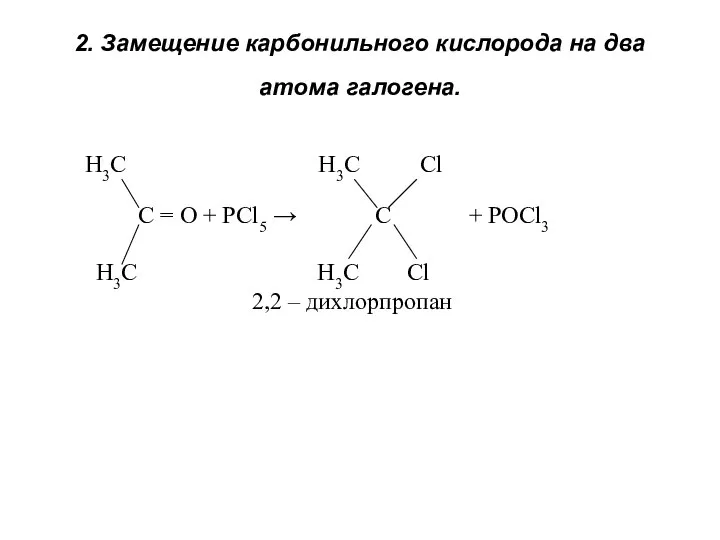
- 29. 2. Замещение карбонильного кислорода на два атома галогена. Н3С Н3С Cl C = O + PCl5
- 30. Окисление альдегидов и кетонов О СН3 – СНО + 2[Ag(NH3)2]OH → СН3 – С + 3NH3
- 32. Скачать презентацию







![Окисление альдегидов и кетонов О СН3 – СНО + 2[Ag(NH3)2]OH →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1303989/slide-29.jpg)
 Снаряжение для выхода в лес
Снаряжение для выхода в лес Прибыль и рентабельность предприятия
Прибыль и рентабельность предприятия  Валеологические требования к уроку Денисова А. Н. доцент кафедры ЕНД БИПКиПРО
Валеологические требования к уроку Денисова А. Н. доцент кафедры ЕНД БИПКиПРО Презентация Диффузионистское направление в изучении культуры.
Презентация Диффузионистское направление в изучении культуры. МЕЗЕНХИМАЛЬНЫЕ ОПУХОЛИ
МЕЗЕНХИМАЛЬНЫЕ ОПУХОЛИ Урок литературного чтения Булат Окуджава «Весна» 3 класс УМК «Школа 2100»
Урок литературного чтения Булат Окуджава «Весна» 3 класс УМК «Школа 2100» Презентация к уроку по коми языку. Финно-угорский книжный детский мир
Презентация к уроку по коми языку. Финно-угорский книжный детский мир Приготовление растворов, смесей и мастик, расчёт расхода
Приготовление растворов, смесей и мастик, расчёт расхода Христос воскрес
Христос воскрес Отсортированная матрица
Отсортированная матрица малая группа 1
малая группа 1 МОДЕЛЬ ИЗМЕНЕНИЙ В Сатир
МОДЕЛЬ ИЗМЕНЕНИЙ В Сатир Параметр порядка
Параметр порядка Экономика стран Евразийского экономического сообщества
Экономика стран Евразийского экономического сообщества Оператор присваивания. Переменна
Оператор присваивания. Переменна Презентация "Чудо-дерево" - скачать презентации по МХК
Презентация "Чудо-дерево" - скачать презентации по МХК Налог на имущество физических лиц
Налог на имущество физических лиц Развитие маркетинга в Китае Подготовила: Клеутина Светлана ДС_01
Развитие маркетинга в Китае Подготовила: Клеутина Светлана ДС_01  Прилади акустоелектроніки. Перетворювачі. Детектори. Відбивачі. Концентратори. Відгалужувачі
Прилади акустоелектроніки. Перетворювачі. Детектори. Відбивачі. Концентратори. Відгалужувачі Стратегический и операционный бенчмаркин
Стратегический и операционный бенчмаркин Построение календарного плана производства монтажных работ
Построение календарного плана производства монтажных работ Фундаменты. Виды фундаментов дома
Фундаменты. Виды фундаментов дома iPhone X. Дизайн и дисплей
iPhone X. Дизайн и дисплей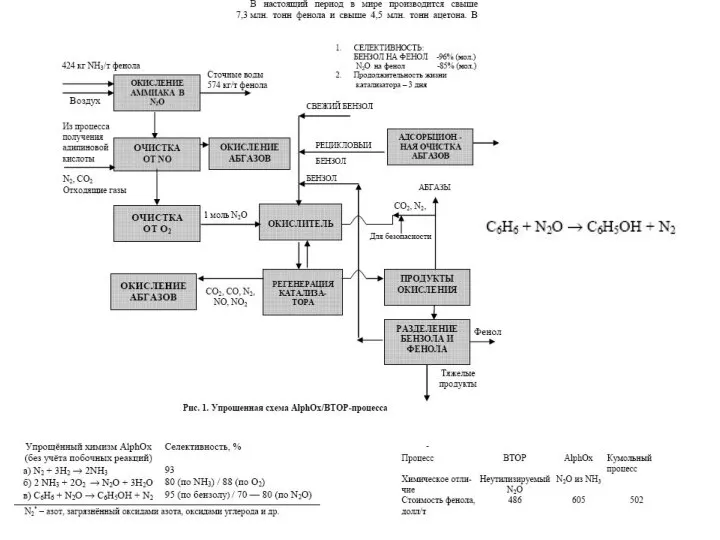 фенол, бутандиол, олефины, метанол, формалин, уротропин, пентраэритрит,ХНИВ, НТО
фенол, бутандиол, олефины, метанол, формалин, уротропин, пентраэритрит,ХНИВ, НТО Субъекты судебной экспертизы
Субъекты судебной экспертизы Культура эпохи Возрождения
Культура эпохи Возрождения Презентация Социологическая концепция Т. Парсона
Презентация Социологическая концепция Т. Парсона Nebensätze - temporal
Nebensätze - temporal