Содержание
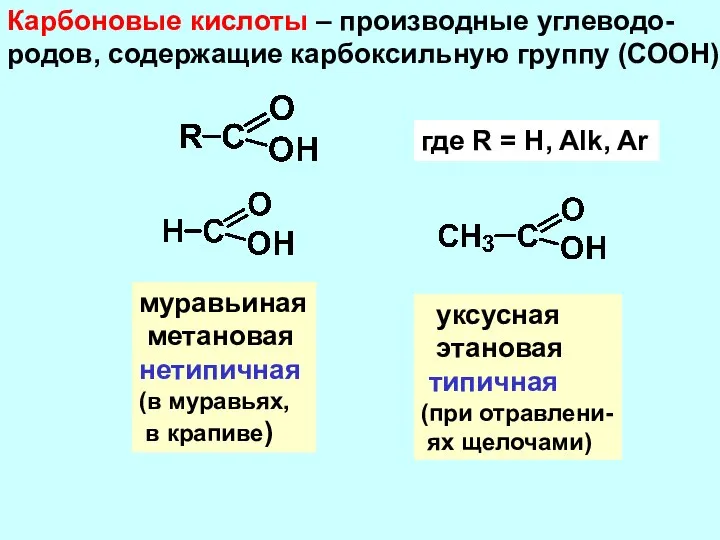
- 2. Карбоновые кислоты – производные углеводо- родов, содержащие карбоксильную группу (СООН) где R = H, Alk, Ar
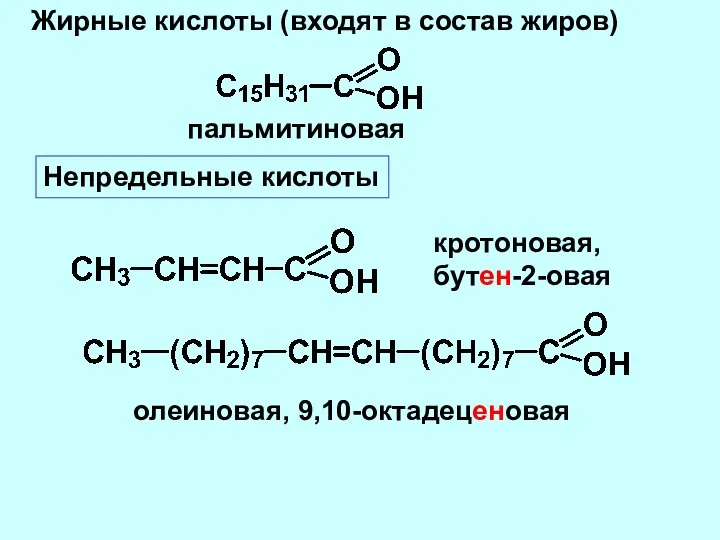
- 3. Жирные кислоты (входят в состав жиров) пальмитиновая Непредельные кислоты кротоновая, бутен-2-овая олеиновая, 9,10-октадеценовая
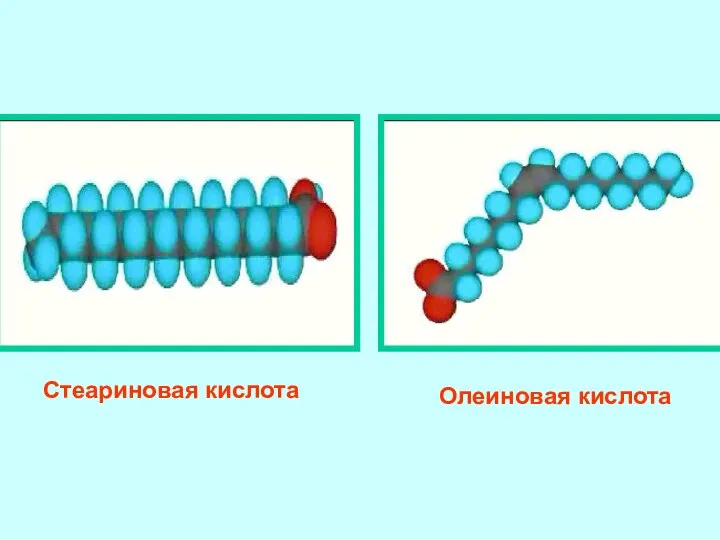
- 4. Стеариновая кислота Олеиновая кислота
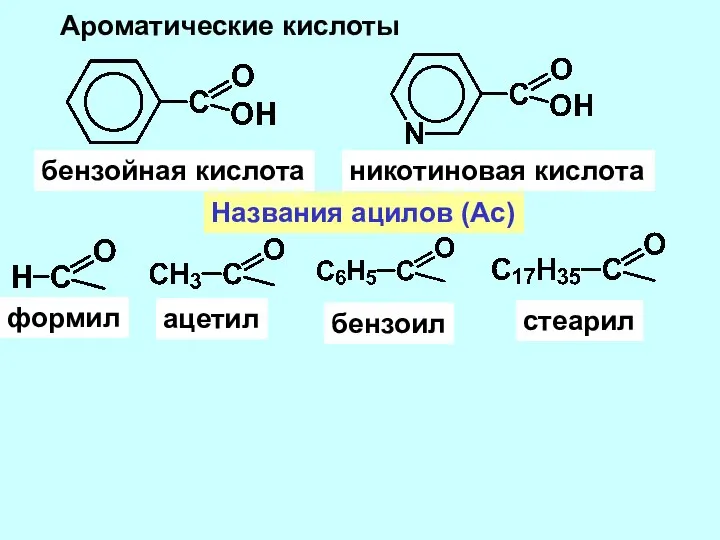
- 5. Ароматические кислоты бензойная кислота никотиновая кислота Названия ацилов (Ac) формил ацетил бензоил стеарил
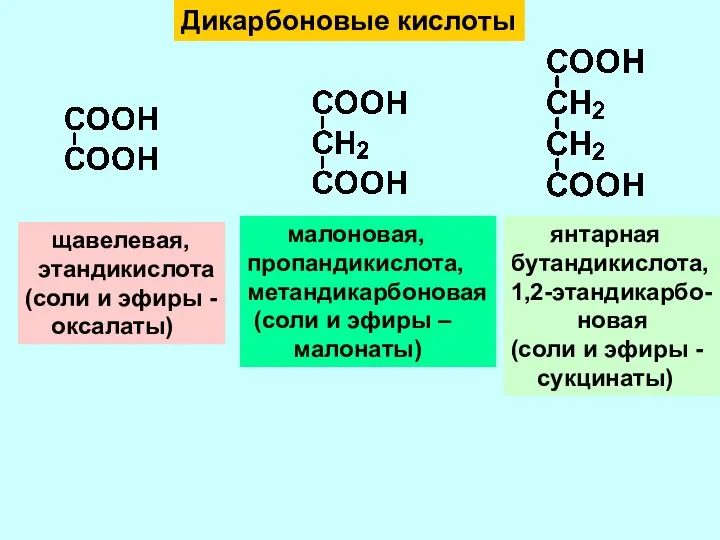
- 6. Дикарбоновые кислоты щавелевая, этандикислота (соли и эфиры - оксалаты) малоновая, пропандикислота, метандикарбоновая (соли и эфиры –
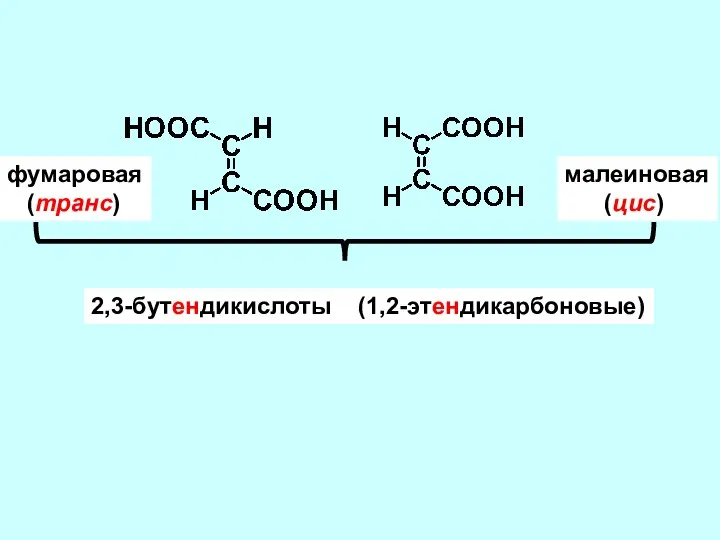
- 7. фумаровая (транс) малеиновая (цис) 2,3-бутендикислоты (1,2-этендикарбоновые)
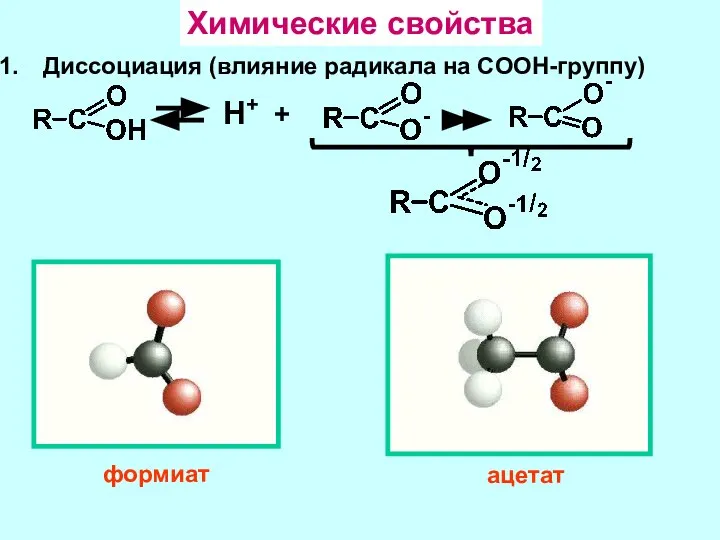
- 8. Химические свойства Диссоциация (влияние радикала на COOH-группу) Н+ + формиат ацетат
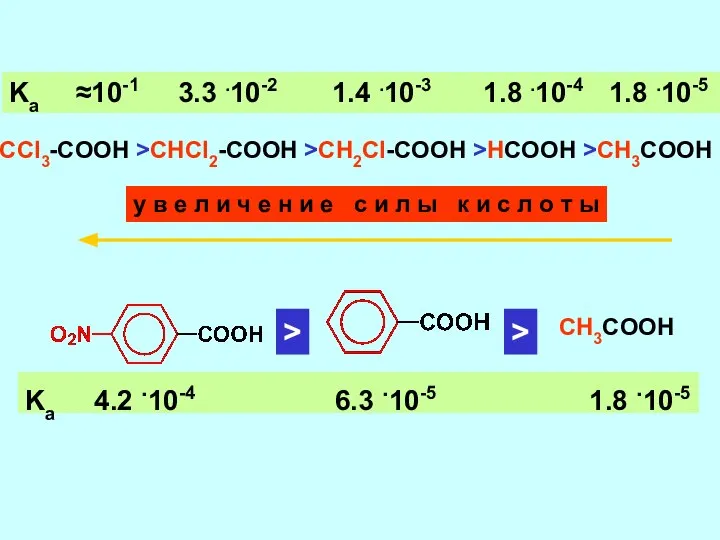
- 9. CCl3-COOH >CHCl2-COOH >CH2Cl-COOH >HCOOH >CH3COOH Ka ≈10-1 3.3 .10-2 1.4 .10-3 1.8 .10-4 1.8 .10-5 CH3COOH
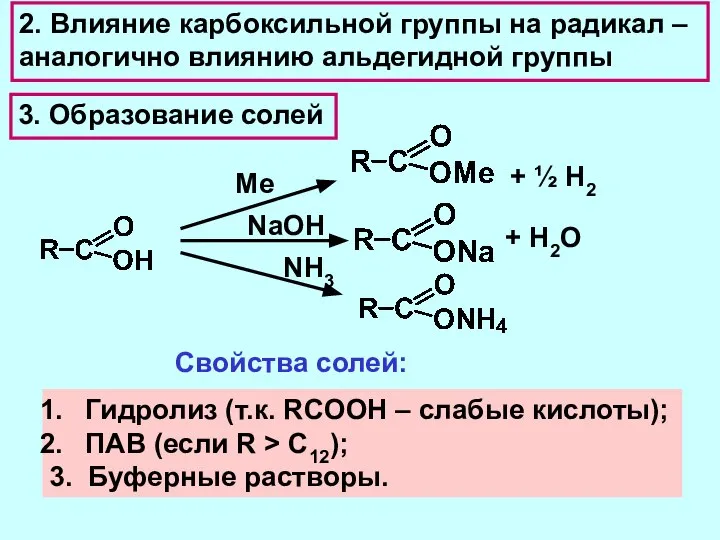
- 10. 3. Образование солей Ме + ½ Н2 NaOH + Н2O NH3 Cвойства солей: Гидролиз (т.к. RCOOH
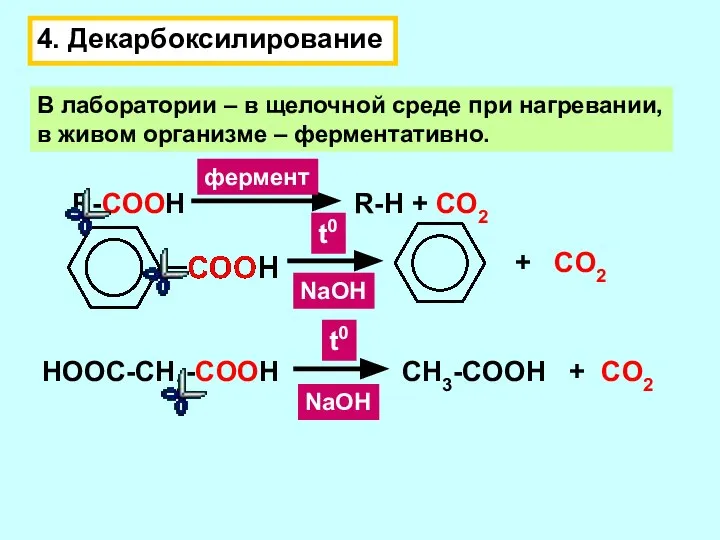
- 11. 4. Декарбоксилирование В лаборатории – в щелочной среде при нагревании, в живом организме – ферментативно. R-COOH
- 12. 5. Окислительно-восстановительные реакции а) восстановление 1. R-COOH [H] кат. R-CH=О [H] кат. R-CH2ОН 2. R-COOH +
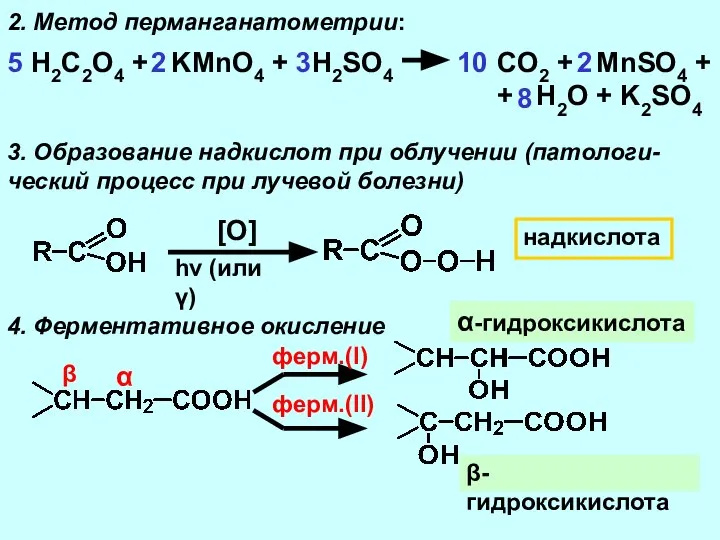
- 13. H2C2O4 + KMnO4 + H2SO4 CO2 + MnSO4 + + H2O + K2SO4 5 2. Метод
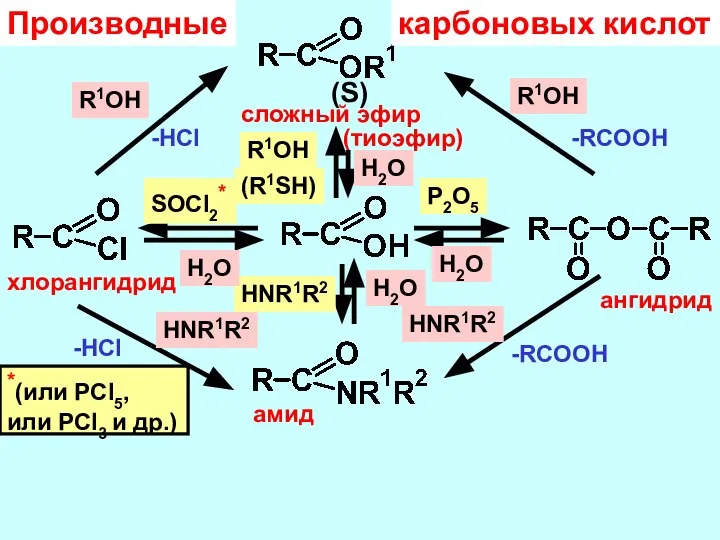
- 14. SOCl2* хлорангидрид P2O5 ангидрид R1OH сложный эфир HNR1R2 амид R1OH -HCl H2O HNR1R2 (R1SH) (S) (тиоэфир)
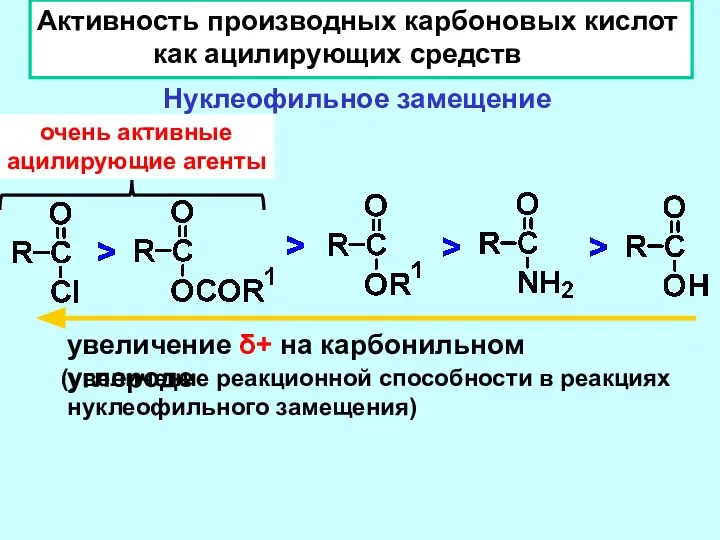
- 15. Активность производных карбоновых кислот как ацилирующих средств Нуклеофильное замещение увеличение δ+ на карбонильном углероде (увеличение реакционной
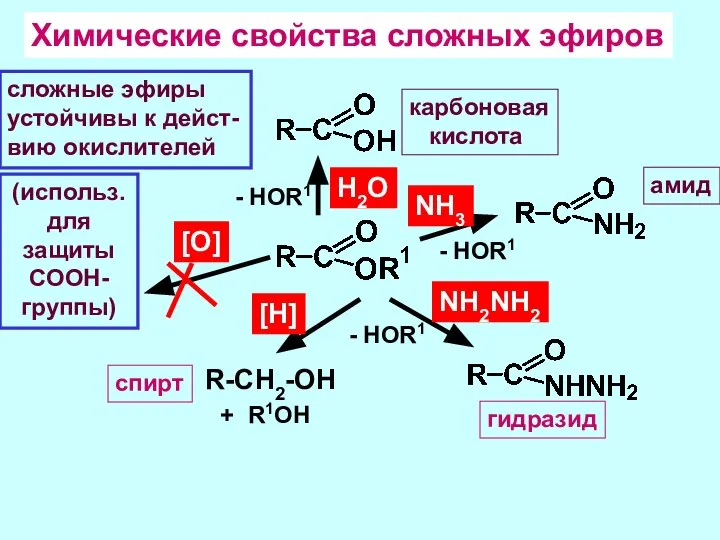
- 16. Химические свойства сложных эфиров Н2О - HOR1 NН3 - HOR1 карбоновая кислота амид NН2NH2 - HOR1
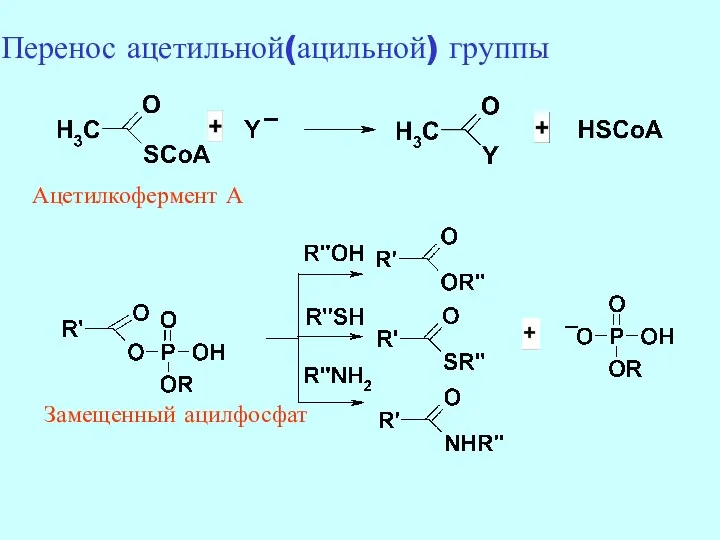
- 17. Замещенный ацилфосфат Ацетилкофермент А Перенос ацетильной(ацильной) группы
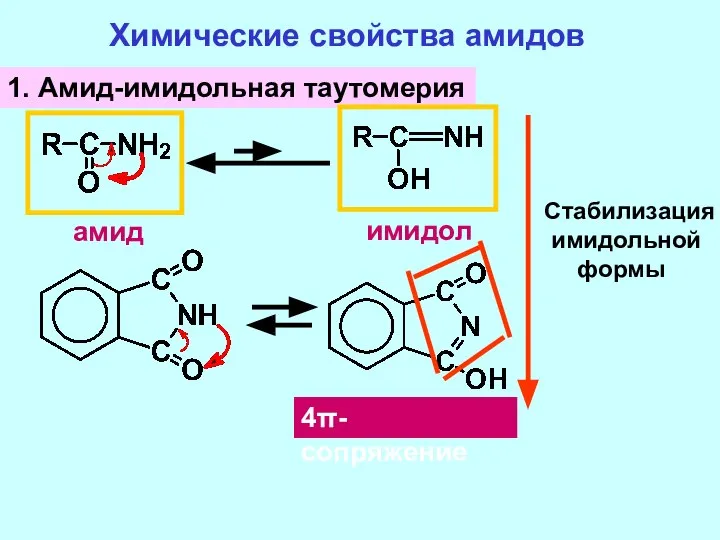
- 18. Химические свойства амидов 1. Амид-имидольная таутомерия амид имидол 4π-сопряжение Стабилизация имидольной формы
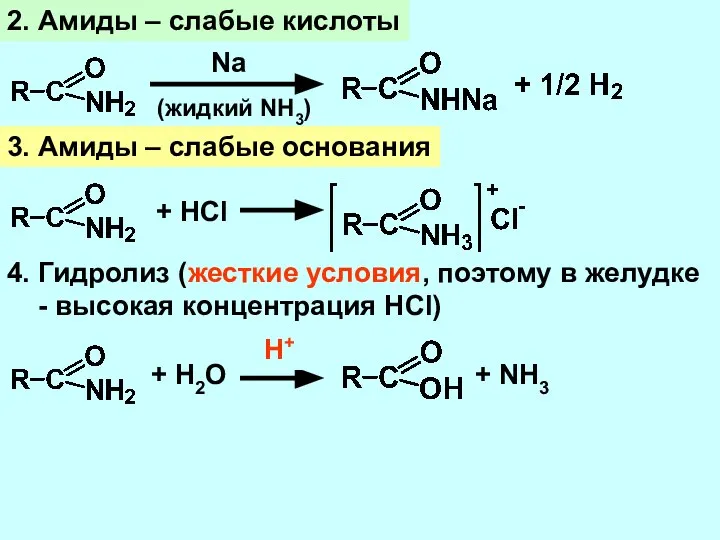
- 19. 2. Амиды – слабые кислоты Na (жидкий NH3) 3. Амиды – слабые основания + HCl 4.
- 21. Скачать презентацию
![5. Окислительно-восстановительные реакции а) восстановление 1. R-COOH [H] кат. R-CH=О [H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300358/slide-11.jpg)
 ТМ для Горизонта. Как всё и везде успеть
ТМ для Горизонта. Как всё и везде успеть С-строка. Размер. Инициализация
С-строка. Размер. Инициализация Алишер Усманов
Алишер Усманов Заболевания ,обусловленные материалами зубных протезов.Этиология патогенез клиника диагностика лечение и профилактика
Заболевания ,обусловленные материалами зубных протезов.Этиология патогенез клиника диагностика лечение и профилактика Общие сведения о производстве сборных железобетонных изделий
Общие сведения о производстве сборных железобетонных изделий Нивелирование
Нивелирование Свято Миколая!
Свято Миколая! Город как среда обитания
Город как среда обитания Определяющие факторы
Определяющие факторы Археологія. Коли речі починають говорити
Археологія. Коли речі починають говорити Оценка конкурентоспособности организации и ее продукта Тема 5
Оценка конкурентоспособности организации и ее продукта Тема 5  Искусство Новгородских земель XI-XIII вв. Пригороды Великого Новгорода. Антониев монастырь
Искусство Новгородских земель XI-XIII вв. Пригороды Великого Новгорода. Антониев монастырь Язык программирования «Python»
Язык программирования «Python» Аппаратные средства персональных компьютеров
Аппаратные средства персональных компьютеров БЖД (безопасность жизнедеятельности)
БЖД (безопасность жизнедеятельности) Правовое, социальное и светское государство. Тема 5
Правовое, социальное и светское государство. Тема 5 Веб-технологии в промышленности и образовании. Назначение и применение JavaScript, общие сведения. (Лекция 16)
Веб-технологии в промышленности и образовании. Назначение и применение JavaScript, общие сведения. (Лекция 16) Эпоха возрождения XIV-XVI вв
Эпоха возрождения XIV-XVI вв Презентация "ГРАФФИТИ" - скачать презентации по МХК
Презентация "ГРАФФИТИ" - скачать презентации по МХК Типы данных (Pascal)
Типы данных (Pascal) Гимнастические упражнения как основной способ профилактики заболеваний у детей школьного возраста (11-13 лет)
Гимнастические упражнения как основной способ профилактики заболеваний у детей школьного возраста (11-13 лет) Былинный герой Илья Муромец
Былинный герой Илья Муромец Животные которые вымерли Работу выполнял «Брехов Михаил»
Животные которые вымерли Работу выполнял «Брехов Михаил»  Графики Внеурочная деятельность по математике при подготовки к итоговой аттестации в 9 классе.
Графики Внеурочная деятельность по математике при подготовки к итоговой аттестации в 9 классе.  Презентация на тему "Реклама" - скачать презентации по Медицине
Презентация на тему "Реклама" - скачать презентации по Медицине АНДРЕЙ РУБЛЕВ
АНДРЕЙ РУБЛЕВ Действия сотрудников ОВД при обнаружении взрывных устройств
Действия сотрудников ОВД при обнаружении взрывных устройств Крещение - первое и важнейшее христианское таинство
Крещение - первое и важнейшее христианское таинство