Содержание
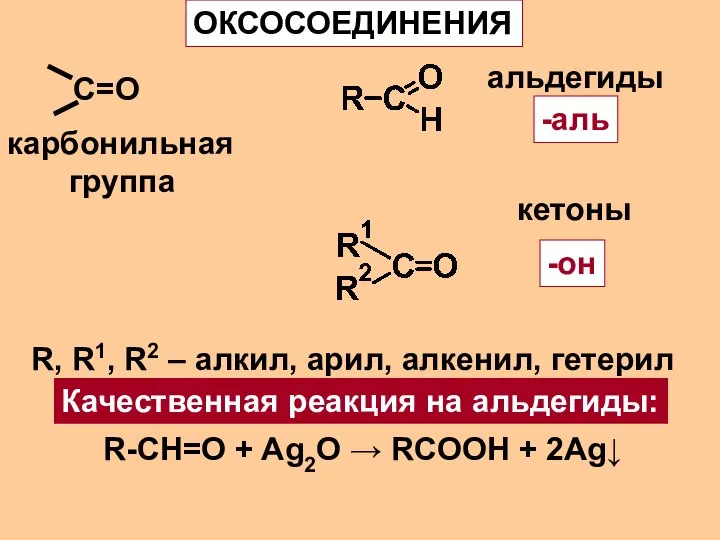
- 2. С=О ОКСОСОЕДИНЕНИЯ карбонильная группа альдегиды -аль кетоны -он R, R1, R2 – алкил, арил, алкенил, гетерил
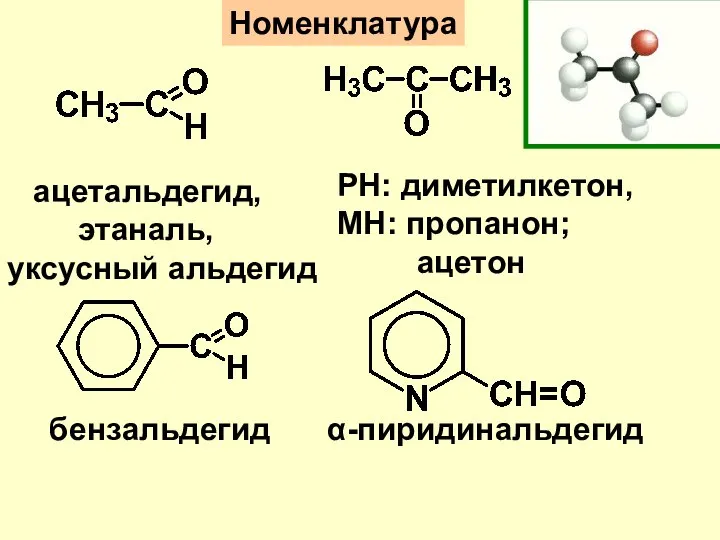
- 3. Номенклатура РН: диметилкетон, МН: пропанон; ацетон ацетальдегид, этаналь, уксусный альдегид бензальдегид α-пиридинальдегид
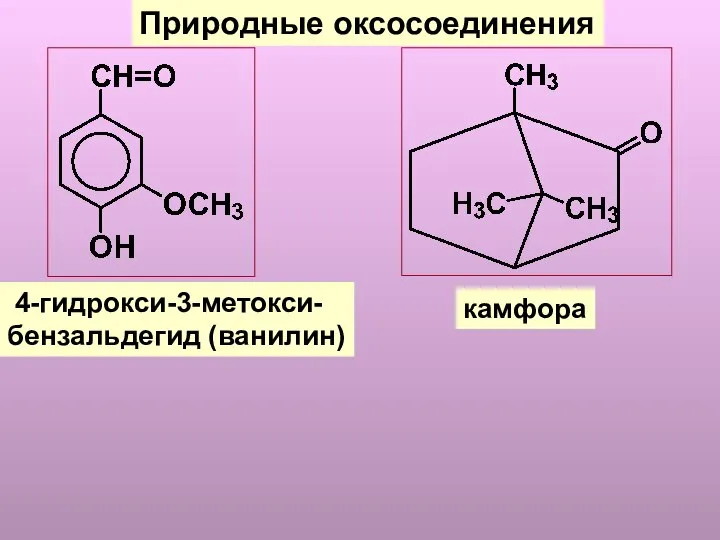
- 4. Природные оксосоединения 4-гидрокси-3-метокси- бензальдегид (ванилин) камфора
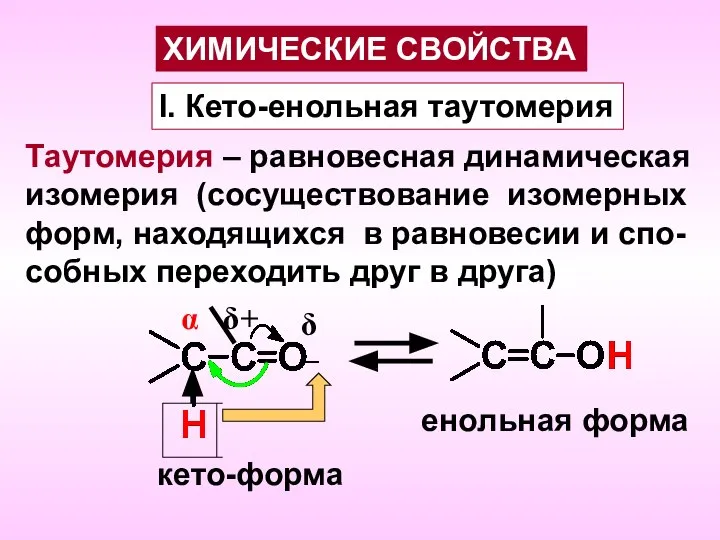
- 5. I. Кето-енольная таутомерия Таутомерия – равновесная динамическая изомерия (сосуществование изомерных форм, находящихся в равновесии и спо-
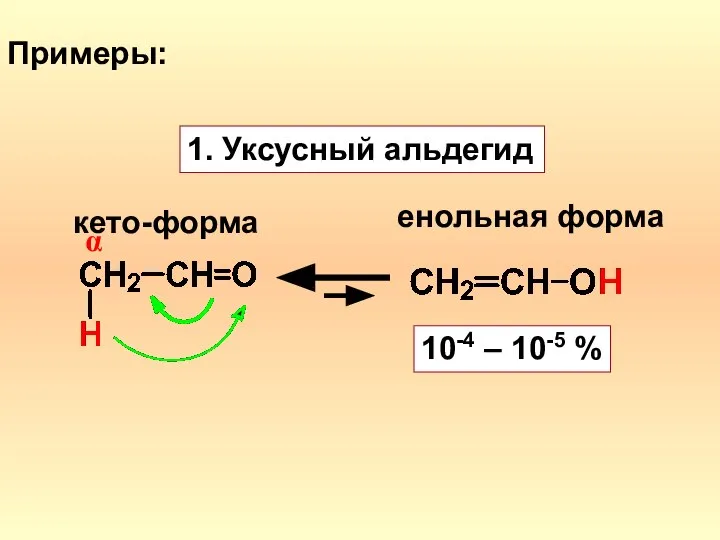
- 6. Примеры: 1. Уксусный альдегид кето-форма енольная форма α 10-4 – 10-5 %
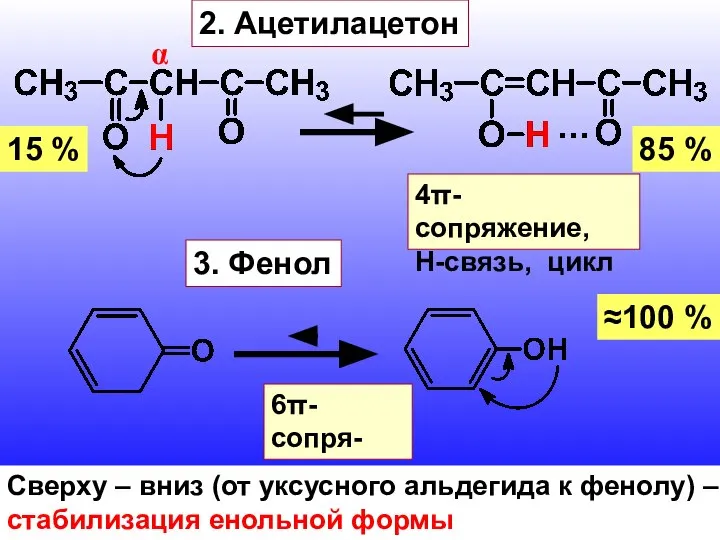
- 7. 2. Ацетилацетон α 15 % 85 % 4π-сопряжение, Н-связь, цикл 3. Фенол ≈100 % 6π-сопря- жение
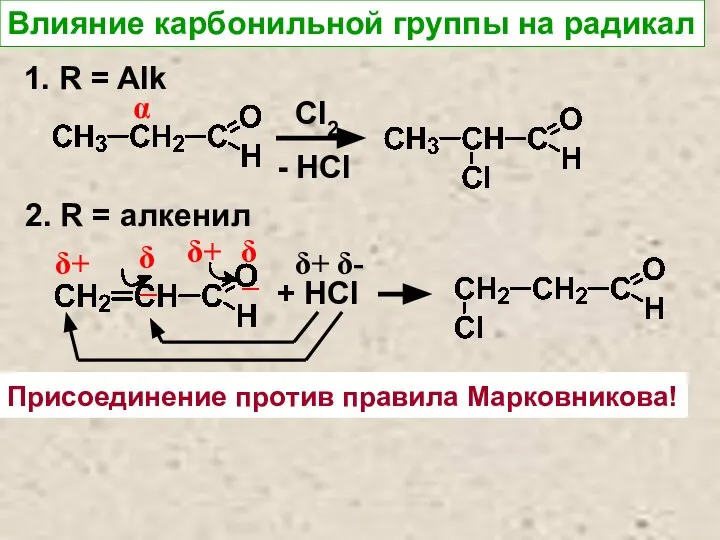
- 8. Влияние карбонильной группы на радикал 1. R = Alk α Cl2 - HCl 2. R =
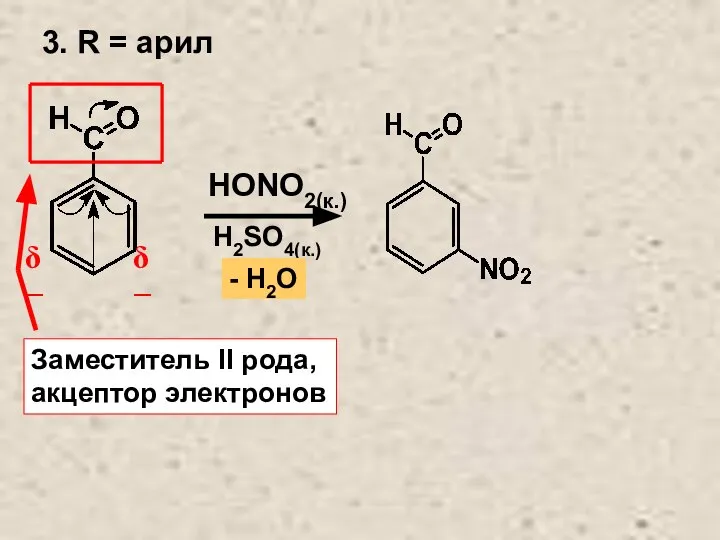
- 9. 3. R = арил Заместитель II рода, акцептор электронов HONO2(к.) H2SO4(к.) - Н2О δ− δ−
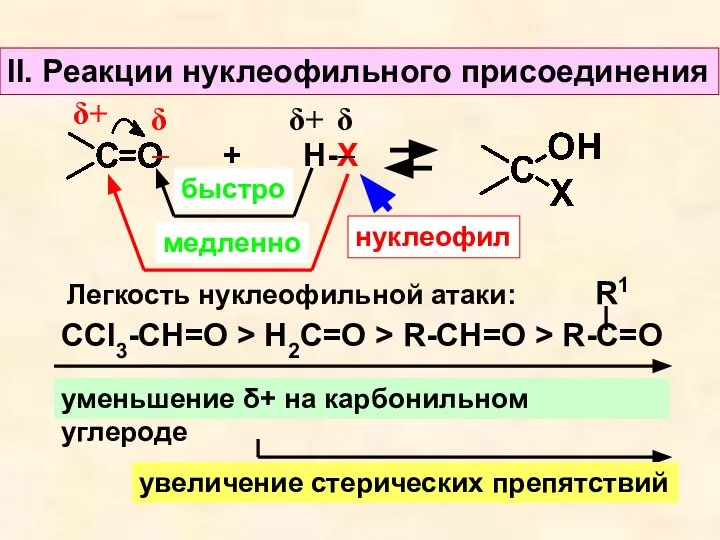
- 10. II. Реакции нуклеофильного присоединения δ− δ+ + Н-Х δ+ δ− быстро медленно нуклеофил Легкость нуклеофильной атаки:
- 11. 1. Гидрирование (присоединение гидридов Me) CH3CH=O альдегид [Н] СН3СН2ОН первичный спирт кетон [Н] LiAlH4 LiAlH4 вторичный
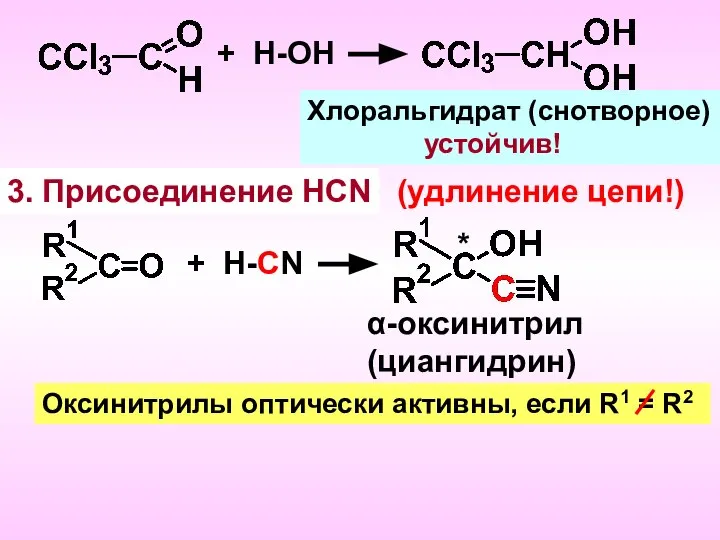
- 12. + Н-ОН Хлоральгидрат (снотворное) устойчив! 3. Присоединение HCN + Н-CN α-оксинитрил (циангидрин) (удлинение цепи!) Оксинитрилы оптически
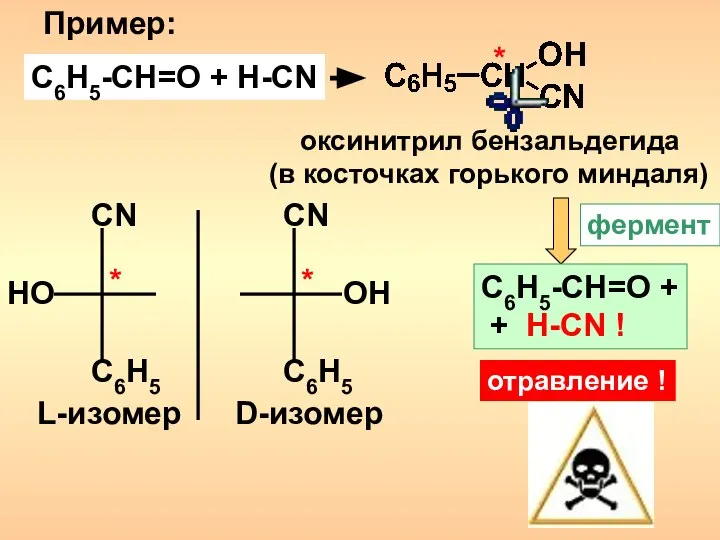
- 13. Пример: C6H5-CH=O + H-CN * оксинитрил бензальдегида (в косточках горького миндаля) C6H5 C6H5 CN CN OH
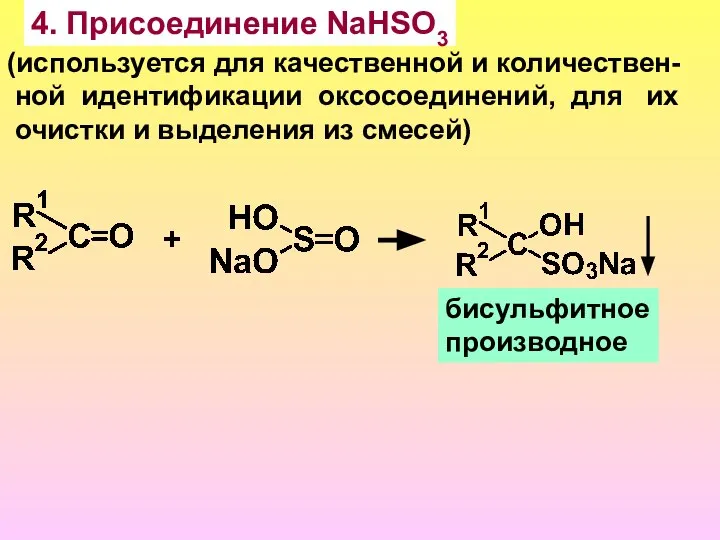
- 14. 4. Присоединение NaHSO3 (используется для качественной и количествен- ной идентификации оксосоединений, для их очистки и выделения
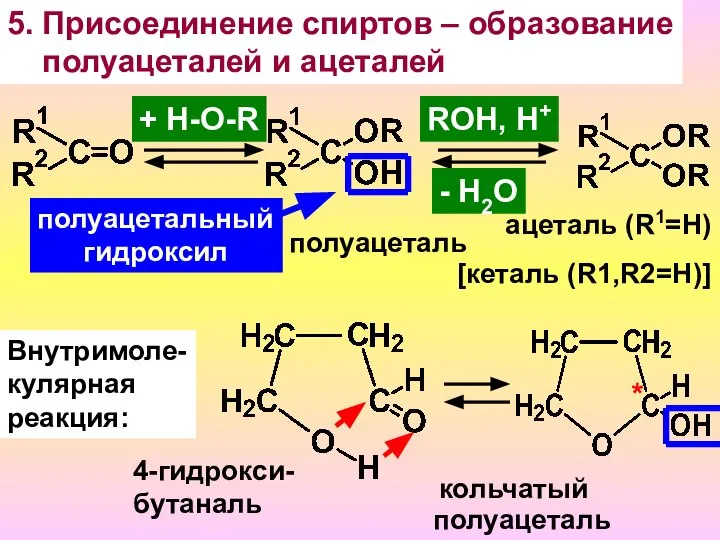
- 15. 5. Присоединение спиртов – образование полуацеталей и ацеталей + H-O-R ROH, H+ - H2O полуацеталь aцеталь
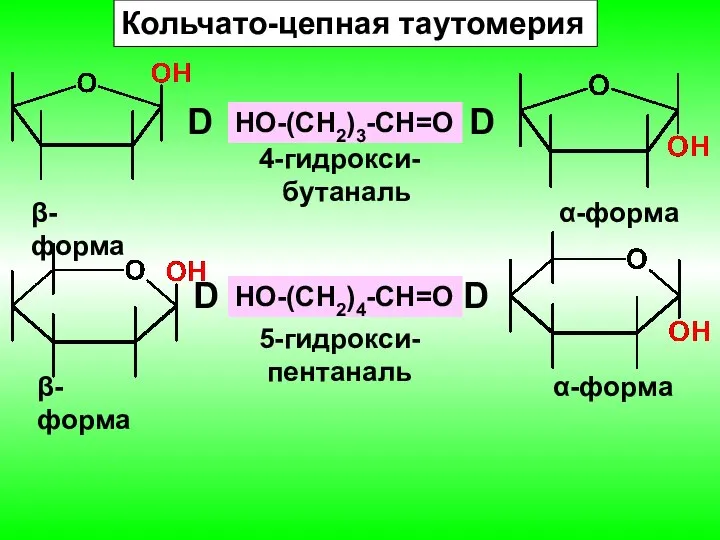
- 16. Кольчато-цепная таутомерия HO-(CH2)3-CH=O 4-гидрокси- бутаналь D D β-форма α-форма HO-(CH2)4-CH=O 5-гидрокси- пентаналь D D β-форма α-форма
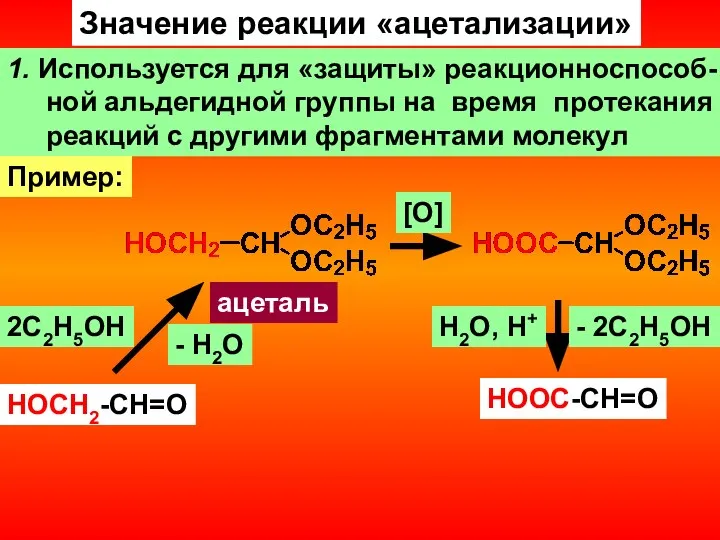
- 17. Значение реакции «ацетализации» 1. Используется для «защиты» реакционноспособ- ной альдегидной группы на время протекания реакций с
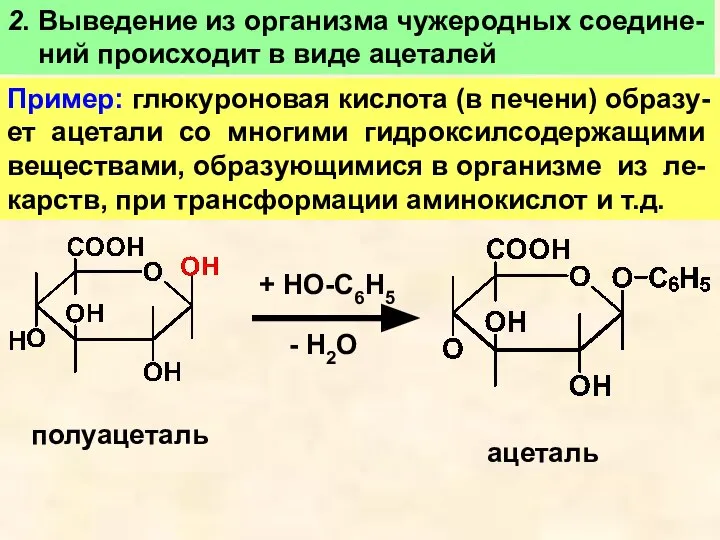
- 18. 2. Выведение из организма чужеродных соедине- ний происходит в виде ацеталей Пример: глюкуроновая кислота (в печени)
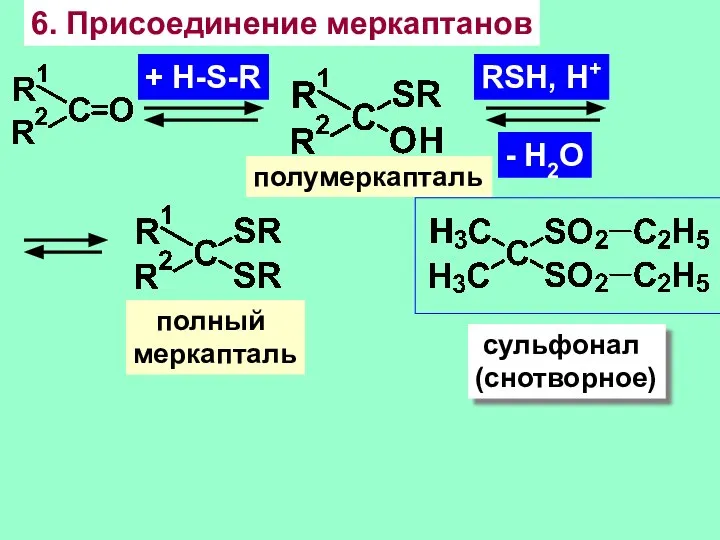
- 19. 6. Присоединение меркаптанов + H-S-R полумеркапталь RSH, H+ - H2O полный меркапталь сульфонал (снотворное)
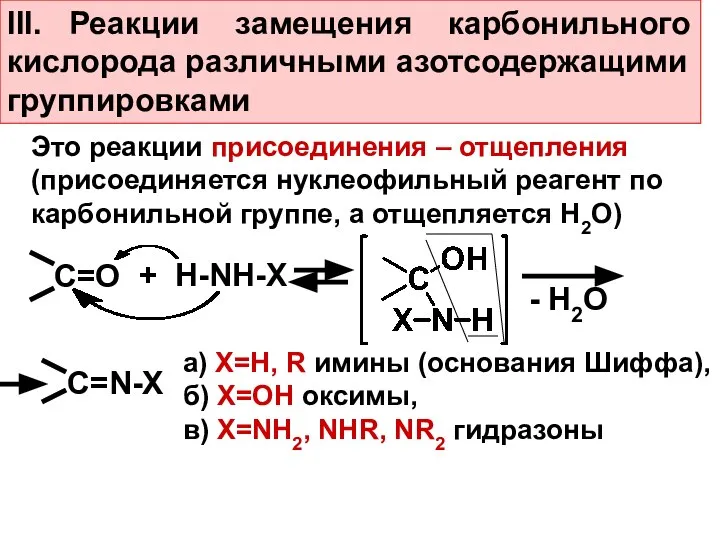
- 20. III. Реакции замещения карбонильного кислорода различными азотсодержащими группировками Это реакции присоединения – отщепления (присоединяется нуклеофильный реагент
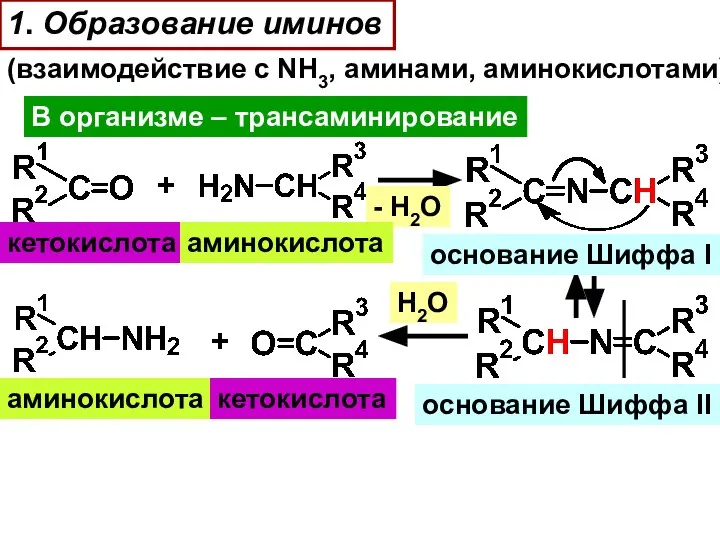
- 21. 1. Образование иминов (взаимодействие с NH3, аминами, аминокислотами) В организме – трансаминирование + - H2O кетокислота
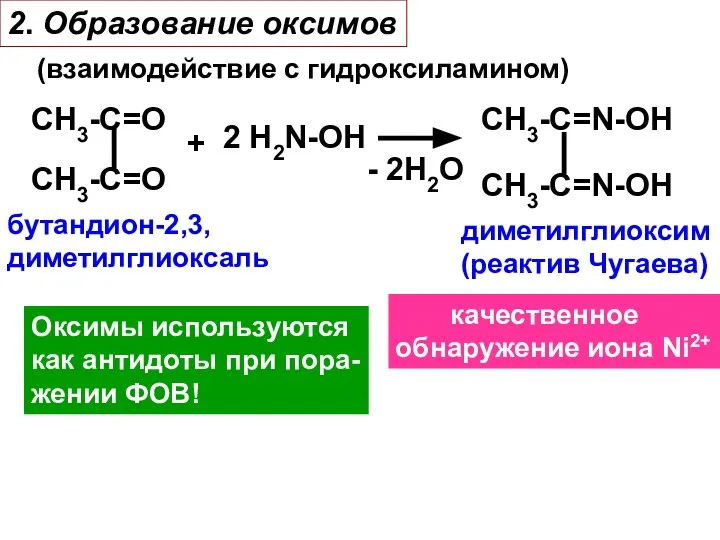
- 22. 2. Образование оксимов (взаимодействие с гидроксиламином) СH3-C=O СH3-C=O + 2 H2N-OH - 2H2O СH3-C=N-OH СH3-C=N-OH бутандион-2,3,
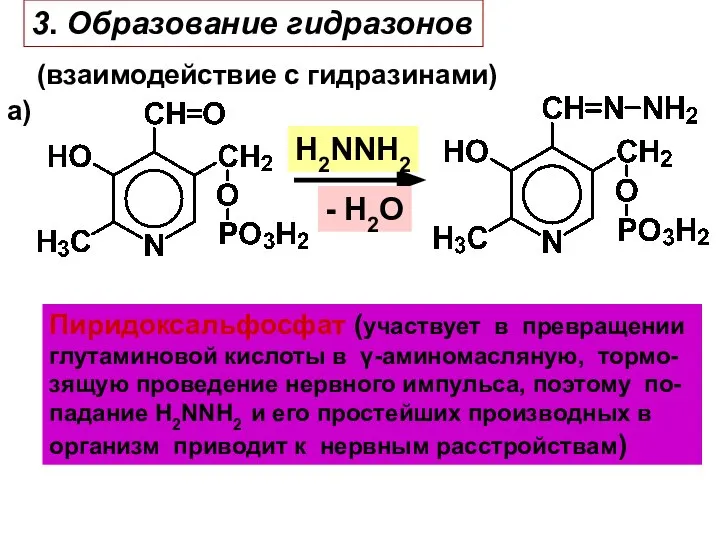
- 23. 3. Образование гидразонов (взаимодействие с гидразинами) а) Пиридоксальфосфат (участвует в превращении глутаминовой кислоты в γ-аминомасляную, тормо-
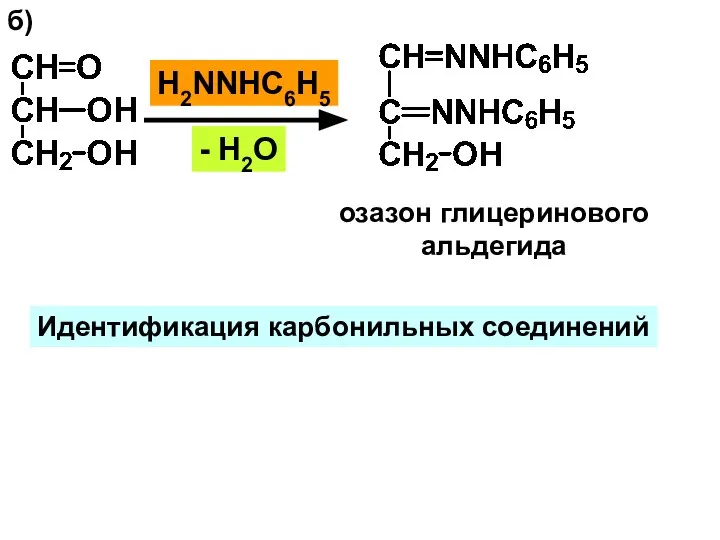
- 24. б) H2NNHС6Н5 - H2O озазон глицеринового альдегида Идентификация карбонильных соединений
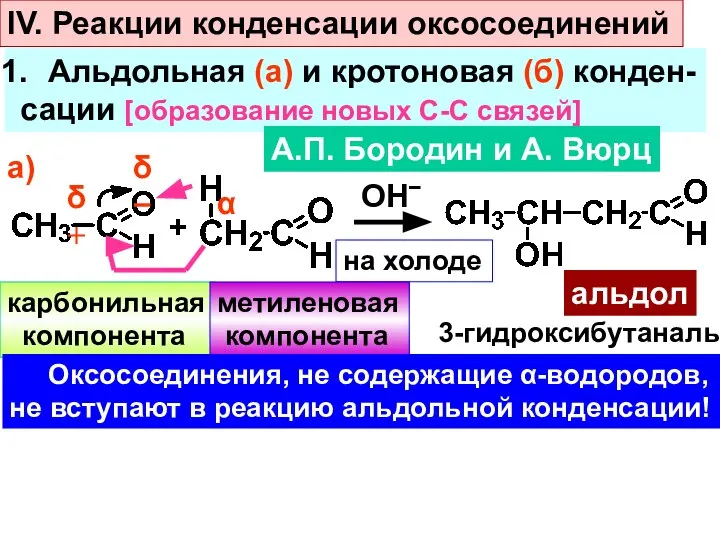
- 25. IV. Реакции конденсации оксосоединений Альдольная (а) и кротоновая (б) конден- сации [образование новых С-С связей] А.П.
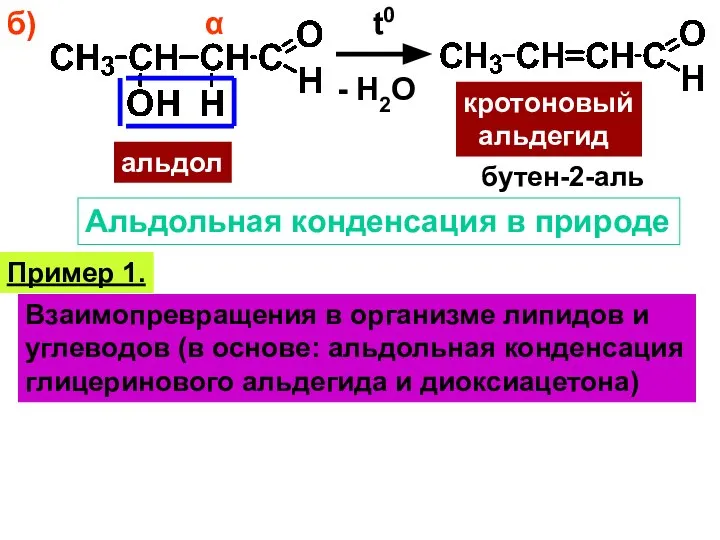
- 26. б) α t0 альдол - H2O кротоновый альдегид бутен-2-аль Альдольная конденсация в природе Пример 1. Взаимопревращения
- 27. + [O] [H] α липиды глицерино- вый альдегид диокси- ацетон фруктоза углеводы карбонильная компонента метиленовая компонента
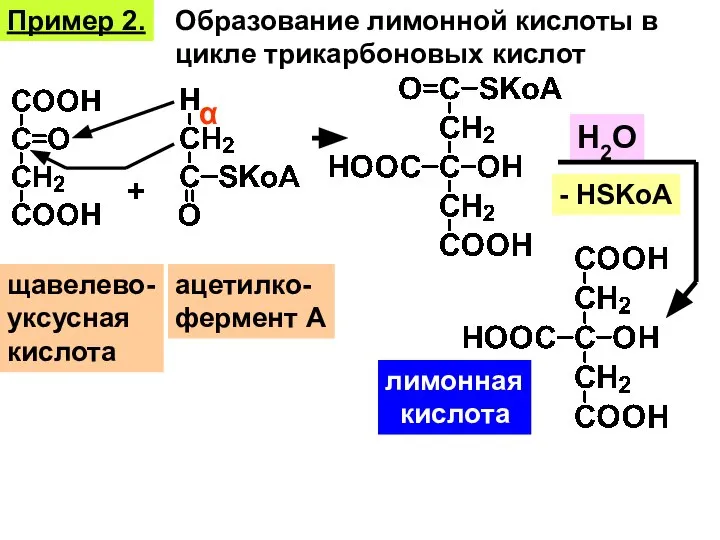
- 28. Пример 2. щавелево- уксусная кислота + α ацетилко- фермент А Образование лимонной кислоты в цикле трикарбоновых
- 29. 2. Реакция Канниццаро (1853 г.) - Тищенко (1906 г.) [реакция диспропорционирования] R-CH=O R-CH2ОН альдегид спирт R-CООН
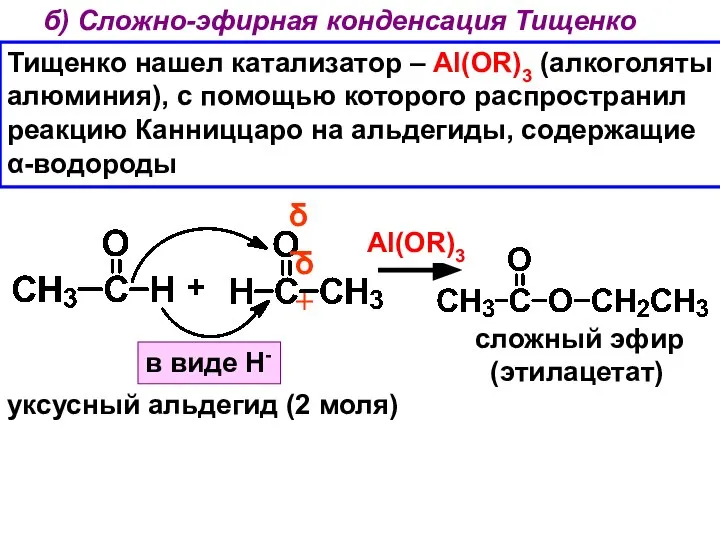
- 30. б) Сложно-эфирная конденсация Тищенко Тищенко нашел катализатор – Al(OR)3 (алкоголяты алюминия), с помощью которого распространил реакцию
- 31. V. Реакции полимеризации оксосоединений а) полимеры на основе формальдегида СН2=О ОН- 6 моль С6Н12О6 гексоза (А.М.Бутлеров)
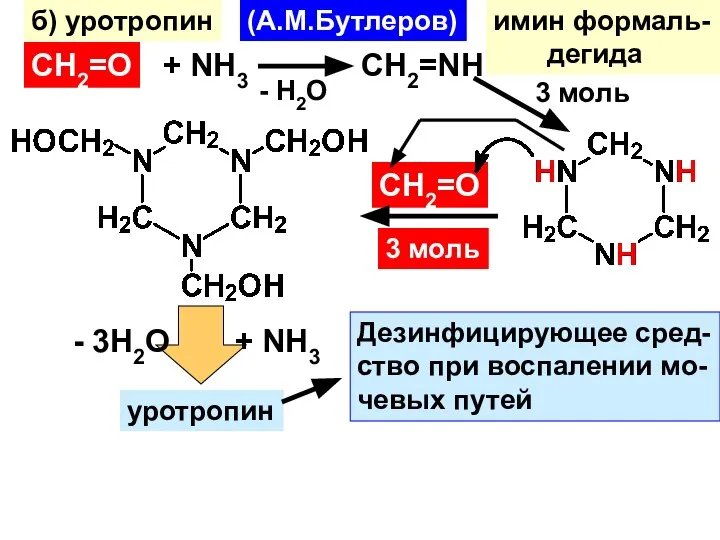
- 32. б) уротропин (А.М.Бутлеров) СН2=О + NH3 - H2O CH2=NH имин формаль- дегида 3 моль СН2=О 3
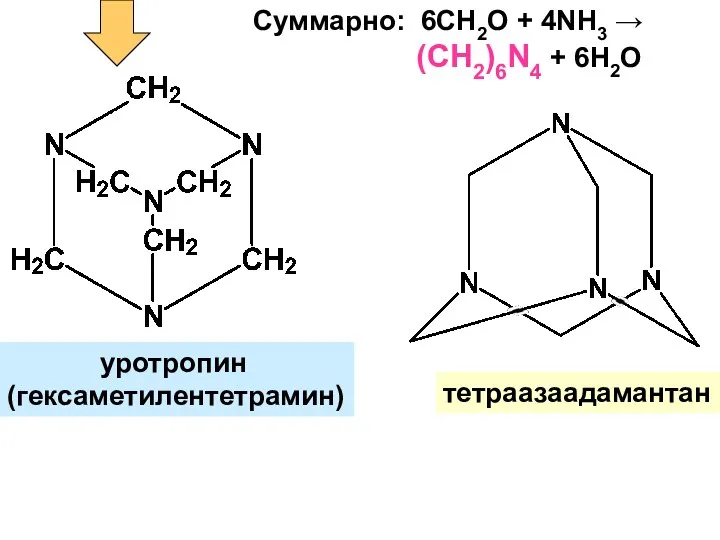
- 33. уротропин (гексаметилентетрамин) тетраазаадамантан Суммарно: 6СН2О + 4NH3 → (CH2)6N4 + 6H2O
- 35. Скачать презентацию
![1. Гидрирование (присоединение гидридов Me) CH3CH=O альдегид [Н] СН3СН2ОН первичный спирт](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300357/slide-10.jpg)
![+ [O] [H] α липиды глицерино- вый альдегид диокси- ацетон фруктоза](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300357/slide-26.jpg)
![2. Реакция Канниццаро (1853 г.) - Тищенко (1906 г.) [реакция диспропорционирования]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300357/slide-28.jpg)

 Забота родителей и школы о здоровье младших подростков
Забота родителей и школы о здоровье младших подростков Управление e-learning проектом Тихомирова Елена Владимировна www.e-learningcenter.ru. - презентация
Управление e-learning проектом Тихомирова Елена Владимировна www.e-learningcenter.ru. - презентация Гостиничное дело. Основные службы гостиничного предприятия
Гостиничное дело. Основные службы гостиничного предприятия Изменение объема сердца в разные фазы его деятельности
Изменение объема сердца в разные фазы его деятельности Управление и организация монтажа холодильного оборудования в супермаркете
Управление и организация монтажа холодильного оборудования в супермаркете Основные направления в психологии
Основные направления в психологии Презентация "Проектирование системы управления предприятием" - скачать презентации по Экономике
Презентация "Проектирование системы управления предприятием" - скачать презентации по Экономике Народный праздник Масленица
Народный праздник Масленица Падежные окончания существительных
Падежные окончания существительных Презентация "Искусство" - скачать презентации по МХК
Презентация "Искусство" - скачать презентации по МХК Продажи гостиничного продукта на примере гостиницы «Центральная»
Продажи гостиничного продукта на примере гостиницы «Центральная» Модели каналов передачи данных
Модели каналов передачи данных Лечение о.аппендицита
Лечение о.аппендицита  Индивидуальные программы корпоративного страхования. - презентация
Индивидуальные программы корпоративного страхования. - презентация БЮДЖЕТИРОВАНИЕ ЗДРАВООХРАНЕНИЯ, ОРИЕНТИРОВАННОЕ НА РЕЗУЛЬТАТ доктор медицинских наук, профессор Флек Виталий Олегович
БЮДЖЕТИРОВАНИЕ ЗДРАВООХРАНЕНИЯ, ОРИЕНТИРОВАННОЕ НА РЕЗУЛЬТАТ доктор медицинских наук, профессор Флек Виталий Олегович Величаю Тебе, Боже, величаю
Величаю Тебе, Боже, величаю Принципы физического воспитания. Условия здорового образа жизни
Принципы физического воспитания. Условия здорового образа жизни Гражданское общество и правовое государство
Гражданское общество и правовое государство Элементы и соединения. Узлы Ферм. Лекция 9
Элементы и соединения. Узлы Ферм. Лекция 9 Юридические основы работы врача
Юридические основы работы врача 你知道四级的答题顺序吗
你知道四级的答题顺序吗 Знакомство с буквой З ,з Учитель: Пуговкина Елена Анатольевна Средняя общеобразовательная школа №7 города Ртищево Саратовской
Знакомство с буквой З ,з Учитель: Пуговкина Елена Анатольевна Средняя общеобразовательная школа №7 города Ртищево Саратовской  Лингво-стилистические особенности жанра: политическое аналитическое интервью
Лингво-стилистические особенности жанра: политическое аналитическое интервью Презентация на тему "ВМА - КТ в диагностике повреждений области лица" - скачать презентации по Медицине
Презентация на тему "ВМА - КТ в диагностике повреждений области лица" - скачать презентации по Медицине Алгоритмы и исполнители
Алгоритмы и исполнители Методика развития гибкости у детей 8-9 лет, занимающихся греко-римской борьбой
Методика развития гибкости у детей 8-9 лет, занимающихся греко-римской борьбой Монотипия – один из удивительных видов изобразительного искусства
Монотипия – один из удивительных видов изобразительного искусства Украшение и реальность. Паутинка. Изобразительная деятельность и художественный труд (2 класс)
Украшение и реальность. Паутинка. Изобразительная деятельность и художественный труд (2 класс)