Содержание
- 2. КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ. ЭЛЕКТРОКИНЕТИЧЕСКИЕ СВОЙСТВА И УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ Лекция №8 Лектор: к.х.н., доцент Иванова Надежда
- 3. Коллоидная химия ‒ … … наука о поверхностных явлениях и дисперсных системах. … наука о коллоидном
- 4. Основные понятия: Дисперсность ‒ мерой её служит удельная поверхность (Sуд). Sуд ‒ площадь раздела фаз, приходящаяся
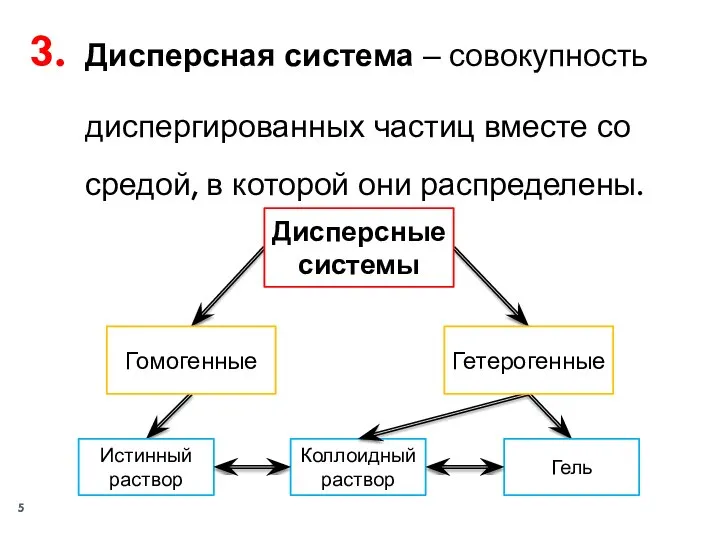
- 5. Дисперсная система ‒ совокупность диспергированных частиц вместе со средой, в которой они распределены. Дисперсные системы Гомогенные
- 6. Дисперсная фаза (ДФ) ‒ совокупность диспергированных частиц, размеры которых больше молекулярных. Дисперсионная среда (ДС) ‒ однородная
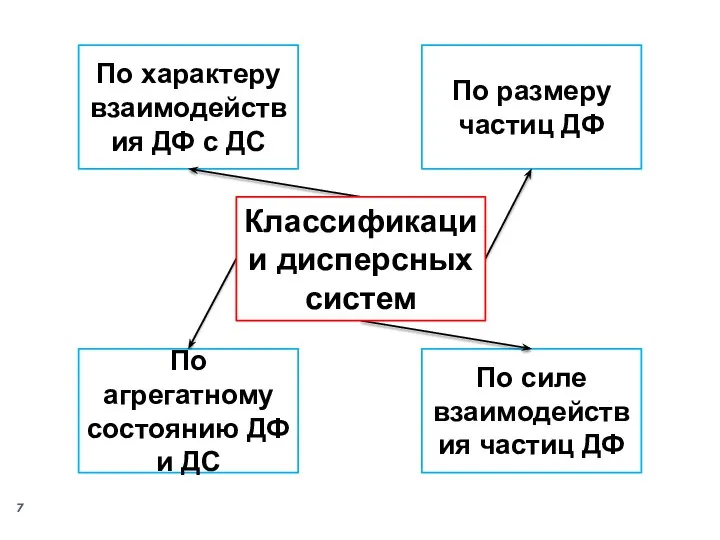
- 7. По размеру частиц ДФ По характеру взаимодействия ДФ с ДС По агрегатному состоянию ДФ и ДС
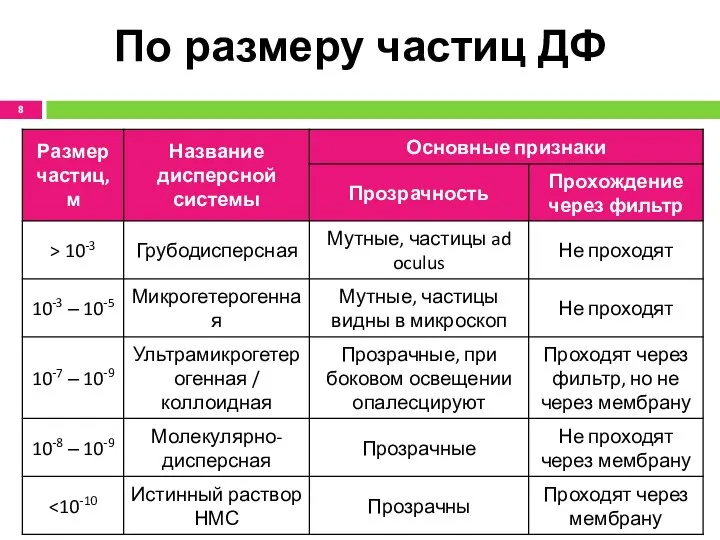
- 8. По размеру частиц ДФ
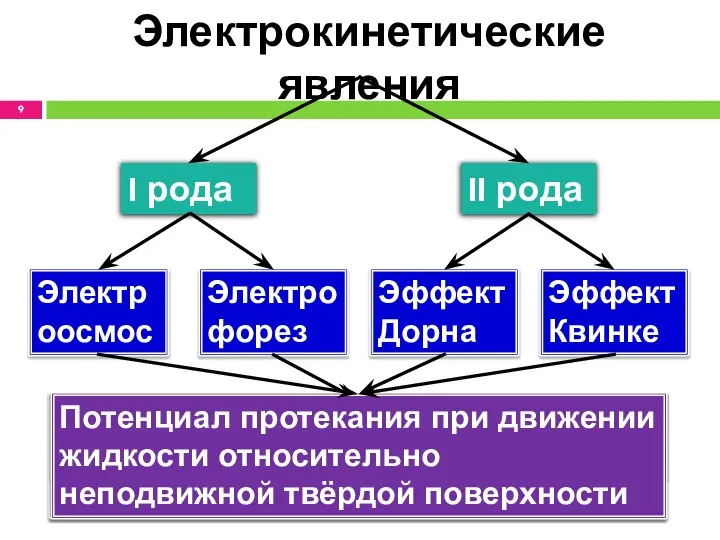
- 9. Электрокинетические явления I рода II рода Электрофорез Электроосмос Эффект Дорна Эффект Квинке Движение частиц ДФ в
- 10. Мицеллярная теория лиофобных золей Мицелла ‒ гетерогенная микросистема, состоящая из микрокристалла ДФ, окружённого сольватированными ионами стабилизатора.
- 11. Мицеллярная теория лиофобных золей – агрегат с адсорбированными на нём потенциалопределяющими ионами (ПОИ). – ионы, сообщающие
- 12. Мицеллярная теория лиофобных золей – ядро с адсорбционным слоем противоионов, являющаяся гигантским многозарядным ионом. Источником ПОИ
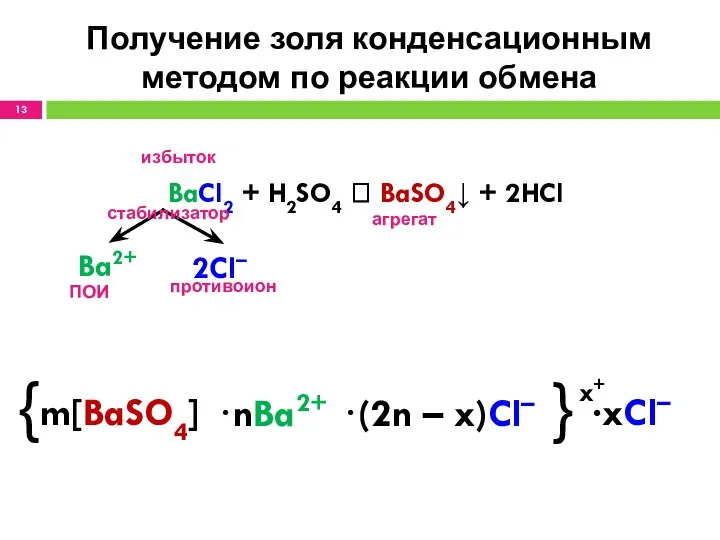
- 13. Получение золя конденсационным методом по реакции обмена BaCl2 + H2SO4 ? BaSO4↓ + 2HCl избыток агрегат
- 14. Мицелла {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl– агрегат адсорбционный слой ядро гранула диффузионный слой
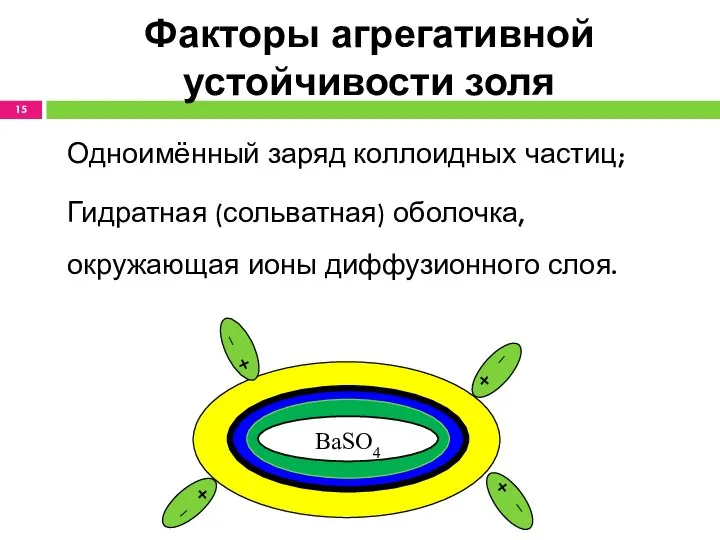
- 15. Факторы агрегативной устойчивости золя Одноимённый заряд коллоидных частиц; Гидратная (сольватная) оболочка, окружающая ионы диффузионного слоя. BaSO4
- 16. Возникновение ДЭС и потенциалов в мицелле {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl– На границе
- 17. Возникновение ДЭС и потенциалов в мицелле По величине 0 ≤ ζ ζкрит. = ±30 мВ. При
- 18. Факторы, влияющие на ζ Концентрация стабилизатора. Состояние ИЭТ золя, ζ = 0. Золь разрушается. Концентрация посторонних
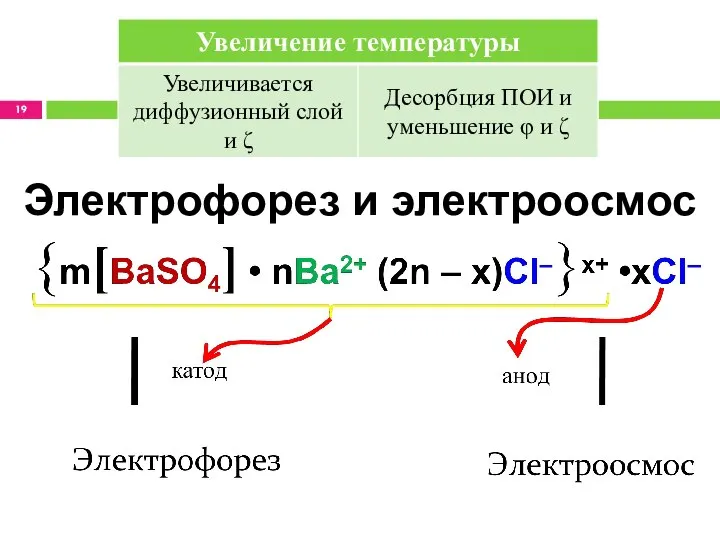
- 19. Электрофорез и электроосмос
- 20. Расчёт ζ Поскольку ζ обнаруживает себя при попадании мицеллы в электрическое поле, для его расчёта используются
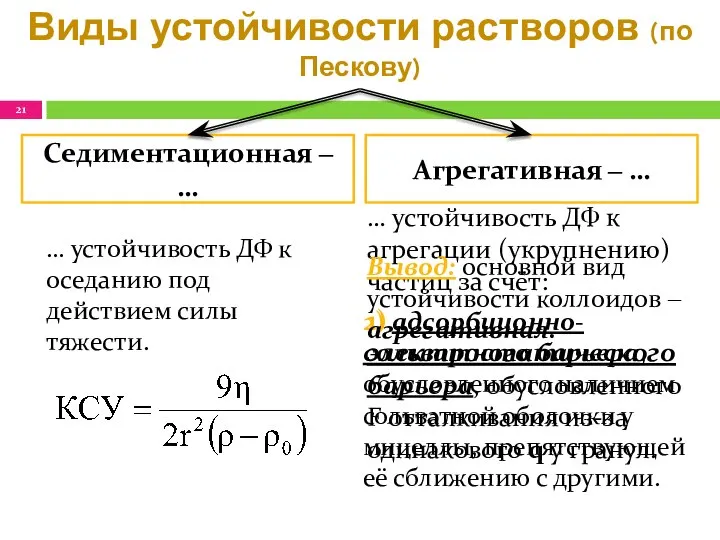
- 21. Виды устойчивости растворов (по Пескову) … устойчивость ДФ к агрегации (укрупнению) частиц за счёт: 1) электростатического
- 22. Коагуляция ‒ … … процесс слипания частиц, образование крупных агрегатов с потерей седиментационной и фазовой устойчивости
- 23. Факторы, вызывающие коагуляцию Увеличение концентрации золя приводит к уменьшению расстояния между частицами, на котором начинают действовать
- 24. Факторы, вызывающие коагуляцию Добавление электролитов наиболее сильное по 2-м причинам: из-за адсорбции ионов электролита на грануле
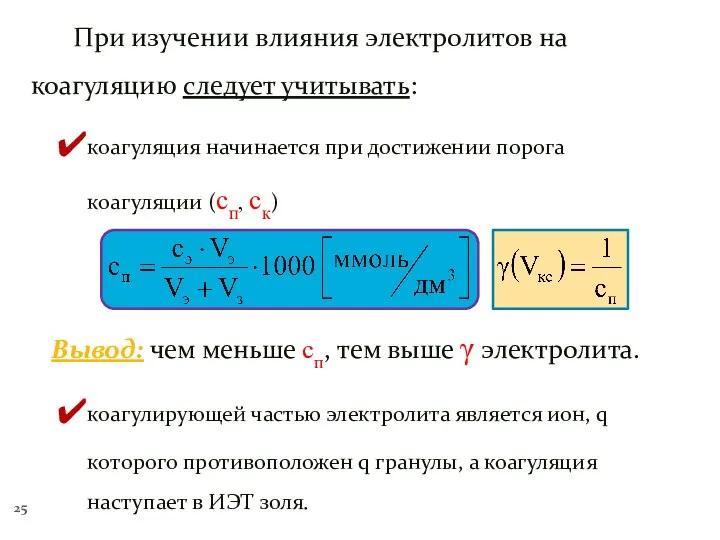
- 25. При изучении влияния электролитов на коагуляцию следует учитывать: коагуляция начинается при достижении порога коагуляции (сп, ск)
- 26. чем выше заряд коагулирующего иона, тем меньше сп и выше γ электролита. Правило Шульце ‒ Гарди
- 27. Правило Дерягина ‒ Ландау … … устанавливает связь между сп и зарядом коагулирующего иона. Теор.: Эксп.:
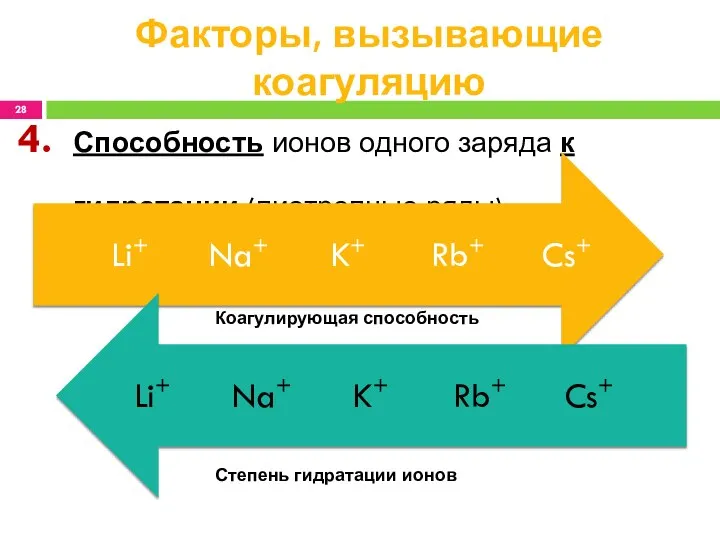
- 28. Способность ионов одного заряда к гидратации (лиотропные ряды) Факторы, вызывающие коагуляцию Коагулирующая способность Степень гидратации ионов
- 29. Факторы, вызывающие коагуляцию «Ионы-партнёры», идущие в паре с коагулирующими ионами, уменьшают их γ в случае адсорбции
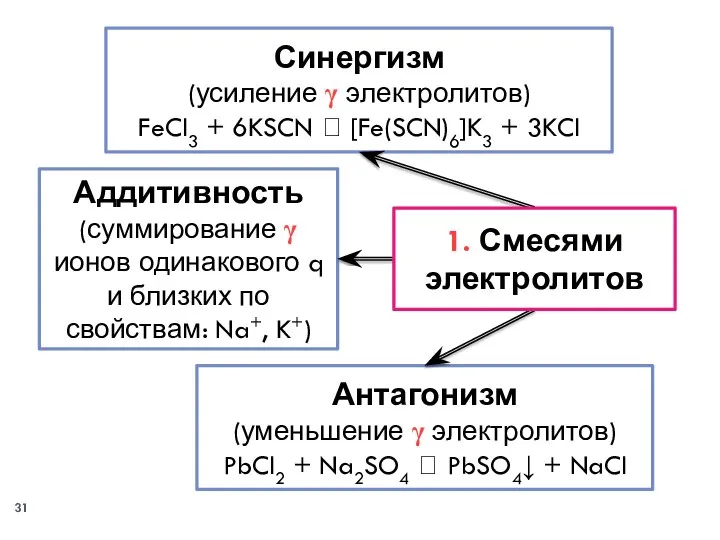
- 30. Смесями электролитов; Многозарядными ионами‒коагуляторами (чередование зон коагуляции); При смешивании коллоидов с гранулами разного по знаку заряда
- 31. Аддитивность (суммирование γ ионов одинакового q и близких по свойствам: Na+, K+) Антагонизм (уменьшение γ электролитов)
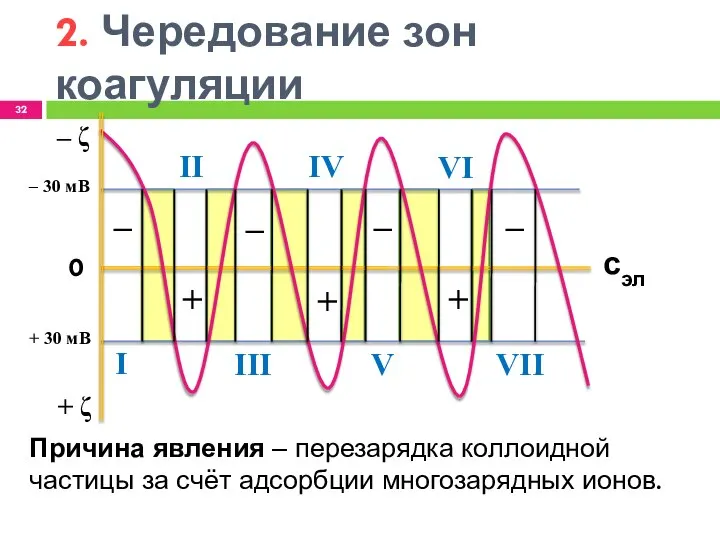
- 32. 2. Чередование зон коагуляции ‒ + + + ‒ ‒ ‒ ‒ ζ + ζ 0
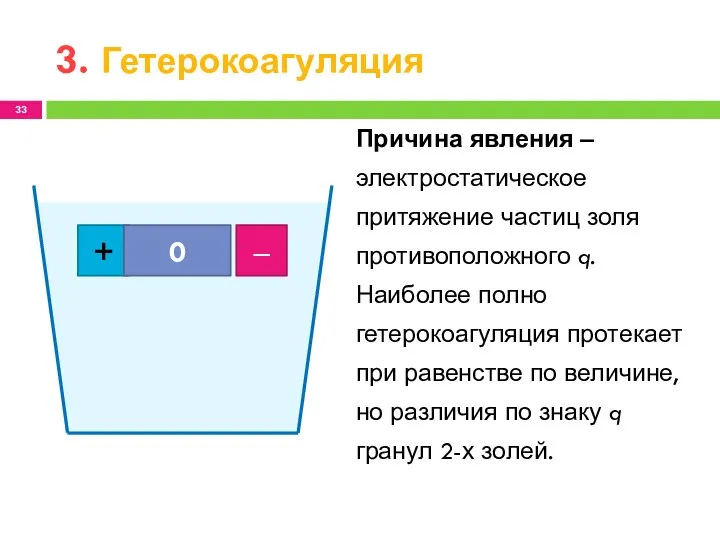
- 33. 3. Гетерокоагуляция + ‒ 0 Причина явления ‒ электростатическое притяжение частиц золя противоположного q. Наиболее полно
- 34. … вызвана добавлением очень малых количеств ВМС и понижает устойчивость коллоидов. … связана с особенностями ВМС:
- 35. Вывод: адсорбционный слой является механическим препятствием для иона ‒ коагулянта. …повышение устойчивости коллоидов добавлением ВМС в
- 36. Защитное число … … min масса ВМС (мг), достаточная для предотвращения 10 см3 гидрозоля от коагулирующего
- 37. Процесс перехода свежевыпавшего при коагуляции осадка во взвешенное состояние (золь) под влиянием пептизаторов ‒ б) адсорбция
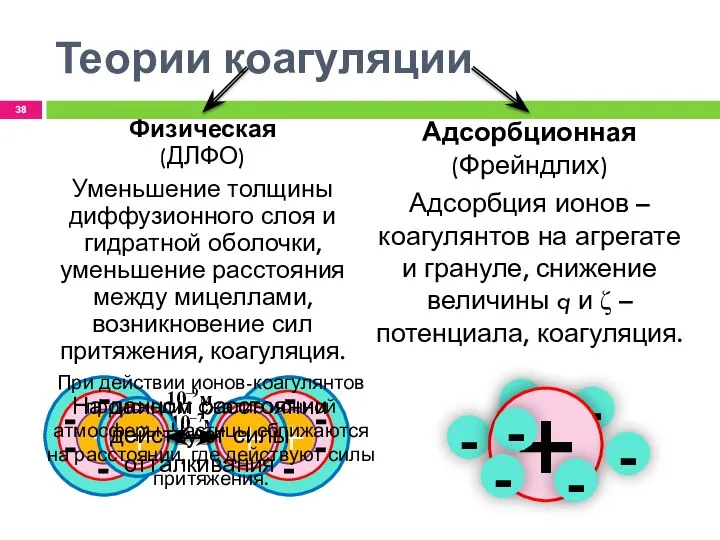
- 38. - - - Теории коагуляции Адсорбционная (Фрейндлих) Адсорбция ионов – коагулянтов на агрегате и грануле, снижение
- 40. Скачать презентацию







![Мицелла {m[BaSO4] • nBa2+ (2n – x)Cl–}x+ • xCl– агрегат адсорбционный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304799/slide-13.jpg)
![Возникновение ДЭС и потенциалов в мицелле {m[BaSO4] • nBa2+ (2n –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304799/slide-15.jpg)














 Сущность валютного рынка. Классификация валютных рынков. Особенности функционирования рынка FOREX. Современные тенденции развития
Сущность валютного рынка. Классификация валютных рынков. Особенности функционирования рынка FOREX. Современные тенденции развития  Подпрограммы и ввод
Подпрограммы и ввод коллекция русских икон
коллекция русских икон Урок по теме «Применение производной в естествознании». 11 класс
Урок по теме «Применение производной в естествознании». 11 класс  Презентация "Средневековье. Готика." - скачать презентации по МХК
Презентация "Средневековье. Готика." - скачать презентации по МХК Театральная педагогика в школе
Театральная педагогика в школе  Античная культура
Античная культура Hobbies and interests
Hobbies and interests Презентация____
Презентация____ Игра-лотерея «Религия и культура»
Игра-лотерея «Религия и культура» Курсы по тестированию IT LABS. Баг. (Урок 3)
Курсы по тестированию IT LABS. Баг. (Урок 3) Музейная педагогика в дошкольном образовании в свете Федеральных государственных требований Е. В. Францужан, методист НМЦ Невс
Музейная педагогика в дошкольном образовании в свете Федеральных государственных требований Е. В. Францужан, методист НМЦ Невс Бактериофагия
Бактериофагия  Алгебраические дроби Основное свойство дроби Сокращение дробей - презентация по Алгебре_
Алгебраические дроби Основное свойство дроби Сокращение дробей - презентация по Алгебре_ Великие люди Германии. В рамках внеклассных мероприятий «Путешествия по Германии»
Великие люди Германии. В рамках внеклассных мероприятий «Путешествия по Германии» «Папа, мама, я – спортивная семья». Спортивный праздник средняя школа №29
«Папа, мама, я – спортивная семья». Спортивный праздник средняя школа №29 Алгоритм и его исполнение
Алгоритм и его исполнение живопись византии
живопись византии Специзмерения системах автоматики и телемеханики
Специзмерения системах автоматики и телемеханики Современная организация школьного питания в МБОУ «СОШ № 59» г. Чебоксары
Современная организация школьного питания в МБОУ «СОШ № 59» г. Чебоксары Лесные ресурсы Подготовили: Студенты 1 курса Фтд-1204 Кондратьев А. Лаптев А.
Лесные ресурсы Подготовили: Студенты 1 курса Фтд-1204 Кондратьев А. Лаптев А. Портфолио ученика начальной школы Рекомендации для учеников и родителей (Составлены учителем начальных классов Салыховой И.А.)
Портфолио ученика начальной школы Рекомендации для учеников и родителей (Составлены учителем начальных классов Салыховой И.А.) Урок МХК 8 класс
Урок МХК 8 класс Экономическая игра «Юный экономист»
Экономическая игра «Юный экономист» Аналитическая обработка информации. Оформление результатов анализа
Аналитическая обработка информации. Оформление результатов анализа Жостовские подносы
Жостовские подносы Поняття нації
Поняття нації Ошибки при разработке Или как сделать курс красивым?
Ошибки при разработке Или как сделать курс красивым?